МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ УКРАИНЫ
СЕВЕРОДОНЕЦКИЙ ТЕХНОЛОГИЧЕСКИЙ ИНСТИТУТ
Кафедра “Технологии неорганических веществ и экологии”
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
к курсовому проекту по дисциплине
“Химическая технология неорганических веществ”
на тему: Стадия синтеза аммиака
Проектировал студент группы __________ _________________
(шифр) (фамилия, инициалы)
Руководитель проекта___________ _________________
(должность) (фамилия, инициалы)
Проект защищен на оценку _____________________________________
Комиссия:
_______________ _________________
(должность) (фамилия, инициалы)
____________________ ______________________
(должность) (фамилия, инициалы)
____________________ ______________________
(должность) (фамилия, инициалы)
Зав. кафедрой ________________ _________________
(фамилия, инициалы)
г. Северодонецк 2006
Содержание
Введение...................................................................................................................3
1 КРАТКИЙ АНАЛИТИЧЕСКИЙ ОБЗОР С ОБОСНОВАНИЕМ МЕТОДА ПРОИЗВОДСТВА 5
1.1 Технологические схемы производства аммиака из природного газа. 5
1.2 Технологический процесс фирмы “Kellogg”. 5
1.3 Аппарат риформинга с газовым обогревом (GHR). 7
1.4 Технологическая схема процесса AMV. 8
2 ХАРАКТЕРИСТИКА СЫРЬЯ, ПОЛУФАБРИКАТОВ, ГОТОВОЙ ПРОДУКЦИИ.. 10
3 НОВЫЕ ТЕХНИЧЕСКИЕ РЕШЕНИЯ, ПРИНЯТЫЕ В ПРОЕКТЕ.. 12
4 ОПИСАНИЕ ТЕХНОЛОГИЧЕСКОЙ СХЕМЫ... 13
5 МАТЕРИАЛЬНЫЕ И ТЕПЛОВЫЕ БАЛАНСЫ... 18
5.1 Материальный баланс цикла синтеза аммиака. 18
5.2 Тепловой баланс цикла синтеза аммиака. 27
6 ВЫБОР И РАСЧЕТ ОСНОВНОГО АППАРАТА.. 32
6.1 Технологический расчет. 32
6.2 Механические расчеты.. 34
6.2.1 Определение толщины стенки сварной цилиндрической. 34
обечайки, работающей под внутренним давлением.. 34
6.2.2 Расчет толщины стенки верхнего стандартного. 35
отбортованного эллиптического днища. 35
6.2.3 Расчет толщины стенки стандартного отбортованного. 37
сферического днища. 37
7 ПРИМЕНЕНИЕ ЭВМ В КУРСОВОМ ПРОЕКТИРОВАНИИ.. 39
8 КОНТРОЛЬ РАБОТЫ, НОРМЫ И ПРАВИЛА ОБСЛУЖИВАНИЯ ГЛАВНОГО АППАРАТА 40
9 ВЫБОР ВСПОМОГАТЕЛЬНОГО ОБОРУДОВАНИЯ.. 42
10 РЕСУРСОСБЕРЕЖЕНИЕ И ОХРАНА ОКРУЖАЮЩЕЙ СРЕДЫ... 44
10.1 Мероприятия направленные на снижение энергоемкости. 44
агрегата. 44
10.2 Охрана окружающей среды.. 44
10.2.1 Мероприятия, направленные на снижение выбросов в. 44
атмосферу и водоемы.. 44
10.2.2 Экологические проблемы производства и методы их. 45
решения. 45
Выводы.. 46
Список использованной литературы.. 47
Реферат
Курсовой проект состоит из 50 страниц машинописного текста, включает 9 таблиц, использовано 10 литературных источников.
Графическая часть проекта – 2 листа.
АММИАК, ПРОДУВОЧНЫЕ И ТАНКОВЫЕ ГАЗЫ, СИНТЕЗ АММИАКА, АЗОТОВОДОРОДНАЯ СМЕСЬ, МЕМБРАННОЕ РАЗДЕЛЕНИЕ, МАТЕРИАЛЬНЫЙ БАЛАНС, ТЕПЛОВОЙ БАЛАНС.
В курсовой работе рассмотрены сферы использования аммиака в различных отраслях промышленности и сельского хозяйства. Дан краткий обзор истории получения аммиака, проанализированы причины и трудности, возникающие при синтезе аммиака.
Представлен аналитический обзор современных методов получения аммиака. Произведен расчет главного аппарата, дана характеристика сырья полуфабрикатов и готовой продукции, рассмотрены вопросы охраны окружающей среды. Несмотря на эффективный способ получения аммиака, остается еще много нерешенных проблем. В курсовой работе предлагается новое техническое решение одной из них.
В основу курсового проекта поставлена задача усовершенствования процесса извлечения водорода в процессе переработки продувочных газов.
Итогом внедрения нового решения стало сокращение энергозатрат на процесс за счет снижения расхода природного газа, используемого в качестве топлива, и уменьшение расхода технологического газа на 2.0÷2.5%. Возможно, также повышение производительности агрегата примерно на 5% при сохранении расхода природного газа.
ВВЕДЕНИЕ
Соединения азота играют исключительно важную роль в жизни на Земле, поскольку они являются составной частью всех белковых соединений и находят широкое применение во всех областях деятельности человека. Азот – один из наиболее распространенных элементов в земной коре (около 0,04%), а содержание его в воздухе составляет 78% (об.). Однако ввиду большой прочности связей в молекуле азота проблема получения его соединений искусственным путем была решена сравнительно недавно.
Впервые чистый аммиак был получен в 1774 Дж. Пристли. Промышленную технологию получения аммиака разработали и осуществили в 1913 немцы Ф. Габер и К. Бош, получившие за свои исследования Нобелевские премии.
В настоящее время основным промежуточным продуктом для получения огромного числа различных азотсодержащих соединений является аммиак, а его синтез из водорода и азота по реакции:
N2 + 3H2 = 2NH3 + Q
единственным крупномасштабным методом производства этого важнейшего продукта.
В частности, соединения азота имеют исключительно большое значение для всего народного хозяйства. В связи с этим азотная промышленность по темпам развития опережает другие подотрасли химической промышленности.
В промышленности аммиак используют при получении азотной кислоты HNO3 (все промышленные способы получения азотной кислоты основаны на контактном окислении аммиака кислородом воздуха), в производстве азотных минеральных удобрений (практически все азотные удобрения получают на основе синтетического аммиака), в качестве хладагента. Аммиачная вода является азотным удобрением. Нашатырный спирт используют в медицине.
Современное производство синтетического аммиака состоит из ряда последовательных технологических стадий, сосредоточенных в отдельных блоках: сероочистки природного газа, конверсии метана, конверсии СО, очистки синтез-газа от СО2, метанирования, компрессии, синтеза аммиака, объединенных по технологическому принципу и, кроме того, по энергетическому – единой системой парового цикла.
Характерной особенностью блока отделения синтеза аммиака является то, что здесь образуется и выделяется жидкий аммиак – товарный продукт. От остальных стадий синтез аммиака отличается применением высокого давления, наличием циркуляционного газового контура, использованием холода. На этой стадии выделяется и утилизируется наибольшее количество реакционного тепла. Блок синтеза характеризуется применением сложной и разнообразной реакционной и теплообменной аппаратуры, для изготовления которой используются высококачественные стали. По капитальным затратам он один из самых весомых в аммиачном производстве. Выбор технологических схем, аппаратурного оформления и экономические показатели производства аммиака во многом определяются свойствами катализаторов синтеза: его активностью, стабильностью, механической прочностью, в связи с чем к качеству катализатора предъявляют самые высокие требования [1].
1 КРАТКИЙ АНАЛИТИЧЕСКИЙ ОБЗОР С ОБОСНОВАНИЕМ МЕТОДА ПРОИЗВОДСТВА
1.1 Технологические схемы производства аммиака из природного газа
В данном разделе рассмотрены две технологические схемы производства аммиака из природного газа.
Первая схема выполнена по проекту фирмы “Kellogg”, и разработка и внедрение ее относится к 70 годам. Для удобства сохраняются обозначения оборудования и основных потоков такими, как было принято у фирмы. Эти обозначения свойственны и всем последующим проектам фирмы “Kellogg”. Большинство агрегатов в Украине и странах СНГ выполнены и работают именно на основе этого базового проекта.
Вторая технологическая схема - это схема агрегата АМ-76, выполненная по проекту ГИАП (г. Москва). Здесь в описании схемы также сохраняются фирменные обозначения.
В моментах, где дизайн обоих проектов совпадает в аппаратурном и технологическом отношениях, будет рассматриваться схема на основе проекта фирмы “Kellogg”. Отличия проекта ГИАП будут в этом случае рассматриваться особо.
Оба проекта выполнены по, так называемой, энерготехнологической схеме. Потребность в энергии (пар) обеспечивается, в основном, за счет утилизации тепла реакций [2].
1.2 Технологический процесс фирмы “Kellogg”
Предлагаемый технологический процесс предусматривает производство 1360 т/сутки жидкого безводного аммиака из природного газа. Проектом предусмотрена выдача продукционного аммиака при (+5)°С или (-33)°С.
Основные стадии процесса.
- Гидрирование сераорганических соединений, содержащихся в природном газе, в сероводород на кобальтмолибденовом катализаторе.
- Поглощение сероводорода поглотителем на основе оксида цинка.
- Первичный риформинг очищенного от сернистых соединений природного газа в трубчатой печи при давлении равном 33,1 кгс/см2 изб.
- Конверсия остаточного метана, содержащегося в частично конвертированном газе после первичного риформинга, в водород и оксид углерода при повышенных температурах. Стадия вторичного риформинга это стадия, на которой в систему подаётся воздух для подготовки синтез-газа с необходимым стехиометрическим соотношением азот: водород.
- Высоко- и низкотемпературная конверсия оксида углерода с одновременным получением эквивалентных количеств водорода.
- Очистка конвертированного газа от диоксида углерода по методу “Карсол”. Этот процесс представляет собой контакт синтез-газа с горячим модифицированным раствором поташа.
- Метанирование остаточного количества оксида и диоксида углерода для получения очищенного синтез-газа с содержанием оксидов углерода не более 10 ppm.
- Компримирование очищенного синтез-газа до 331 кгс/см2 изб. с применением центробежного турбокомпрессора.
- Конверсия синтез-газа в аммиак при 321,7 кгс/см2. Выделение и захолаживание продукционного аммиака.
В проекте агрегата АМ-76 для очистки конвертированного газа от диоксида углерода применяется моноэтаноламиновая очистка.
Печь риформинга как в проекте фирмы “Kellogg”, так и в проекте ГИАП (г. Москва) рассчитана для работы при давлении 33,1 кгс/см2 изб. на выходе из реакционных труб
Система, рекуперирующая тепло реакций, как в проекте фирмы “Kellogg”, так и в проекте ГИАП (г. Москва) АМ-76, предусматривает генерирование пара при давлении 105,5 кгс/см2 изб. При этом уровне давления пар перегревается и используется для технологических нужд в процессе конверсии и для привода турбин компрессорного и насосного оборудования. Для поддержания баланса агрегата по пару служит вспомогательный котел. При проведении начальных стадий пусковых операций и заключительных стадий остановок служит пусковой котел.
Обоими проектами предусматривается оборудование для очистки технологического конденсата от растворенного аммиака, диоксида углерода и других компонентов. В дальнейшем очищенный, в так называемой отпарной колонне, технологический конденсат возвращается для использования в технологии.
Действующие на этих системах адсорбционный, абсорбционный и криогенный способы извлечения водорода из продувочных газов имеют ряд существенных недостатков (прежде всего большие капитальные и эксплуатационные затраты) и, кроме процесса низкотемпературной ректификации, не нашли широкого промышленного применения. Совершенно новые перспективы в этой области открылись с разработкой мембранных методов разделения газов.
1.3 Аппарат риформинга с газовым обогревом (GHR).
Одним из новых решений в производстве аммиака является применение нового аппарата риформинга [3].
Конвертированный газ, выходящий из вторичного риформинга с температурой примерно 900°С, охлаждается в GHR, отдавая тепло для реакции первичного риформинга. При этом газ проходит через зону, в которой может образовываться металлическая щель. Это происходит в результате коррозии при миграции углерода в поверхность металла. Образование углерода термодинамически выгодно при пониженных температурах и подавляется при очень высоких температурах (обычно более 800°С для отходящего газа вторичного риформинга). Ниже 500°С скорость образования углерода мала и проблем не возникает. При конструировании GHR фирма “ICI” много внимания уделила проблеме возможного образования углерода и “пыления” металла. Были подобраны специальные материалы и сплавы, интенсифицирован теплообмен с помощью “труб-оболочек”, которые окружали трубки, содержащие катализатор, разработано специальное оребрение труб и т.д.
При конструировании и разработке реактора вторичного риформинга значительное внимание было уделено минимизации его тепловой инертности. Низкая тепловая инертность способствует быстрому запуску установки, сокращает термически неустойчивые состояния, которые обязательно возникают при запуске, остановке, неисправности системы. Использование катализатора вторичного риформинга с низкой термической инерцией обеспечило простую конструкцию GHR. Катализатор новой конфигурации обеспечивает хорошую конверсию метана, однако, структура катализатора вызывает некоторое увеличение перепада давления вследствие того, что монолиты забиваются пылью и твердыми частицами из технологического газа. Необходимо периодически менять верхнюю часть катализатора.
1.4 Технологическая схема процесса AMV.
Для новых заводов разработаны комплексные процессы, которые включают энергосберегающие усовершенствования, которые трудно внедрить в уже существующие заводы. В качестве примера можно привести процесс Braun Puzifier [4], который в настоящее время используется на нескольких крупных заводах, а также, процесс AMV, предложенный фирмой “ICI”, который внедрен в эксплуатацию мощностью 1120 т/сутки на предприятии Cilinc.
В процессе Braun Puzifier первичный риформинг преднамеренно работает в менее жестких условиях, чем на обычном заводе. Парогазовая конверсия проводится не до 8¸10% содержания метана, а гораздо выше. Это дает возможность экономить топливо для обогрева печи. Для того, чтобы обеспечить конверсию большого количества метана во вторичном риформинге, в реактор подается дополнительное количество воздуха (больше стехиометрических условий) по азоту. Избыточный азот удаляется вместе с аргоном, метаном и другими инертными примесями в криогенной системе непосредственно перед компрессором синтез-газа. Уровень инертов в контуре синтеза, таким образом, гораздо ниже, чем на обычном заводе, и продувочный газ снова циркулирует в криогенной системе. Для компенсации более низкой утилизации тепла компрессор технологического воздуха имеет привод от газовой турбины, работающей на обедненной смеси, причем горячий выхлоп этой турбины используется для предварительного подогрева первичного воздуха для горелок печи первичного риформинга.
2 ХАРАКТЕРИСТИКА СЫРЬЯ, ПОЛУФАБРИКАТОВ, ГОТОВОЙ ПРОДУКЦИИ
Данная характеристика представлена в таблицах 1 и 2 [5].
Таблица 1
|
Наименование сырья, материалов, полупродуктов |
Межгосударственный, государственный или отраслевой стандарт, технические условия, регламент или методика |
Показатели, обязательные для проверки (наименование и единицы) |
Регламентированные значения показателей с допустимыми отклонениями |
|
1 |
2 |
3 |
4 |
|
Природный газ |
ГОСТ 5542-87 |
1. Массовая концентрация сернистых соединений, мг/м3 |
Не более 80 |
|
2. Теплота сгорания низшая МДж/ м3 (ккал/ м3) при 20°С, и 101,325 кПа (760 мм.рт.ст.) |
Не менее 31,8 (7600) |
||
|
3. Плотность при 20°С, кг/ м3 |
0,71-0,75 |
||
|
4. Давление избыточное на входе в цех, МПа (кгс/см2) |
Не менее 0,9 (9,0) |
||
|
5. Температура, °С |
От минус 40 до плюс 40 |
||
|
Состав газа в объемных долях % - СН4 |
85.9-98.7 |
||
|
- С2Н6 |
0,15-4,1 |
||
|
- С3Н8 |
0,06-1,5 |
||
|
- С4Н10 |
0,02-0,7 |
||
|
- С5Н12 |
0,0-0,5 |
||
|
- СО2 |
не более 1,5 |
||
|
- Н2 |
0,0-0,6 |
||
|
- N2 |
не более 2,5 |
||
|
Азот газообразный, чистый |
СТП 113-03-26-43-91 |
1. Объемная доля кислорода, % |
Не более 0,02 |
|
2. Массовая концентрация водяных паров, г/м3 |
Не более 0,05 |
||
|
3. Содержание масла |
Отсутствие |
||
|
4. Давление избыточное, МПа (кгс/см2) |
0,2—0,6 (2,0—6,0) |
||
|
Азот газообразный, технический |
СТП 113-03-26-43-91 |
1. Объемная доля кислорода, % |
Не более 3 |
|
2. Содержание масла |
Отсутствие |
||
|
3. Давление избыточное, МПа (кгс/см2) |
0,2—0,6 (2,0—6,0) |
Продолжение таблицы 1
|
1 |
2 |
3 |
4 |
|
||||
|
Азот газообразный , чистый, высокого давления |
СТП 113-03-26—43-91, регламент цеха синтеза метанола |
1. Объемная доля кислорода, % |
Не более 0,02 |
|
||||
|
2. Массовая концентрация водяных паров, г/м3 |
Не более 0,05 |
|
||||||
|
3. Содержание масла |
Отсутствие |
|
||||||
|
4. Давление избыточное, МПа (кгс/см2) |
Не более 31,9 (319) |
|
||||||
|
Катализатор синтеза аммиака, железный, промотированный СА-С |
ТУ 6-05761672.152-96 |
1.Размер зерен, мм:
|
1,5-3 3-7 7-10 10-15 |
|
||||
|
|
|
2.Насыпная плотность, кг/дм3 3.Механическая прочность на раздавливание, МПа, н.м для размеров зерен 1,5-3 и 3-5 для размеров зерен 5-7, 7-10 и 10-15 |
2,5-2,9
10
20 |
|
||||
|
|
|
|
4.Массовая доля, %: FeO калия в пересчете на К2О алюминия в пересчете на Al2O3 кальция в пересчете на СаО кремния в пересчете на SiO2, не более серы в пересчете на SO3, не более |
31-40 0,8-1,2
2,4-3,8 1,9-2,8
0,7
0,015 |
||||
Выпускаемый жидкий технический аммиак должен соответствовать государственному стандарту ГОСТ 6221-90, основные технические показатели которого приведены в таблице.
Таблица 2
Характеристика товарного аммиака
|
Наименование показателей |
Нормы для марок |
||
|
А |
Ак |
Б |
|
|
1. Массовая доля аммиака, %, не менее |
99,90 |
99,6 |
99,6 |
|
2. Массовая доля воды, %, не более |
0,1 |
0,4 |
0,4 |
|
2 |
2 |
8 |
|
1 |
1 |
2 |
3 НОВЫЕ ТЕХНИЧЕСКИЕ РЕШЕНИЯ, ПРИНЯТЫЕ В ПРОЕКТЕ
Одним из наиболее эффективных путей совершенствования технологии синтеза аммиака является утилизация продувочных и танковых газов.
При изыскании путей оптимальной утилизации газов необходимо стремиться к комплексному использованию компонентов газовых смесей с учетом их энергетических показателей. Особенно важно полное извлечение из продувочных и танковых газов аммиака как основного продукта.
На основании литературного обзора предлагаю заменить существующий криогенный метод переработки танковых газов при их утилизации на мембранный метод регенерации водорода.
В современных установках для регенерации водорода из продувочных газов ведущие фирмы используют два промышленных процесса: криогенный и селективное прохождение различных газов через мембраны. Регенерация водорода из продувочных газов сокращает энергозатраты на процесс за счет снижения расхода природного газа, используемого в качестве топлива, и уменьшения расхода технологического газа на 2,0¸2,5%. При этом производительность агрегата сохраняется на прежнем уровне. Возможно, также повышение производительности примерно на 5% при сохранении расхода природного газа [2].
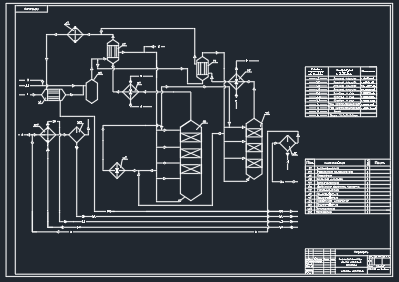
4 ОПИСАНИЕ ТЕХНОЛОГИЧЕСКОЙ СХЕМЫ
Циркуляционный газ после компрессора с температурой не более 5 0С и давлении не более 25,8 МПа и объемной доле аммиака до 3,2% поступает в теплообменник 1Т, где подогревается газом, выходящим из колонны синтеза и прошедшим воздушный холодильник 2Т [5].
Свежий синтез-газ смешивается с циркуляционным газом перед смесителем 3С. Температура смешанного газа должна поддерживаться не менее 40 0С для предотвращения образования карбамата аммония.
Смешанный газ после сепаратора 3С разделяется на два потока. Около 70% смешанного синтез-газа подается в основную колонну синтеза 4К после подогрева до температуры не более 1460С в теплообменнике 5Т. Остальные 30% газа подается в дополнительную колонну синтеза 6К после подогрева до температуры не более 1460С в теплообменнике 7Т.
По конструктивным особенностям теплообменники 1Т, 5Т рассчитаны на разность давления между трубным и межтрубным пространством не более 0,91 МПа.
Основной поток газа, идущего на колонну синтеза 4К через заслонку с дистанционным управлением, поступает в нижнюю часть колонны синтеза и поднимается по кольцевому зазору между корпусом колонны и стенкой катализаторной коробки в верхнюю часть колонны, где расположен теплообменник.
В верхней части колонны исходный газ входит в межтрубное пространство теплообменника входящего и выходящего потоков, где он подогревается, охлаждая продукционный газ.
На выходе из теплообменника входящего и выходящего потоков свежий газ смешивается с газом, выходящим из трубного пространства промежуточного теплообменника колонны.
Затем газ по аксиальной и радиальной траекториям («вовнутрь») проходит первую полку и поступает на вторую полку через кольцевой зазор между катализатором первой полки и вторым кольцевым зазором промежуточного теплообменника.
В кольцевом зазоре газ, прошедший первую полку, охлаждается, смешиваясь с газом, идущим через «холодный» байпас.
Смешанный газ, пройдя вторую полку по аксиальной и радиальной траекториям, поступает в межтрубное пространство промежуточного теплообменника через следующий кольцевой зазор между корпусом трубчатки теплообменника и первым зазором.
Пройдя межтрубное пространство промежуточного теплообменника, газ охлаждается потоком газа, идущего по трубному пространству этого теплообменника от «холодных» байпасов. Нагретый газ от «холодных» байпасов поступает на первую полку, а охлажденный газ из межтрубного пространства промежуточного теплообменника поступает на третью полку. На третьей полке газ также проходит по аксиальной и радиальной траекториям.
После третьей полки газ с температурой не более 5380С и объемной долей аммиака до 17,5% через перфорированную трубу этой полки и далее по центральной трубе поднимается вверх и входит в трубное пространство теплообменника входящего и выходящего потоков, где отдает часть своего тепла газу, идущему в колонну, охлаждаясь при этом до температуры не более 3500С, при давлении не более 25,0 МПа.
Общий объем катализатора, загруженного в колонну синтеза 4К-37,53м3, распределяется по полкам следующим образом:
Фракция Фракция
1,5 ¸3мм 8 ¸12,0мм
1 полка 4,4м3 0,3м3
2 полка 6,15м3 0,28м3
3 полка 26,05м3 0,35м3
Всего 36,6м3 0,93м3
Катализатором является восстановленное промотированное железо. На катализаторе протекает реакция синтеза аммиака:
3Н2 + N2 = 2NH3 + 111,54 кДж/моль
Такое распределение катализатора по полкам произведено с целью поддержания на них оптимальной температуры. Для этого же предназначены и «холодные» байпасы.
Регулирование температур по полкам производится с помощью заслонок с дистанционным управлением.
Газ после 4К поступает в 8Т, где, охлаждаясь, нагревает питательную воду котлов.
После подогревателя питательной воды 8Т газ поступает в теплообменник 5Т, где охлаждается за счет отдачи тепла газу, идущему в колонну.
Основной поток газа, идущего на колонну 6К, через заслонку с дистанционным управлением поступает в нижнюю часть колонны и поднимается по кольцевому зазору между корпусом колонны и стенкой катализаторной коробки в верхнюю часть колонны, где расположен теплообменник входящего и выходящего потоков.
Проходя по межтрубному пространству этого теплообменника, газ нагревается за счет охлаждения газа выходящего из колонны синтеза и поступает на катализатор первой полки. Общий объем катализатора, загруженного в колонну синтеза 6К 16м3, располагается на трех полках.
Количество катализатора на каждой полке:
1 полка 3,0м3 (8160 кг),
2 полка 5,0м3 (13600 кг),
3 полка 8,0м3 (21760 кг)
Всего 16,0м3 (43520 кг).
Для регулирования температуры по полкам колонны смонтированы «холодные» байпасы, по которым газ подается, минуя внутренний теплообменник. Максимальный перепад давления в колонне, зависящий в основном от состояния катализатора, не должен превышать 0,34 МПа.
После третьей полки газ с температурой не более 5380С по центральной трубе поднимается вверх и входит в трубное пространство внутреннего теплообменника, где отдает часть тепла газу, идущему в колонну, охлаждаясь при этом до температуры не более 3330С.
Затем газ поступает в трубное пространство подогревателя питательной воды 9Т, охлаждаясь при этом до температуры не более 1700С.
После подогревателя питательной воды 9Т газ поступает в теплообменник 7Т, где охлаждается за счет отдачи тепла газу, идущему в колонну 6К.
Перед подачей на воздушный холодильник 2Т потоки циркуляционного газа из обеих колонн смешиваются и затем охлаждаются до температуры не более 400С и газ поступает в межтрубное пространство теплообменника 1Т, где охлаждается до температуры не более 330С, нагревая газ, идущий в колонну синтеза после сепаратора 3С.
Далее газ направляется в аммиачный холодильник, где охлаждается до температуры не более 19¸330С подачей жидкого аммиака в.
Окончательное охлаждение циркуляционного газа осуществляется в аммиачном холодильнике до температуры 0- минус 100С подачей жидкого аммиака.
В первичном сепараторе 10С из газа отделяется образовавшийся в колоннах синтеза 4К и 6К аммиак. Отделившийся аммиак отводится в сборник жидкого аммиака.
После сепаратора 10С газ направляется на всас циркуляционной ступени компрессора синтез-газа.
Таким образом, замыкается цикл циркуляционного газа в системе синтеза.
После первичного сепаратора 10С часть циркуляционного газа постоянно выводится из системы в количестве, объемную долю инертов (метан, аргон) в газе на входе в колонну не более 10,6% и 6% соответственно.
5 МАТЕРИАЛЬНЫЕ И ТЕПЛОВЫЕ БАЛАНСЫ
5.1 Материальный баланс цикла синтеза аммиака
Материальный баланс выполнен для колонны синтеза аммиака [6].
Исходные данные.
Синтез осуществляется под давлением 304*105 Па
(300атм) при 5000С. 1 атм. – 101300 Па
по реакции:
3Н2 + N2 = 2NH3 + 111,54 кДж/моль
Состав свежего газа:
Н 2 = 74.85%,
N2 = 24.95%,
инертных газов* = 0.2%об.
*Для упрощения условно принимаем, что они состоят только из СН4.
Концентрация инертных газов в продувочном газе не более 3%.
Расчет ведем на 1000м3 свежей АВС:
Н2 – 748.5 м3
N2 – 249.5 м3
СН4 - 2 м3
В цикл синтеза поступает, кмоль:
Н2 - 748.5/22.4 = 33.42;
N2 - 249.5/22.4 = 11.14;
СН4 - 2/22.4 = 0.09.
Всего: 44.65.
Введем обозначения:
u - количество NH3, полученного в конденсаторах, кмоль;
v - количество NH3, сконденсировавшегося при температуре первичной конденсации, кмоль;
w - количество циркулирующих Н2+N2, кмоль;
x - количество NН3, который находится в цикле, кмоль;
y - количество СН4, который находится в цикле, кмоль;
z - количество Н2+N2, выведенных с продувочными газами, кмоль.
Все количество метана (инертных газов), который поступает со свежей смесью АВС должна выводиться из цикла с продувочными газами.
Продувочные газы содержат в себе водород, азот, метан:
z + 0.09 кмоль.
Продувочные газы выводятся после первичной конденсации, поэтому они насыщены аммиаком при 300С, концентрацию которого определяем по формуле:
(5.1)
где Р – давление в аппарате, МПа;
Т – температура в аппарате, оК.
CNH3 = 8.1 %об.
Количество аммиака, который отходит с продувочными газами:
Общее количество продувочных газов:
z + 0.09 0.0883z + 0.00794 = 1.0883z + 0.09794.
Поскольку количество метана после первичной конденсации в газе составляет 3%об.(так же как и в продувочном газе), то можно записать:
отсюда z = 1.86 кмоль.
Общее количество продувочных газов:
1.0883*1.86 + 0.09794 = 2.12 кмоль.
Количество аммиака которое удаляется с продувочными газами:
0.0883*1.86 + 0.00794 = 0.172 кмоль.
В 1м3 жидкого NH3 растворяется при 300С в пересчете на н.у.:
H2
N2
где 0.03 и 0.081 концентрация метана и аммиака в газовой смеси, об. доли;
0.07 и 0.075 растворимость Н2 и N2 в м3 на 1 м3 жидкого аммиака при 300С и 1 атм.
При (-5) в сепараторе растворяется в 1 м3 жидкого аммиака:
H2
N2
где 0.043 и 0.048 растворимость Н2 и N2 при (-5)0С;
0.0262 концентрация аммиака (об. доли) в газе после вторичной конденсации (-5)0С, найденной по формуле:
CNH3 = 2.62 %об.
В 1кмоль NH3 растворяется, кмоль:
H2 (14*17)/(22.4*595) = 0.018
N2 (5*17)/(22.4*595) = 0.0065
всего: 0.0245,
где 595 плотность жидкого аммиака при 300С, кг/м3.
При (-5)0С в 1кмоль растворяется, кмоль:
H2 (9.3*17)/(22.4*645) = 0.011
N2 (3.47*17)/(22.4*645) = 0.0041
всего: 0.0151
где 645 плотность жидкого аммиака при (-5)0С, кг/м3.
Количество Н2 и N2, растворенных в жидком аммиаке, кмоль:
после первичной конденсации -v*0.0245
после вторичной конденсации -(u - v)*0.0151
Количество газовой смеси (кмоль) на выходе из колонны синтеза равняется сумме Н2 + N2 + NH3 + CH4, которая постоянно находится в цикле, плюс аммиак, образованный в колонне, плюс продувочные газы и Н2 + N2, растворенные в жидком аммиаке после первичной конденсации:
w + x + y + u + 1.0883z + 0.09794 + 0.0245v.
В этой смеси находится аммиака, кмоль:
x + u + 0.0883z + 0.00794.
Концентрация аммиака в газе, об. долях:
, (5.2)
Концентрацию аммиака после колонны синтеза находим по формуле:
где СNH3 - концентрация аммиака при равновесии, % об.
Р - общее давление газа, атм.
Для этого находим значение при 5000С по уравнению (5.3):
где рN2, рН2, рNH3 - парциальное давление газов, атм.
201.
Решая уравнение:
находим СNH3 = 26.2 %об.
Так как по условиям равновесие достигается на 0.6, то действительная концентрация NH3 в газе равняется:
СNH3 = 26.2*0.6 = 15.7%об.
Подставляя в уравнение (2.2) значения СNH3 = 0.157 и z = 1.86, находим:
(5.4)
или
0.843(x + u) – 0.157(w + y) – 0.00385v – 0.161 = 0. (5.5)
После первичной конденсации количество газовой смеси уменьшается вследствие выделения части аммиака и растворенных в нем Н2 и N2, которая составляет, кмоль:
w + x + y + u + 1.0883z + 0.09794 - v – 0.0245v
или
w + x + y + u + 2.12 – 1.0245v.
В этой смеси находится аммиака:
u - v + x + 0.0883z + 0.00794
или
u - v + x + 0.172.
Это составляет в соответствии с предыдущим 8.1 % об. NH3.
Таким образом, можно записать:
или
0.919(u + x) – 0.081(w + y) – 0.0917v = 0. (5.6)
Перед циркуляционным компрессором, т.е. после продувки, количество газовой смеси составляет, кмоль: w + x + y + u - v.
В этой смеси содержится у (кмоль) СН4, что составляет 3% об. Таким образом:
или
w + x + u - v – 32.3y = 0. (5.7)
После циркуляционной ступени к газовой смеси прибавляют свежую АВС в количестве 44.65 кмоль; общее количество газов составляет, кмоль:
w + x + y + u - v + 44.65.
После вторичной конденсации выделяется (u - v) кмоль NH3, в котором растворено 0.0151(u - v) кмоль азота и водорода. В связи с этим, после вторичной конденсации ( или, то же самое, на входе в колонну синтеза) количество газа равняется, кмоль:
v + x + y + 44.65 – 0.0151(u - v).
Раньше было найдено, что концентрация аммиака в этой смеси составляет 2.62% об. Значит:
или
w + y – 0.0151(u - v) – 37.2x + 44.65 = 0.
При образовании аммиака в колонне синтеза количество смеси уменьшается на u + 0.172 кмоль, значит, из колонны синтеза выходит газа, кмоль:
w + x + y + 44.65 – 0.0151(u - v) - u – 0.172,
где 0.172 количество аммиака в продувочных газах, кмоль.
С другой стороны, раньше было найдено, что количество газа после колонны синтеза составляет, кмоль:
w + x + y + u + 1.0883z + 0.09794 + 0.0245v.
Приравнивая оба выражения значений количества газа после колонны синтеза, получаем:
42.36 – 2.0151u – 0.0094v = 0. (5.8)
Решая систему полученных уравнений (2.5) – (2.8) находим, кмоль:
u = 20.96; y = 4.5;
v = 13.55; x = 4.94;
w = 134.
В колонну синтеза поступает газа, кмоль:
w + x + y + 44.65 – 0.0151(u - v) = 134 + 4.94 + 44.65 – 0.0151(20.96 – 13.55) = 187.98.
Из них: кмоль %об.
NH3 4.94 2.62
СН4 4.5 + 0.09 = 4.59 2.44
H2 + N2 187.98 -(4.94 + 4.59) = 178.45.
Количество газа на выходе из колонны, кмоль:
w + x + y + 44.65 – 0.0151(u - v) - u – 0.172 = 134 + 4.94 + 4.5 + 44.65 -
- 0.0151(20.96 – 13.55) – 20.96 – 0.172 = 166.85.
Из них: кмоль %об.
NH3 4.94 + 20.96 + 0.172= 26.072 15.7
СН4 4.59 2.75
H2 + N2 166.85 - (26.072 + 4.59) = 136.188
Конденсируется аммиака, кмоль:
после первичной конденсации 13.55
после вторичной конденсации 20.96 – 13.55 = 7.41
В жидком аммиаке растворяется АВС, кмоль:
после первичной конденсации 0.0245*13.55 = 0.33
после вторичной конденсации 0.0151*7.41 = 0.11
Превращается АВС:
44.65 – 1.86 – 0.33 – 0.11 – 0.09 = 42.26 кмоль.
Составим таблицу материального баланса цикла синтеза аммиака (на 1000м3 свежего газа).
Таблица 3
Таблица материального баланса
|
Компонент |
Статья |
Приход, |
Расход, |
|||
|
кмоль |
кмоль |
|||||
|
|
|
|
|
|
|
|
|
H2 + N2 |
вводится со свежей АВС |
|
44.65 |
- |
||
|
|
выводится из цикла с про- |
|
|
|
||
|
|
дувочными газами |
|
|
- |
1.86 |
|
|
|
растворяется в жидком аммиаке |
|
|
|||
|
|
в 1 конденсации |
|
|
- |
0.33 |
|
|
|
во 2 конденсации |
|
- |
0.11 |
||
|
|
циркулирует в системе |
|
134.0 |
134.0 |
||
|
|
превращается в аммиак |
|
|
42.26 |
||
|
|
Всего: |
178.65 |
178.56 |
|||
|
|
|
|
|
|
|
|
|
NH3 |
образуется в колонне |
|
21.13 |
- |
||
|
|
выделяется в сепараторе |
|
|
|
||
|
|
в 1 конденсации |
|
|
- |
13.55 |
|
|
|
во 2 конденсации |
|
- |
7.41 |
||
|
|
выводится с продувочными газами |
- |
0.172 |
|||
|
|
циркулирует в системе |
|
4.94 |
4.94 |
||
|
|
Всего: |
26.07 |
26.072 |
|||
|
|
|
|
|
|
|
|
|
СН4 |
вводится с АВС |
|
|
0.09 |
- |
|
|
|
циркулирует в системе |
|
4.50 |
4.50 |
||
|
|
выводится с продувочными газами |
- |
0.09 |
|||
|
|
Всего: |
4.59 |
4.59 |
|||
Таким образом, образуется всего 21.13 кмоль NH3, из которых 20.96 кмоль выводится в виде продукта, а 0.712 кмоль теряется с продувочными газами. Потеря NH3 полученного составляет: (0.172/21.13)*100 = 8.15%.
Из 1000 м3 начального газа в аммиак превращается 42.26 кмоль Н2 и N2, что составляет от свежей АВС (за исключением метана):
(42.26/44.56)*100 = 95%.
На получение товарного аммиака затрачивается АВС:
20.96*2 = 41.92 кмоль;
(41.92/44.56)*100 = 94%.
Теряется АВС: на продувку: (1.86/44.56)*100 = 4.2%
на получение аммиака, выделенного с продувочными газами:
[(0.172*2)/44.56]*100 = 0.8%
растворяется в жидком аммиаке: (0.44/44.56)*100 = 1.0%
Всего: 6.0%
На получение 1000 кг NH3 нужно свежей АВС:
(1000*1000)/(20.96*17) = 2800 м3.
При годовой производительности аммиака 540000 т/год часовая производительность будет следующая:
540000/8240 = 65.5 т/час,
где 8240 – количество рабочих часов в году.
Для этого необходимо свежей АВС:
2800*65.5 = 183400м3.
Таким образом, материальный баланс в пересчете на часовую производительность представлен в таблице.
Таблица 4
Таблица материального баланса
|
Компонент |
Статья |
Приход, |
Расход, |
||
|
кмоль/ч |
кмоль/ч |
||||
|
1 |
2 |
3 |
4 |
||
|
H2 + N2 |
вводится со свежей АВС |
|
8188.81 |
- |
|
|
|
выводится из цикла с про- |
|
|
|
|
|
|
дувными газами |
|
|
- |
341.124 |
|
|
растворяется в жидком аммиаке |
|
|
||
|
|
в 1 конденсации |
|
|
- |
60.522 |
|
|
во 2 конденсации |
|
- |
20.174 |
|
|
|
циркулирует в системе |
|
24575.6 |
24575.6 |
|
|
|
превращается в аммиак |
|
|
7750.484 |
|
|
|
Всего: |
32764.41 |
32747.904 |
||
|
NH3 |
образуется в колонне |
|
3875.242 |
- |
|
|
|
выделяется в сепараторе |
|
|
|
|
|
|
в 1 конденсации |
|
|
- |
2485.07 |
|
|
во 2 конденсации |
|
- |
1358.994 |
|
|
|
выводится с продувочными газами |
- |
31.545 |
||
|
|
циркулирует в системе |
|
905.996 |
905.996 |
|
|
|
Всего: |
4781.238 |
4781.6048 |
||
|
СН4 |
вводится с АВС |
|
|
16.506 |
- |
|
|
циркулирует в системе |
|
825.30 |
825.30 |
|
|
|
выводится с продувочными газами |
- |
16.506 |
||
|
|
Всего: |
841.806 |
841.806 |
||
5.2 Тепловой баланс цикла синтеза аммиака
Исходные данные:
температура входа 1410С,
температура выхода 3500С;
теплоемкости веществ представлены таблицей:
Таблица 5
Таблица теплоемкостей веществ
|
В-во |
Теплоемкость, |
|
кДж/(кмоль*град) |
|
|
Н2 |
28.851 |
|
N2 |
29.144 |
|
CH4 |
35.63 |
|
NH3 |
35.59 |
Уравнение химической реакции:
N2 + 3Н 2 = 2NH3
На основании материального баланса составим тепловой баланс процесса согласно основной формулы:
ΣQвх = ΣQвых, (5.9)
где ΣQвх - общее количество тепла , что вносится в аппарат со всеми материальными потоками, а также тепло которое выделяется или поглощается в результате протекания химической реакции или физических процессов, кДж/ч;
ΣQвых - общее количество тепла, что выносится из аппарата со всеми материальными потоками, расходуется на нагревание частей аппарата, а также потеря тепла в атмосферу, кДж/ч.
Соответственно:
ΣQвх = Q1 + Q2 + Q3, (5.10)
где Q1 - теплота, что вносится в аппарат со всеми физическими потоками, кДж/ч;
Q2 - тепло которое необходимо подвести или отвести, кДж/ч;
Q3 - общее тепло, что выделяется или поглощается в результате протекания химических или физических процессов, что происходят в аппарате, кДж/ч.
ΣQвых = Q4 + Q5, (5.11)
где Q4 - тепло, что выносится из аппарата со всеми физическими потоками, кДж/ч.
Q5 - потеря тепла в атмосферу, кДж/ч.
Значения Q1 и Q4 можно определить по формуле:
Q1(4) = Σnі*Cpі*tі, (5.12)
где nі - мольный расход потока, кмоль/ч.
Срi - удельная теплоемкость і-го компонента, кДж/(кмоль*К);
ti - температура потока в котором находится і-й компонент, 0С.
Q1 = Q1(N2+H2)+Q1(NH3)+Q1(CH4)
Q1(N2+H2) = Q1(N2+H2)1+Q1(N2+H2)2, (5.13)
где Q1(N2 +H2)1 - тепло вводимое со свежей АВС, кДж/ч,
Q1(N2 + H2)2 - тепло смеси циркулирующей в системе, кДж/ч.
Q1(N2 + H2)1 = (8188.81*1/4*29.144+8188.81*3/4*28.851)*141 =
= 33396581 кДж/ч.
Q1(N2 + H2)2 = (24575.6*1/4*29.144+24575.6*3/4*28.851)*141 =
= 100227143 кДж/ч.
Q1(N2 + H2) = 33396581+100227143 = 133623724 кДж/ч.
Q1(NH3) = Q1(NH3)1+Q1(NH3)2, (5.13)
где Q1(NH3)1 - тепло аммиака образовавшегося в колонне, кДж/ч,
Q1(NH3)2 - тепло аммиака циркулирующего в системе, кДж/ч.
Q1(NH3)1 = 3875.242*35.59*141 = 19446701 кДж/ч.
Q1(NH3)2 = 905.996*35.59*141 = 4546460 кДж/ч.
Q1(NH3) = 19446701+4546460 = 23993161 кДж/ч.
Q1(CH4) = Q1(CH4)1+Q1(CH4)2, (5.14)
где Q1(CH4)1 - тепло инертов вводимых с АВС, кДж/ч,
Q1(CH4)2 - тепло инертов циркулирующих в системе, кДж/ч.
Q1(CH4)1 = 16.506*35.63*14 = 82923 кДж/ч.
Q1(CH4)2 = 825.3*35.63*141 = 4146167 кДж/ч.
Q1(CH4) = 82923+4146167 = 4229090 кДж/ч.
Q1 = 133623724+23993161+4229090 = 161845975 кДж/ч.
Q4 = Q4(N2+H2)+Q4(NH3)+Q4(CH4)
Q4(N2+H2) = Q4(N2+H2)1+Q4(N2+H2)2+Q4(N2+H2)3+Q4(N2+H2)4+
+Q4(N2+H2)5, (5.15)
где Q4(N2+H2)1- тепло АВС, вводимой с продувочными
газами, кДж/ч,
Q4(N2+H2)2 - тепло АВС, растворенной в жидком аммиаке,
при 1-ой конденсации, кДж/ч,
Q4(N2+H2)3 - то же при 2-ой конденсации, кДж/ч,
Q4(N2+H2)4 - тепло смеси циркулирующей в системе, кДж/ч,
Q4(N2+H2)5 - тепло АВС превращенной в аммиак, кДж/ч.
Q4(N2+H2)1 = (341.124*1/4*29.144+341.124*3/4*28.851)*350 =
= 3453365 кДж/ч,
Q4(N2+H2)2 = (60.522*1/4*29.144+60.522*3/4*28.851)*350 =
= 612694 кДж/ч,
Q4(N2+H2)3 = (20.174*1/4*29.144+20.174*3/4*28.851)*350 =
= 204231 кДж/ч,
Q4(N2+H2)4 = (24575.6*1/4*29.144+24575.6*3/4*28.851)*350 =
= 248790779 кДж/ч,
Q4(N2+H2)5 = (7750.484*1/4*29.144+7750.484*3/4*28.851)*350 =
= 78461928 кДж/ч.
Q4(N2+H2) = 3453365+612694+204231+248790779+78461928 =
= 331522997 кДж/ч.
Q4(NH3) = Q4(NH3)1+Q4(NH3)2+Q4(NH3)3+Q4(NH3)4 (5.16)
где Q4(NH3)1 - тепло аммиака выделяющегося в сепараторе при 1-ой конденсации, кДж/ч,
Q4(NH3)2 - то же при 2-ой конденсации, кДж/ч,
Q4(NH3)3 - тепло аммиака выводимого с продувочными газами, кДж/ч,
Q4(NH3)4 - тепло аммиака циркулирующего в системе, кДж/ч.
Q4(NH3)1 = 2485.07*35.59*350 = 30955274 кДж/ч,
Q4(NH3)2 = 1358.994*35.95*350 = 16928309 кДж/ч,
Q4(NH3)3 = 31.545*35.59*350 = 392940 кДж/ч,
Q4(NH3)4 = 905.996*35.59*350 = 11285539 кДж/ч,
Q4(NH3) = 30955274+16928309+392940+11285539 = 59562062 кДж/ч.
Q4(CH4) = Q4(CH4)1+Q4(CH4)2 (5.17)
где Q4(CH4)1 - тепло инертов циркулирующих в системе, кДж/ч,
Q4(CH4)2 - тепло инертов выводящихся с продувочными газами, кДж/ч.
Q4(CH4)1 = 825.3*35.63*350 = 10291904 кДж/ч,
Q4(CH4)2 = 6.506*35.63*350 = 205838 кДж/ч.
Q4(CH4) = 10291904+205838 = 10497742 кДж/ч.
Q4 = 331522997+59562062+10497742 = 401582801 кДж/ч.
Количество тепла, выделяющееся в процессе химического превращения, рассчитывается по формуле:
, (5.18)
где - тепловой эффект химической реакции, кДж/моль,
n - количество вещества принявшее участие в реакции, моль,
а - стехиометрический коэффициент .
Q3 = 82*3875.242*103/2 = 158884922 кДж.
Потери тепла принимаются равными 3% от ΣQвх, тогда:
Q5 = 0.03*(161845975+158884922) = 9621927 кДж/ч.
Далее рассчитываем количество тепла Q2, которое необходимо подвести или отвести по уравнению:
Q2 = Q5+Q4-Q1-Q3
Q2 = 9621927+401582801-161845975-158884922 = 90473831 кДж/ч.
Так как Q2 положительное число, то тепло необходимо подводить в систему.
Полученные данные сведем в таблицу теплового баланса.
Таблица 6
Таблица теплового баланса
|
Компонент |
Статья |
Приход, |
Расход, |
|
кДж/ч |
кДж/ч |
||
|
1 |
2 |
3 |
4 |
|
H2 + N2 |
вводится со свежей АВС |
33396581 |
- |
|
|
выводится из цикла с про- |
|
|
|
|
дувочными газами |
- |
3453365 |
|
|
растворяется в жидком аммиаке: |
|
|
|
|
в 1 конденсации |
- |
612694 |
|
|
во 2 конденсации |
- |
204231 |
|
|
циркулирует в системе |
100227143 |
248790779 |
|
|
превращается в аммиак |
- |
78461928 |
|
|
Всего: |
133623724 |
331522997 |
|
NH3 |
образуется в колонне |
19446701 |
- |
|
|
выделяется в сепараторе: |
|
|
|
|
в 1 конденсации |
- |
30955274 |
|
|
во 2 конденсации |
- |
16928309 |
|
|
выводится с продувочными газами |
- |
392940 |
|
|
циркулирует в системе |
4546460 |
11285539 |
|
|
Всего: |
23993161 |
59562062 |
|
СН4 |
вводится с АВС |
82923 |
- |
|
|
циркулирует в системе |
4146167 |
10291904 |
|
|
выводится с продувочными газами |
- |
205838 |
|
|
Всего: |
4229090 |
10497742 |
|
|
|
|
|
|
|
Тепло выделяющееся в про- |
|
|
|
|
цессе химической реакции |
158884922 |
- |
|
|
|
|
|
|
|
Потери тепла |
- |
9621927 |
|
|
Подводимое тепло |
90473831 |
- |
|
|
ИТОГО: |
411204728 |
411204728 |
На основании расчетов материального и теплового балансов составляем таблицу расходных коэффициентов, которые рассчитаны на 1000 кг/ч целевого продукта.
Таблица 7
Таблица расходных коэффициентов
|
Название сырья, материалов и энергоресурсов |
Единицы измерения |
Расход на единицу товарного продукта |
|
Азот |
кмоль/ч |
93.765 |
|
Водород |
кмоль/ч |
31.255 |
|
Подводимое тепло |
кДж/ч |
1381280 |
6 ВЫБОР И РАСЧЕТ ОСНОВНОГО АППАРАТА
Основной аппарат – колонна синтеза – представляет собой вертикальный цилиндрический аппарат колонного типа, предназначен для синтеза аммиака из азота и водорода. Аппарат изготовлен из низколегированной марганцовистой стали. Режим работы – непрерывный.
6.1 Технологический расчет
Технологический расчет выполнен с использованием литературного источника [7].
Перейдем от часовой производительности к производительности за секунду:
м3/с.
Определим площадь поперечного сечения аппарата в м2 по формуле:
(6.1)
где V – объемная скорость газовой смеси, м3/с,
W – линейная скорость движения газа в аппарате, м/с (для колонных аппаратов принимается равной 3).
м2.
Далее, зная площадь поперечного сечения, определяем диаметр аппарата в м по формуле:
, (6.2)
м.
Необходимый объем катализатора в м3 определим по формуле:
(6.3)
где V’’ – часовая производительность аппарата, м3/ч,
- нагрузка на катализатор по газу, ч-1 (принимается в соответствии с действующим производством).
м3.
Определим высоту слоя катализатора в м, зная его объем и площадь поперечного сечения аппарата, по формуле:
, (6.4)
м.
Зная высоту слоя катализатора, можно определить высоту аппарата в м по формуле:
, (6.5)
где 2.66 – коэффициент, показывающий во сколько раз высота колонны больше высоты катализатора.
м.
Принимаем количество аппаратов равное 2 и с учетом этого пересчитываем размеры аппарата:
м2;
м, выбираем стандартный диаметр аппарата D=3.4м [8];
м;
м.
6.2 Механические расчеты
6.2.1 Определение толщины стенки сварной цилиндрической
обечайки, работающей под внутренним давлением
Расчет толщины стенки обечайки проводится в соответствии с ГОСТ 14249 – 89.
Расчет проводится по следующим исходным данным:
материал обечайки – низколегированная марганцовистая сталь;
прибавка на коррозию – Ск=1.5мм;
рабочее избыточное давление среды Р – 25МПа;
рабочая температура t – 5000С;
внутренний диаметр обечайки D – 3.4м;
высота аппарата H– 15.694м;
стыковой сварной шов, выполненный
автоматической сваркой - φш=1;
поправочный коэффициент - η=0.9.
Номинальное допустимое напряжение для материала обечайки находим по графику (рис.14.1) [9]
σ*д=227 МПа
Допускаемое напряжение определяем по формуле:
σд= η·σ*д , (6.6)
σд=0.9·227=204 МПа.
Определим отношение определяющих параметров σд и Р с учетом коэффициента φш
>5.5.
Номинальную расчетную толщину стенки обечайки для данного отношения согласно табл.15.6 [9] определяем по формуле:
, (6.7)
м
Толщину стенки обечайки с учетом прибавки на коррозию определяем по формуле:
S = S’ + Cк , (6.8)
S = 0.221 + 0.0015 = 0.2225 м
Выбираем стандартную толщину стенки S = 0.224 м.
Проверим условие применимости формулы (6.7)
<0.1,
т.е. условие выполняется, значит формула (6.7) применима.
Допускаемое давление в обечайке определяем по формуле:
, (6.9)
МПа.
Рд≥Р
25.06>25, условие выполняется – расчет выполнен, верно.
6.2.2 Расчет толщины стенки верхнего стандартного
отбортованного эллиптического днища
Расчет толщины стенки днища проводится в соответствии с ГОСТ 14249 – 89.
Исходные данные для расчета:
материал днища – низколегированная марганцовистая сталь;
прибавка на коррозию – Ск=1.5мм;
рабочее избыточное давление среды Р – 25МПа;
внутренний диаметр днища Dв– 3.4м;
диаметр центрального неукрепленного
отверстия d – 0.679м;
стыковой сварной шов, выполненный
автоматической сваркой - φш=1;
допустимое напряжение
для материала днища σд – 204МПа.
Определим коэффициент ослабления днища отверстием по формуле:
, (6.10)
.
Поскольку коэффициент ослабления днища отверстием φ0 меньше коэффициента сварного шва φш, в дальнейшем за расчетное значение коэффициента ослабления принимаем φ = φ0
Определим отношение определяющих параметров σд и Р с учетом коэффициента φ0
>4.5.
Номинальную расчетную толщину стенки днища для данного отношения согласно табл.16.12 [9] определяем по формуле:
, (6.11)
где Rв – внутренний радиус кривизны в вершине днища (для эллиптических стандартных днищ Rв = Dв).
м.
Толщину стенки днища с учетом прибавки на коррозию определяем по формуле:
S = S’ + Cк , (6.12)
S = 0.282 + 0.0015 = 0.2835 м
Выбираем стандартную толщину стенки S = 0.284 м.
Проверим условие применимости формулы (6.11)
<0.125,
т.е. условие выполняется, значит формула (6.11) применима.
Допускаемое давление в днище определяем по формуле:
, (6.13)
МПа.
Рд≥Р
31.3>25, условие выполняется – расчет выполнен верно.
6.2.3 Расчет толщины стенки стандартного отбортованного
сферического днища
Расчет толщины стенки днища проводится в соответствии с ГОСТ 14249 – 89.
Исходные данные для расчета:
материал обечайки – низколегированная марганцовистая сталь;
прибавка на коррозию – Ск=1.5мм;
рабочее избыточное давление среды Р – 25МПа;
внутренний диаметр днища Dв– 3.4м;
стыковой сварной шов, выполненный
автоматической сваркой - φш=1;
допустимое напряжение
для материала днища σд – 204МПа.
Номинальная расчетная толщина стенки днища определяется по формуле:
, (6.14)
где Rв - внутренний радиус кривизны в вершине днища (для для сферических стандартных днищ Rв = Dв/2),
м
Толщину стенки днища с учетом прибавки на коррозию определяем по формуле:
S = S’ + Cк , (6.15)
S = 0.107 + 0.0015 = 0.1085 м
Принимаем толщину днища равную толщине сопряженной с ней обечайки S = 0.224 м.
Допускаемое давление в днище определяем по формуле:
, (6.16)
МПа.
Рд≥Р
50.1>25, условие выполняется – расчет выполнен верно.
7 ПРИМЕНЕНИЕ ЭВМ В КУРСОВОМ ПРОЕКТИРОВАНИИ
Современный уровень программных и технических средств электронной вычислительной техники позволяет перейти от традиционных, ручных методов конструирования к новым информационным технологиям с использованием ЭВМ, создавать системы автоматизации разработки и выполнения конструкторской документации (АКД), удовлетворяющие стандартам ЕСКД как по качеству исполнения документов, так и по соблюдению требований стандартов.
В диалоге с ЭВМ могут быть созданы конструкторские документы (чертежи и схемы) как с использованием, например, графических примитивов типа точка, отрезок, окружность и др., так и фрагментов ранее созданных конструктивных элементов, например, графических изображений стандартных изделий, типовых и унифицированных конструкций, их частей и т.д. С помощью задания значений параметров конструктор может изменить их размеры и геометрическую форму, обеспечивая многовариантность графических изображений и соответственно чертежей и схем. При таком подходе к конструированию использование компьютерной графики не устраняет чертежа как основу конструирования, а компьютер используется как “электронный кульман”, без сомнения облегчающий труд конструктора.
В данном курсовом проекте с использованием программы AutoCAD выполнена технологическая схема стадии синтеза аммиака.
Программа AutoCAD – это универсальный графический пакет для плоского черчения, объёмного моделирования и фотореалистической визуализации, обладающий средствами для извлечения символьной и числовой информации, т.е. это “электронный кульман” [10].
8 КОНТРОЛЬ РАБОТЫ, НОРМЫ И ПРАВИЛА ОБСЛУЖИВАНИЯ ГЛАВНОГО АППАРАТА
Контроль, нормы и правила обслуживания главного аппарата рассмотрены в таблице. [5].
Таблица 8
Контроль, нормы и правила обслуживания главного аппарата
|
Наименование стадий, места измерения параметров или отбора пробы |
Параметр, который контролируется и позиция КИП и А |
Частота и вид контроля |
Нормы |
Методики и средства измерения (контроля, испытаний) |
|
1 |
2 |
3 |
4 |
5 |
|
1. Газ на входе в теплообменник 5Т |
Состав синтез-газа в колонну синтеза 4К в объемных долях, % |
один раз в сутки |
NH3 – не более 3,2 Н2 - 60÷65 СН4 – не более 10,6 N2 – 19,0÷24,0 Аr – не более 6,0 |
Титриметрический метод, методическая инструкция №А – 17 Хроматографический метод. Методическая инструкция №Х -332 |
|
Соотношение водород к азоту |
один раз в сутки |
2,8 – 3,2 |
|
|
|
|
Объемная доля воды при восстановлении катализатора |
Каждые один – четыре часа |
Не более 0,4 |
Конденсационный метод, методическая инструкция №А – 762, №А - 29 |
|
2. На выходе из колонны синтеза аммиака 4К |
Объемная доля аммиака в синтез-газе из колонны синтеза |
один раз в сутки |
13,0÷18,0 |
Титриметрический метод, методическая инструкция №А - 17 |
|
|
Объемная доля воды в синтез-газе из колонны синтеза, % |
При восстановлении катализатора через 0,5÷1ч. |
Не более 0,4 |
Конденсационный метод. Методическая инструкция №А – 762, №А - 29 |
В соответствии с особенностями повреждений и износа составных частей оборудования, а также трудоемкостью ремонтных робот на предприятиях химического комплекса Минпромполитики, как правило, осуществляется проведение следующих видов ремонта:
- текущего;
- капитального.
Как правило, при текущем ремонте выполняются основные работы, перечень которых приводится ниже:
- проведение операций периодического технического обслуживания;
- замена быстроизнашивающихся деталей и узлов;
- ремонт футеровок и противокоррозионных покрытий, окраска;
- замена прокладок, набивок сальников, ревизия арматуры;
- проверка на точность;
- ревизия электрооборудования.
При капитальном ремонте производится частичная, а в случае необходимости и полная разборка оборудования, в объем капитального ремонта входят следующие основные работы:
- объем работ текущего ремонта;
- замена или восстановление всех изношенных деталей и узлов;
- полная или частичная замена изоляции, футеровки, противокоррозионной защиты;
- выверка и центровка машины;
- послеремонтные испытания.
9 ВЫБОР ВСПОМОГАТЕЛЬНОГО ОБОРУДОВАНИЯ
Выбор вспомогательного оборудования выполняется по показателям производства [5]:
Таблица 9
Перечень основного и вспомогательного оборудования технологической схемы
|
Обозначение аппарата |
Наименование оборудования |
Назначение и короткая характеристика |
Материал |
Количество |
|
1 |
2 |
3 |
4 |
5 |
|
4К |
Колонна синтеза аммиака |
Предназначена для проведения реакции синтеза аммиака из азотоводородной смеси Вертикальный цилиндрический многослойный аппарат. |
Низколегированная марганцовистая сталь |
1 |
|
6К |
Дополнительная колонна синтеза аммиака |
Предназначена для проведения реакции синтеза аммиака из азотоводородной смеси Вертикальный цилиндрический многослойный аппарат. |
Низколегированная марганцовистая сталь |
1 |
|
8Т |
Подогреватель питательной воды |
Предназначен для охлаждения циркуляционного газа и подогрева питательной воды. Горизонтальный кожухотрубн ый теплообменник. |
Низколегированная марганцовистая сталь |
3 |
|
9Т |
Подогреватель питательной воды |
Предназначен для охлаждения циркуляционного газа и подогрева питательной воды. Горизонтальный кожухотрубн ый теплообменник. |
Низколегированная марганцовистая сталь |
2 |
|
5Т |
Теплообменник |
Предназначен для подогрева газа, поступающего в колонну синтеза 4К. Горизонтальный кожухотрубный теплообменник. |
Низколегированная сталь |
1 |
|
7Т |
Теплообменник |
Предназначен для подогрева газа, поступающего в колонну синтеза 6К. Горизонтальный кожухотрубный теплообменник. |
Низколегированная сталь |
1 |
|
1Т |
Теплообменник |
Предназначен для подогрева газа, поступающего в колонны синтеза и охлаждения газа, поступающего в аммиачный холодильник. Горизонтальный кожухотрубный аппарат. |
Низколегированная сталь |
1 |
Продолжение таблицы 9
|
1 |
2 |
3 |
4 |
5 |
|
2Т |
Холодильник |
Предназначен для охлаждения циркуляционного газа после межтрубного пространства внутренних теплообменников колон 4К,6К. Воздушный холодильник с вентиляторами. |
— |
1 |
|
10С |
Первичный сепаратор |
Предназначен для отделения жидкого аммиака из газа после колонны синтеза 4К. Горизонтальный цилиндрический аппарат. |
Низколегированная сталь |
1 |
|
3С |
Смеситель |
Предназначен для смешения свежего синтез-газа с циркуляционным газом после 1Т. Вертикальный цилиндрический аппарат. |
Низколегированная сталь |
1 |
|
11Т |
Подогреватель |
Предназначен для подогрева циркуляционного газа при восстановлении и разогреве катализатора. Вертикальный цилиндрический аппарат. |
— |
1 |
|
12Т |
Холодильник |
Предназначен для конденсации аммиака из продувочной системы синтеза аммиака. Горизонтальный кожухотрубный аппарат. |
Низколегированная сталь |
1 |
|
13С |
Сепаратор |
Предназначен для отделения жидкого аммиака. Горизонтальный цилиндрический аппарат. |
Низколегированная сталь |
1 |
10 РЕСУРСОСБЕРЕЖЕНИЕ И ОХРАНА ОКРУЖАЮЩЕЙ СРЕДЫ
10.1 Мероприятия направленные на снижение энергоемкости
агрегата
- Использование водорода в качестве технологического газа, дает экономию природного газа ~1720 нм3/ч или ~27Гкал/ 1тNH3 [5].
- Усовершенствование процесса очистки газа от двуокиси углерода. Экономия энергии 0.371 Гкал/1тNH3.
- Максимальная утилизация тепла дымовых газов и конвертированного газа с дополнительной генерацией пара среднего и низкого давления, для нужд агрегата и частичной выдачей в сеть Р=5 кгс/см2~26 т/ч, экономия энергии ~0.18 Гкал/1тNH3.
- Использование процессного конденсата в качестве питательной воды котлов среднего давления. Этим снижается потребление обессоленной воды из установки деминерализации на 1т аммиака.
10.2 Охрана окружающей среды
10.2.1 Мероприятия, направленные на снижение выбросов в
атмосферу и водоемы
- Исключение сжигания в печи риформинга аммиакосодержащих газов приводит к снижению массовой концентрации окислов азота в дымовых газах.
- Усовершенствование схемы гомогенной очистки дымовых газов от окислов азота.
- Исключение подачи газов дистилляции отпарной колонны, содержащих аммиак, в горелки огневого подогревателя с подачей их в качестве восстановителя на гомогенную очистку.
- Снижение сброса в канализацию загрязненного аммиаком и органическими примесями процессного конденсата с 84 до 36 м3/ч, в связи с использованием его для питания котлов.
10.2.2 Экологические проблемы производства и методы их
решения
На стадии синтеза образуются следующие отходы:
- Продувочные газы – используются на установке мембранного разделения продувочных газов с целью получения водорода. Содержат: Н2 – до 60%, N2 – до 20%, СН4 – до 16%, Аr – до 7%, NH3 – до 4%. Объем 155.3 м3/т.
- Танковые газы системы синтеза аммиака используются в системе топливного газа с целью получения тепла посредством горелок печи и подогревателя, пускового котла или сжигаются на факеле. Состав: Н2 – до 47%, N2 – до 18%, СН4 – до 24.1%, Аr – до 6%, NH3 – до 4.9%. Объем 8.08 м3/т.
- Избыточный водяной пар используется в системе пароснабжения предприятия.
- Катализатор синтеза аммиака поз. 4К, 6К, СА-1,СА-С, СА-1В, СА-СВ – вывозится в хозяйственный цех. Состав: Fe2O3 до 31-40% (0.0479 кг/т), остальное промоторы (0.0096 кг/т).
Выводы
- В данной курсовой работе разработана стадия синтеза в производстве аммиака мощностью 540 тыс.т/год.
- Рассчитаны материальный и тепловой балансы.
- Произведен расчет габаритных размеров основного аппарата: D=3.4м, Н=15.694м, описаны необходимые мероприятия при текущем и капитальном ремонте.
- В проекте принято новое техническое решение, направленное на сокращение энергозатрат на процесс за счет снижения расхода природного газа, используемого в качестве топлива, и уменьшения расхода технологического газа на 2,0¸2,5%.
- Рассмотрены вопросы ресурсосбережения и охраны окружающей среды: методы сокращения энергозатрат при производстве аммиака, а также методы утилизации отходов.
Список использованной литературы
- Кузнецов Л.Д., Дмитренко Л.М., Рабина П.Д., Соколинский Ю.А. Синтез аммиака. – Под редакцией Л.Д.Кузнецова, - М.: Химия, 1982, - 296 с., ил.
- Под общей редакцией Н.А. Янковского. Аммиак. Вопросы технологии. Кол-в авторов. - Донецк: ГИК “Новая печать”, ООО “Лебедь”. 2001. - 497 c. Табл. - 35. Илл. - 66. Библ. - 207 назв.
- The ICI Gas Heated Reformer (GHR) System - К.J. Elkins, I.С. Jeffrej, D. Kitchen and А. Pinto, Nitrogen"91, British Sulphur Conference, Copenhagen, June 1991.
- Патент № 449051 Германия.
- Постоянный технологический регламент цеха аммиака 1-А ЗАО”Северодонецкое объединение Азот”.
- Позин М.Е., Копылев Б.А., Бельченко Г.В., Терешенко Л.Л. Расчеты по технологии неорганических веществ./Под общей редакцией Позина М.Е./ М.,Л.: “Химия”, 1966, с.670.
- Тетеревков Печковский
- Основные процессы и аппараты химической технологии: Пособие по проектированию/ Г.С. Борисов, В.П. Брыков, Ю.И. Дытнерский и др. Под ред. Ю.И. Дытнерского, 2-е изд., перераб. и доплн. М.: Химия, 1991. – 496 с.
- Основы конструирования и расчета химической аппаратуры. Лащинский А.А., Толчинский А.Р., Л., “Машиностроение” 1970 г., 752 стр. Табл. 476. Илл. 418. Библ. 218 назв.
- AutoCAD 14 / Э.Т.Романычева, Т.М.Сидорова, С.Ю.Сидоров. – М.: ДМК, Радио и связь, 1997 – 480 с., ил.
Скачать: