При нападении фитопатогенных грибов эпидермальные клетки листьев травянистых растений часто образуют утолщения (папиллы) непосредственно под ап-прессориямп. Образование папилл обычно ассоциируется с потерей паразитом возможности проникать в ткани хозяина и поэтому считается механизмом устойчивости к прониканию. В этой главе собраны доказательства роли папилл в развитии мучнистых рос и некро-трофных пятнистостей листьев. Облигатно биотрофный характер возбудителя мучнистой росы хорошо пригоден для изучения развития болезни и генетических исследований, тогда как болезни, вызываемые некротрофными паразитами, дают больше информации о физиологии больного растения.
Мучнистая роса злаков
Реакции, следующие за дифференциацией аппрессо-риев Erysiphe graminis (ДС) Merat f. sp. hordei Em. Marshal на поверхности листьев ячменя (Hordeum vulgare L. ), определяют либо развитие внутриклеточных гаусторий, либо невозможность проникания гриба. Обычная ответная реакция хозяина в этот период включает образование цитоплазматических агрегатов, ореолов и папилл в пораженном участке. Значение более ранних реакций, вызываемых безаппрессорными первичными ростковыми трубками, обсуждается в статье Куно.
Агрегирование цитоплазмы, формирование ореолов и утолщение аппрессориев—это неспецифические реакции на химические и микромеханические повреждения. Химические вещества, выделяемые Е. graminis, могут действовать как индукторы этих реакций, способствуя появлению подвижных цитоплазматических агрегатов под ростковыми трубками гриба перед образованием аппрессориев и ответных реакций в клетках, прилегающих к инфицируемой клетке. Ферменты гриба и (или) растворение эпикутнкулярного воскового слоя под аппрессорием также могут быть факторами, запускающими ответные реакции хозяина.
1. Структуры, связанные с ответными реакциями растения-хозяина
а. Цитоплазменные агрегаты. Некоторым исследователям удалось добиться оптической четкости изображения внутреннего содержания эпидермиса частично отсеченных колеоптилей для наблюдения за поведением живых клеток хозяина. Однако они использовали интактный первичный лист для получения данных по гистохимии и ультраструктуре.
В отсеченных колеоптилях между образованием ап-прессория и последующими видимыми ответными реакциями хозяина, т. е. образованием цитоплазменных агрегатов в клетке, расположенной непосредственно под аппрессорием, проходит примерно два часа. Примерно такой же период проходит перед прониканием паразита в колеоптиль, подвергнутый температурному шоку и не имеющий цитоплазменных агрегатов. Это показывает, что интервал после образования аппрессо-рия необходим для обеспечения внутреннего развития самого паразита. Масса органелл хозяина достигает своего полного объема (=10—13 мкм в диаметре) через 5—10 мин и сохраняется в таком виде некоторое время после образования папиллы или гаустория. Многочисленные митохондрии, полирнбосомы и шероховатый эндоплазматический ретикулюм являются индикаторами высокой метаболической активности и интенсивных процессов биосинтеза. Аппарат Гольджи и вакуоли многочисленны и могут быть связаны с отложением материала папиллы.
б. Ореолы. Сферические по форме участки наружной части клеточной стенки хозяина и соответствующей антиклинальной стенки около вздутия аппрессо-Рия или кончика первичной ростковой трубки становятся биохимически измененными. Сарджент и Гей утверждают, что липидные материалы откладываются в кутикуле, а опалиновый кремний — в целлюлозных слоях, обычно вызывая утолщения. Кутикула и целлюлозные субструктуры остаются в основном интактными. Указанные составные части в зоне ореола включают также каллозу, марганец и кальций. Аутофлуоресценция зоны ореолов свидетельствует о наличии в них фенольных соединений, однако тесты на лигнификацию не подтвердили этого. Ореолы могут предохранять клеточную стенку от активной потери влаги. Кроме того, они могут представлять собой локализованные участки повышенной синтетической активности, которые обеспечивают отложение материала папилл.
в. Папиллы. Образование папилл происходит вслед за закладкой ореолов и может быть продолжением этого процесса. Папиллы формируются как полусферические отложения между плазмалеммой и клеточной стенкой. Они либо являются продолжением клеточной стенки, либо жестко прикреплены к ней. Зейен и Бушнелл с помощью трансмиссионной электронной микроскопии (ТЭМ) получили материалы о существовании четырех стадий формирования папилл: 1—отложение электронно-непрозрачного ос-миофильного материала на поверхности клеточной стенки; 2 — отложение аморфных, неосмиофильных материалов (возможно, нерастворимых полисахаридов типа каллозы) из везикул, связанных с мембраной; 3 — частичное уплотнение неосмпофильного материала, отсутствующего в папиллах, поврежденных проникшими инфекционными выростами; 4 — включение осмиофильно-го материала в папиллы и клеточные стенки. Стадии 2—4 могут протекать одновременно. В ряде исследований отмечена гетерогенность папилл, которая может быть результатом прерывания и восстановления любой из стадий в ответ на попытки проникания паразита.
Папиллы могут содержать каллозу, липиды, кремний и фенольные соединения. По данным Лина и Эдвардса, во всех па-пиллах, не поврежденных паразитом, появляются не-идентифицированные вещества, окрашивающиеся основными красителями (ВОК).
г. Проникание. Первым доказательством проникания паразита в клетку является электронно-прозрач-ная зона около 1 мкм в диаметре, появляющаяся в клеточной стенке хозяина непосредственно под инфекционным выростом. В это же время начинается рост противоположной внутренней стороны клеточной стенки. Кутикула изгибается под давлением инфекционного выроста, что свидетельствует о ее механическом повреждении, а на микрофибриллах целлюлозы в клеточных стенках заметны следы ферментативного растворения по ходу движения инфекционного выроста. О проникании инфекционного выроста в противостоящий ему участок клеточной стенки или через него сведений недостаточно. Опыты на искусственных мембранах. подтвердили предположение о том, что физический контакт инфицирующей гифы с плазма-леммой стимулирует образование гаустории.
2. Влияние окружающей среды, онтогенеза и генотипа
Образование папиллы и процесс проникания паразита. зависят от условий среды, онтогенетических и генетических факторов. Влияние некоторых из них было изучено на примере мучнистой росы ячменя.
а. Среда. Восприимчивость листьев к паразиту коррелирует с содержанием кальция. Обработка отсеченных колеоптилей 0, 01 М растворами Ca(N03)2, СаСl2 пли СаВr2 сопровождалась ослаблением образования папилл и вдвое более активным формированием гаусторий. Постоянным использованием 0, 01 М раствора Ca(NO3)2 для инкубирования рассеченных колеоптилей можно частично объяснить высокий уровень проникания паразита в них; напротив, раствор Са(Н2Р04)2 усиливал рост папилл и ослаблял прорастание аппрессорнев.
б. Возраст растений. У первичных листьев и их отдельных клеток с возрастом наблюдается прогрессивное повышение устойчивости к инфекции. О значении возраста свидетельствует следующий пример: молодые первичные листья устойчивого генотипа хозяина могут быть восприимчивыми к прониканию (= 45%), тогда как взрослые листья восприимчивой линии оказываются довольно устойчивыми (=10% поражения). Введение в генотип ячменя локуса Мl-а устойчивости приводит лишь к небольшому ослаблению проникания паразита в молодые листья, но существенно повышает устойчивость к инфекции у полностью раскрывшихся листьев. Позднее сформировавшиеся листья овса меньше поражаются возбудителем мучнистой росы Е. graminis f. sp. avenae, чем первые листья при инокуляции в одной фазе развития. Различия в устойчивости к паразиту в зависимости от фазы развития листьев или возраста клеток хозяина особенно выражены у линии с возрастной устойчивостью.
1. Процент конидий, образующих гаустории или индуцирующих образование папилл в первичных листьях 7-дневных проростков ячменя при инокуляции изолятами Erysiphe graminis f. sp. hordei, совместимыми или несовместимыми со сложным локусом Ml-m/a/c
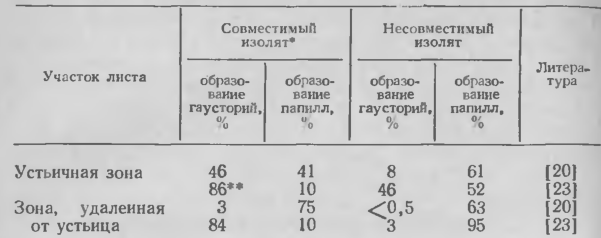
в. Тип клеток. Поражая определенные генотипы хозяина, аппрессории паразита значительно чаще проникают в околоустьичные и длинные покровные клетки, прилегающие к устьицам, чем в клетки, находящиеся на некотором расстоянии от них. Замыкающие клетки не поражаются. В таблице 1 показано влияние локуса Ml-а ячменя на частоту проникания паразита вблизи и в отдалении от устьиц. В соответствии с данными таблицы как в совместимых, так и в несовместимых комбинациях паразит — хозяин вблизи от устьиц процент инфекции выше, чем на участках листьев, удаленных от устьиц, за одним исключением, которое будет обсуждено позже, а именно: оба указанных участка листа у сорта Trebi I в равной степени инфицируются совместимым изолятом паразита. В клетках вблизи устьиц инфекционные выросты гриба часто проникают через папиллы, тогда как вне устьичных зон листа папиллы хорошо дифференцнрованы и преодолеваются реже. Для некоторых (но не всех) линий овса характерно инфицирование главным образом околоустьичных клеток. Поскольку разные типы клеток одного растения различаются по своей устойчивости к паразитам, а современные методы позволяют выделять отдельные типы, то структурные и биохимические исследования последних могут помочь в понимании механизмов устойчивости.
г. Растение. Структура и время формирования цитоплазменных агрегатов, папилл и гаусторий в отсеченных колеоптилях и в листьях сопоставимы. Однако Бушнелл и Бергквист отметили, что листья определенных линий отличаются от отсеченных колеоп-тнлей своими реакциями на инфекцию: 1) папиллы в тканях листьев никогда не связаны с гаусториями; 2) несоответствующий паразит Е. graminis f. sp. tritici не образует гаустории; 3) около 50% инфицированных клеток остаются живыми при несовместимости, обусловленной геном Ml-а (в отсеченных колеоптилях все инфицированные клетки разрушаются).
По некоторым данным, в отличие от отрезанных ко-леоптилей листья могут обладать индуцированной устойчивостью (защита) или индуцированной восприимчивостью. Отсутствие индуцированной устойчивости у колеоптилей подтверждается работами Эйста и Израэ-ля, не нашедших изменений в эффективности проникания паразита при предварительной инокуляции. На листьях ячменя сорта Vada показано, что успешное или неудачное проникание данного паразита определяет реакцию на последующие внедрения. Исследования, проведенные Эдвардсом и Алленом, Йоргенсеном и Мортенсеном, также свидетельствуют о том, что восприимчивость листьев может усилиться при предшествующем проникании. Отсеченные колеоп-тили могут отличаться по реакциям на инфекции от ин-тактных, у которых локус Ml-а оказывает основное влияние на паразита, тогда как отсеченные колеопти-ли с геном Ml-а неустойчивы к внедрению.
д. Генотип. Изучение мучнистой росы ячменя в основном проводили на линиях с устойчивостью в локу-се Ml-а. В этом локусе или около него найдено несколько различных генов устойчивости, и Фавр обозначил их как сложный локус Ml-m/a/c. Именно от этих генов могли зависеть разногласия в данных об устойчивости безустьичных участков листьев в материале с локусом Ml-а. В совместимых комбинациях расы IX с сортом Trebi I, имеющим ген устойчивости JMl-h4sn =Ml-a8, и устьичные, и безустьичные участки листьев были высоковосприимчивы к прониканию паразита. В совместимых комбинациях расы CR-3 с геном хозяина ml-a из сорта Алжир устойчивыми к прониканию были безустьичные участки. Возможно, что различные участки локуса МI-m/а/с регулируют разные защитные механизмы. Альтернативная причина может быть связана с явлением, отмеченным Эллингбоу для мучнистой росы пшеницы; анализ комплементарных пар аллелей хозяина п паразита в квадратной сетке показывает, что две различные комбинации, каждая из которых обусловливает совместимость, могут быть физиологически неодинаковыми. Следовательно, совместимость вирулентной расы паразита с доминантным геном хозяина непдентична совместимости любой расы с рецессивным геном хозяина. Поэтому неудивительно, что в научных сообщениях по-разному оценивается влияние других локусов на проникание патогена, включая Ml-g и Ml-р ячменя и Рm-гены пшеницы.
Для выражения состояния устойчивости неспецнфич-ный (структурный) ml-o ген ячменя должен быть гомо-зиготным. Не все мутантные аллели идентичны, I но все испытанные аллели высокоэффективны в задержке проникания патогена в безустьичной зоне листа хозяина и частично — в устьичной зоне. У овса все типы устойчивости — полпгенная и моногенная расоспецифичная, а также моногенная неспецифиче-ская — обусловливают ослабление проникания паразита и усиленное образование папилл.
Отдельные гены устойчивости ячменя, овса и пшенн-цы могут оказывать влияние в обоих случаях — и при проникании патогена, и в последующий период. Локус Ml-а не только воздействует на проникание, но также обусловливает сверхчувствительность инфицированной клетки. Это может означать, что Ml-а регули-рует несколько механизмов устойчивости. Более вероятно, что ген расоспецифичности вызывает единое базисное нарушение метаболизма, обеспечивающее барьеры на многих этапах взаимодействий в системе паразит — хозяин.
Если иногда базисное нарушение, регулируемое Ml-а, проявляется иначе, чем реакция клеточной стенки против места внедрения патогена, то последняя является дополнительной или синергической реакцией в механизме устойчивости, контролируемом Ml-а. Ранняя активация какого-то механизма устойчивости (но не образования папилл) может подавлять развитие гриба в некоторых взаимодействиях достаточно эффективно, для того чтобы обеспечить формирование папилл, и тогда создается впечатление, что локус Ml-а непосредственно регулирует это формирование. В зрелых усть-ичных областях листа образование папилл само по себе или усиленное в присутствии Ml-а эффективно лишь отчасти. В длинных покровных клетках образование папилл может быть достаточно общим механизмом, в большинстве случаев предотвращающим проникание совместимых или несовместимых патогенов независимо от наличия других защитных механизмов, контролируемых локусом Ml-а. Наоборот, основная роль Ml-а может сводиться к контролю какого-то специфического процесса, происходящего и при формировании папилл, л после проникания патогена. Образование лигнинопо-добных соединений хозяином представляет пример такого процесса, который может играть роль в обоих случаях — при отложении материала клеточной стенки в местах, противостоящих внедряющейся гифе, и при подавлении патогена после его внедрения. В подтверждение этой возможности можно привести работу Эдвардса, отметившего, что реакция сверхчувствительности в инфицированных клетках с локусом Мl-а включает непрерывное образование папиллоподобных материалов и осмнофильных веществ.
3. Последовательность и синхронизация
Агрегация цитоплазмы предшествует инициации папилл и является обязательным ее условием. Координация инициации ореолов и агрегации цитоплазмы специально не исследована, однако образование папилл следует за инициацией ореолов. Обычно инфекционный вырост патогена можно обнаружить только после образования папиллы. Однако формирование инфекционного выроста может происходить и в отсутствие агрегации цитоплазмы. В этих случаях проникание патогена всегда происходит успешно и папиллы не образуются (что свидетельствует об отсутствии механизмов конститутивной устойчивости у растений). Иногда инфекционные выросты находят в живых клеточных стенках еще до того, как становятся заметными папиллы, но точно определить начало проникания инфекционных выростов пли формирования папилл в живой клетке очень трудно.
Изучение отсеченных колеоптилей показало, что после агрегации цитоплазмы могут происходить следующие пять превращений: 1) инфекционный вырост—гаустория (нет папиллы); 2) инфекционный вырост—одновременно папилла и гаустория; 3) одновременно папилла и инфекционный вырост—гаустория; 4) инфекционный вырост—папилла—гаустория; 5) папнлла— —инфекционный вырост—гаустория. Каждое из этих превращений может прерываться на любом этапе. Последовательности 2—5 иногда достигают завершения, и это свидетельствует о том, что формирование папилл не является абсолютно эффективным барьером для паразита, хотя некоторые элементы процесса образования папилл коррелируют с невозможностью его проникания.
4. Особенности образования папилл, связанные с прониканием патогена
а. Продолжительность процессов. Наблюдения Эйста и Израэля совпадают с данными Бушнелла и Бергквиста о времени протекания реакций в отсеченных колеоптилях. Аппрессории формируются приблизительно через 540 мин после инокуляции, тогда как агрегаты цитоплазмы в клетках хозяина появляются спустя 630—690 мин. Через 30—90 мин становятся заметными первые папиллы, но их формирование может начинаться уже спустя 15 мин после появления агрегатов . Инфекционные выросты патогена появляются через 20—50 мин после агрегации цитоплазмы (или через 115 мин в сочетании с ранними папиллами, но без гаусторий). Зачатки гаусторий всегда формируются приблизительно через 95 мин после образования агрегатов, если они вообще образовались. Следовательно, развитие гаусторий определяется небольшими изменениями во времени образования папилл. Если папиллы появлялись спустя 30—40 мин после агрегации, проникание паразита не происходило в 27 из 31 случая, что указывает на способность папилл останавливать процесс инфицирования. Если папиллы не появлялись в течение ж90 мин после агрегации, прониканне патогена удавалось в 36 случаях из 43, указывая на то, что позднее образование папилл неэффективно. Неспособность патогена проникать в хозяина в остальных 7 случаях из 43 учтенных могло быть результатом действия иных, помимо образования папилл, факторов. Необходимо отметить, что в 11 других опытах с колеоптилями появлялись инфекционные выросты, отсутствовали папиллы и всегда развивались гаустории. Очевидно, какие-то механизмы устойчивости растений не влияют на рост инфекционных гиф грибов в отсутствие папилл.
В противоположность отсеченным колеоптилям образование папилл в листьях начиналось спустя 360 мин после инокуляции патогеном и продолжалось по меньшей мере еще 360 мин. Это свидетельствует об относительно большей устойчивости листьев к инфекции.
б. Скорость роста. Скорость роста папилл перед появлением инфекционного выроста одинакова для совместимых и несовместимых листьев или колеоптилей. Она составляет 0, 1 мкм/мин, достигая нижнего уровня скорости роста гиф (0, 1 —0, 3 мкм/мин), т. е. устойчивость растений может зависеть от начальной скорости роста гриба. Большее значение может иметь скорость роста самого инфекционного выроста.
в. Размер. После появления инфекционных выростов папиллы обычно становятся более крупными в несовместимых листьях и колеоптилях, чем в совместимых тканях. Уотермен и др. изучали взаимосвязь между прониканием патогена и размером папилл в центрифугированных и нецентрифугирован-ных колеоптилях. Они установили, что диаметр папилл может оказывать дополнительное влияние на инфицирование в сочетании с другими факторами их формирования, например временем отложения.
г. Состав. Лин и Эдвардс нашли высокую степень корреляции между неспособностью проникания паразита в растение и наличием в папиллах неизвестного вещества, окрашивающегося основными красителями (ВОК). Однако пока не установлено, участвует ли это вещество непосредственно в торможении проникания или же образуется как следствие такого торможения. В пользу первого предположения свидетельствует то, что ВОК обычно встречается только в замыкающих клетках устьиц, которые никогда не инфицируются. Аутофлуоресценция, свидетельствующая о наличии фенольных соединеннй, более интенсивна в папиллах при несовместимых комбинациях паразита и хозяина и в безустьичной зоне листьев, т. е. она связана с устойчивостью растения.
д. Уплотнение. Созревающие папиллы становятся плотными п нерастворимыми. Завершение формирования папилл в листьях тесно связано с неспособностью патогена к инфицированию, причем инфекционные выросты гриба обычно не могут проникать через заранее образовавшиеся (преформацпонные) па-пиллы. Последние отличаются от «неэффективных» папилл в колеоптнлях своей эластичностью. По мнению Зейена и Бушнелла, для того чтобы образующиеся папиллы эффективно предотвращали прони-канне патогена, они должны пройти стадию уплотнения еще до развития инфекционного выроста.
е. Значение папилл для устойчивости растений. Образование папилл у злаков, пораженных мучнистой росой, тесно коррелирует с задержкой роста гриба и устойчивостью к его прониканию. Вышеприведенные зависимости между размером, временем образования папилл и т. п. свидетельствуют в пользу этого. Точные механизмы регуляции образования папилл и подавления роста гриба пока не установлены. Ясно, что папиллы не могут быть единственным механизмом устойчивости. Недавно проведенные исследования развития Е. gramitiis и Е. cichoracearum на растени-ях-нехозяевах показали наличие ряда защитных механизмов. В обоих случаях инфекционный процесс быстро останавливался на поверхности листьев еще до начала образования инфекционных выростов и индукции папилл. Если же гриб образовывал выросты, то их развитие с высокой вероятностью могло быть остановлено папиллами. Как описано ниже, последние данные о некротрофных возбудителях пятнистостей листьев также подтверждают роль папилл как первичного защитного механизма у травянистых растений-нехозяев.
Пятнистости листьев
Эпидермальные клетки травянистых растений обычно реагируют на попытку некротрофных грибов проникнуть в них образованием папилл и «изгоняют» паразита. Механизмом, предотвращающим проникание, может служить изменение противолежащей клеточной стенки (wall apposition).
Все реакции — от образования аппрессориев до полного завершения или прекращения проникания некротрофных паразитов — обычно сходны с описанными для Erysiphe. На листьях канареечника (Phalaris arundina-сеа L. ) непатогенный для него гриб Helmitithosporium avenae Eidam образует аппрессории в течение 4 ч пос-пе инокуляции. Через 6 ч мелкие ореолы можно определить гистохимнчески, многие из них ассоциированы с инфекционным выростом патогена. Изредка появляются мелкие папиллы, которые со временем увеличиваются в размере и становятся более многочисленными. Инфекционный вырост образует в папиллах заметный канал, но не выступает из них. При инокуляции канареечника совместимым патогеном Helminthosporium cate-nariurn Dreschs более 95% аппрессориев индуцируют образование непроходимых для патогена папилл, не отличающихся от индуцированных несовместимым патогеном. Немногие аппрессории Н. catenarium инициируют успешное проникание в растение. Разрушенная клеточная стенка образует небольшие утолщения (не папиллы) или слабоорганизованные папиллы. Цитоплаз-менные агрегаты образуются параллельно новым отложениям материала в противолежащих клетках (Шервуд, неопубл. данные). Однако подробные изучения онтогенеза, времени прохождения, синхронности процессов и ультраструктуры отсутствуют.
1. Экспериментальное ингибирование образования папилл
Чтобы выяснить, существуют ли, помимо папилл, какие-то другие механизмы устойчивости, предохраняющие хозяина от внедрения патогенов, мы помещали кусочки инокулированных листьев в раствор циклогек-симида. Последний использовали для подавления синтеза белков, так как предполагалось, что он необходим для формирования новой клеточной стенки. В субле-тальных концентрациях циклогексимид предупреждал отложение материала в противолежащей клеточной стенке, но не сдерживал внедрение патогена. Если устойчивость хозяина связана с конститутивными соединениями или фитоалексинами, то подавление патогена должно было происходить даже в отсутствие папилл. Такой же результат получили в опытах с 11 другими видами злаковых. Инокулированные листья канареечника, не обработанные циклогексими-дом, фитоалексинов не содержали. Полученные данные свидетельствуют о том, что утолщение противолежащей стенки в клетках видов Graminea часто предотвращает проникание паразита, но в отсутствие папилл оно возможно.
2. Влияние типа клеток
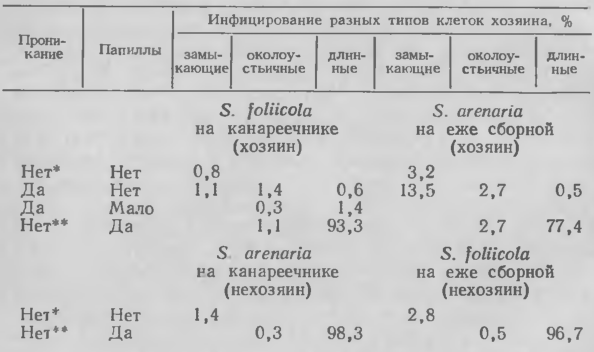
Устойчивость и хозяина, и нехозяина может проявиться уже на стадии проникания патогена. Например, Stagonospora arenaria Sacc. проникал в ткани хозяина — ежи сборной (Dactylis glomerataL. ), но не инфицировал канареечник. Stagonospora foliicola (Bres. ) Bubak заражал своего хозяина — канареечник, но не инокулировал ежу сборную. Неспособность к прониканию в ткани была тесно связана с утолщением противолежащей стенки. В некоторых случаях патоген проходил и через утолщения, хотя при этом не удалось определить, что происходило раньше — инфицирование или отложение материала клеточной стенки.
Особый интерес, как и в случае с Erysiphe на некоторых хозяевах, представляет способность некротроф-ных патогенов чаще проникать в устьичные зоны листьев, чем на удалении от них. В противоположность видам Erysiphe такие грибы способны проходить через клеточные стенки замыкающих клеток. Папиллы в замыкающих клетках не были обнаружены; в придаточных клетках они были мелкими или отсутствовали, но хорошо развивались в длинных клетках эпидермиса.
2. Проникание патогена и образование папилл в тканях канареечника и ежи сборной, инокулированных совместимыми или несовместимыми видами Stagonospora и инкубированных в течение 48 ч во влажной камере при 24 °С
Клеточные ядра хозяина, обычно локализованные вблизи папилл, по-видимому, играют какую-то роль в их образовании.
3. Гистохимия
Ореолы и папиллы в тканях канареечника и пшеницы содержат целлюлозу, каллозу, лигнин, лигнинопо-добные вещества (сиренинового типа) и вещество, окрашиваемое основными красителями (ВОК). Распределение ВОК коррелирует с накоплением желтого пигмента в папиллах канареечника и лигнина в папиллах пшеницы, т. е. ВОК, очевидно, имеет поли-фенольную природу. Гистохимические тесты на каллозу более выражены у молодых папилл (10—12 ч), тогда как реакции на лигнин четче у старых папилл. Сравнительные исследования взаимосвязей между генотипами растений, видами грибов, температурой и светом показали, что папиллы одинакового размера сходны гистохимически. У травянистых растений морфология и пигментация папилл относительно постоянны, но у других видов отличны. Специфичность на уровне видов хозяев может быть связана с особенностями строения противолежащих клеток.
4. Взаимосвязь между лигнификацией и устойчивостью растений
По нашему мнению, лигнифнкация в точке утолщения противолежащей клеточной стенки способствует проявлению устойчивости канареечника и пшеницы. Доказательства этому приведены в работе Вэнса и др. Райд предположил, что при лигнификации рост гриба подавляется за счет следующих процессов: 1) возникновения механического барьера для гиф паразита; 2) ограничения обмена водой, питательными веществами или токсинами между хозяином и грибом; 3) накопления фенольных компонентов, токсичных для патогена; 4) обволакивания клеточных стенок гиф и ограничения их способности к удлинению; 5) защиты полимера клеточных стенок хозяина от ферментативного разрушения паразитом. В подтверждение последней возможности Райд показал, что лигнифицированные папиллы и ореолы в тканях пшеницы высокоустойчивы К повреждающему действию ферментов грибов.
По-видимому, замыкающие клетки устьиц в листьях канареечника содержат лигниноподобный материал. Однако S. folliicola часто проникает через стенки замыкающих клеток, и это свидетельствует о том, что предварительно (до нападения патогена) образованный лигнин не всегда служит эффективным барьером для инфекционных гиф. Следовательно, процесс отложения лигнина (лигнификация в действии) скорее служит защитным механизмом, чем завершенная лигнификация (структура).
Лигнификация индуцируется уже в слабоповрежден-ных листьях пшеницы путем инокуляции их мицелием и обработкой препаратами клеточных стенок грибов или хитином. И патогенные, и сапротрофные грибы одинаково эффективны в индукции этого процесса. Широкий набор веществ, способных вызывать накопление фитоалексинов в тканях различных растений, не вызывает лигнификации поврежденных тканей пшеницы.
Изучение ферментативных процессов позволило установить, что лигнификация, индуцированная грибами, начинается с превращения фенилаланина и идет обычными путями биосинтеза лигнина. Активность основных ферментов, участвующих в лигннфикации (фе-нилаланинаммиаклиазы, пероксидазы, гидрокснцнн-намат-КоА-лигазы), возрастает в листьях, инфицированных Н. avenae. Циклогексимид подавляет эту активность. Лигнификация связана с усилением активности катодных изопероксидаз, а пероксидазная активность, по данным гистохимических анализов, локализована в области папилл и ореола. Ферментативно-зависимое образование лигнифицированных папилл у канареечника можно рассматривать как механизм индуцированной устойчивости. Все результаты опытов с циклогексимидом и ферментами подтверждают гипотезу о защитной роли лигнификации. Однако циклогексимид нарушает не только синтез белка, но и многие другие процессы, происходящие в клетках. Не исключено, что влияние циклогексимида на проникание патогена в растение управляется какими-то другими механизмами, а не утолщением противолежащей клеточной стенки.
Для дальнейшей оценки роли лигнина и фенолов в устойчивости растений мы недавно провели опыты с α-аминоокси-β-фенилпропионовой кислотой (АОФПК), аналогом фенилаланина, которая конкурентно ингибирует активность фенилаланинаммпаклиазы (ФАЛ), не блокируя синтез белка. В кусочках листьев (ж7X5 мм), помещенных в воду, 98% аппрессорпев Н. avenae индуцировали хорошо развитые папиллы, которые защищали клетки от проникания гриба. При добавлении 10 мкМ АОФПК 24, 8% аппрессо-риев вызывало образование мелких папилл, через которые происходило внедрение патогена. Гистохимические тесты выявили меньшую степень лигнификацин папилл при добавлении АОФПК. Последняя явно ингибировала лигнификацню папилл и они легче преодолевались грибами, что подтверждает упомянутую выше гипотезу.
3. Образование папилл и проникание Helminthosporium avenae в кусочки листьев канареечника (нехозяин), помещенные на 24 ч в раствор α-аминоокси-β-фенилпропионовой кислоты (АОФПК)

Около 36% аппрессориев вызывало образование папилл, через которые не происходило проникание гриба. В этом случае либо АОФПК не доходила до всех клеток в достаточной концентрации, либо какие-то иные защитные механизмы предохраняли клетки от проникания. Опыты с более мелко нарезанными кусочками листьев подтвердили первую возможность (Вэнс, не-опубл. данные).
Неожиданным было то, что АОФПК ингибировала образование видимых папилл примерно на 39% слабее, чем образование активных (проникающих) аппрессориев. Если принять, что АОФПК ингибирует только активность ФАЛ, то эти результаты позволяют считать лигнификацню существенным компонентом роста и уплотнения противолежащей стенки. В соответствии с Другим предположением лигннфикация, происходящая до образования видимых папилл, может быть критическим фактором в подавлении роста гриба, достаточном Для их формирования.
Широкая вариабельность последствий взаимодействия паразита с обработанными АОФПК листьями, включая случаи от проникания без утолщения противолежащей клетки до вариантов с утолщением без проникания патогена, напоминает ситуации в природ- ных условиях при наличии совместимого патогена. Ткань, обработанная 1 мМ АОФПК, становилась восприимчивой к непатогену Н. avenae и поражалась с той же частотой, что и контрольные ткани, погруженные в воду и инокулированные патогеном Н. catenari-ит. Возможно, патогены образуют антиметаболиты, индуцирующие восприимчивость хозяина путем нарушения процессов лигнификации или образования папилл. Иммунные сорта или виды растений должны быть нечувствительны к этим антиметаболитам, разлагать их или подавлять их образование.
Используемая литература: Инфекционные болезни растений: физиологические и биохимиче-
ские основы/Пер. с англ. Л. Л. Великанова, Л. М. Левкиной,
В. П. Прохорова, И. И. Сидоровой; Под ред. и с предисл.
Ю. Т. Дьякова. — М.: ВО Агропромиздат, 1985. — 367 с.
Скачать реферат:
Пароль на архив: privetstudent.com