Удаление углекислого газа
Регенеративные удаления углекислого газа
В качестве регенеративных сорбентов в настоящее время используется несколько способов очистки атмосферы от СО2, отличающихся друг от друга характером взаимодействующих фаз, температурой, необходимостью создания искусственного силового поля или градиента концентраций.
В системах газ — твердое тело в качестве адсорбента применяются молекулярные сита, синтетические цеолиты, обладающие избирательной поглощающей способностью по отношению к углекислому газу. Процесс адсорбции протекает независимо от действия силы земного притяжения и может быть осуществлен в условиях реального космического полета. Практическое применение могут найти следующие способы очистки атмосферы от углекислого газа: адсорбция с использованием синтетических цеолитов, физические, абсорбция при осуществлении электрохимических процессов.
При адсорбции СО2 синтетическими цеолитами регенерацию можно осуществить путем использования различных методов и средств: космического вакуума, вакуума и повышенной температуры, уменьшением парциального давления СО2 над слоем адсорбента в токе инертного газа, вакуума и повышенной температуры с последующим компремированием СО2 до нормального давления.
В зависимости от способа регенерации кислорода, определяемого длительностью полета, выбирается тот или иной способ десорбции СО2. При использовании запасов кислорода целесообразно применять вакуумную и термовакуумную десорбцию СО2 в космическое пространство.
К физическим методам очистки атмосферы от СО2 относятся вымораживание, центрифугирование, диффузия.
Разработка методов очистки, основанных на вымораживании и центрифугировании, находится в стадии расчетно-теоретических исследований. Диффузионный же способ очистки атмосферы от СО2 является малоэнергоемким, простым и перспективным.
Абсорбция СО2 при осуществлении электрохимических процессов отличается непрерывностью процесса и одновременным получением кислорода из воды и углекислого газа. Очистка атмосферы от СО2 обеспечивается путем хемосорбции конечными продуктами электролиза, образующимися в катодном пространстве в электролизных установках при осуществлении электролиза водных растворов карбонатов, сульфатов и расплавов щелочных металлов.
Удаление и концентрирование СО2 путем адсорбции с применением синтетических цеолитов
Наиболее распространенными регенерируемыми сорбентами углекислого газа в настоящее время считаются цеолиты (молекулярные сита), представляющие собой синтетический гидратированный алюмосиликат с различными присадками окислов щелочных металлов. Цеолиты — пористые гранулированные вещества с гранулами размером 3— 5 мм и порами в них в несколько ангстрем. При физической адсорбции адсорбируемость различных веществ существенно зависит от пористой структуры адсорбентов. В наиболее мелких порах адсорбентов, так называемых микропорах, размеры которых сравнимы с размерами адсорбируемых молекул, происходит перекрывание входа в пору полями адсорбционных сил, которые создаются противоположными стенками пор. В результате в порах происходит повышение адсорбционных потенциалов и возрастание дифференциальных теплот адсорбции, что приводит к значительному увеличению адсорбции. Этим же объясняется и исключительная селективность определенных форм цеолитов с определенными структурными характеристиками в поглощении ив газовой смеси только определенной ее составляющей, размеры молекулы которой близки к размерам микропор.
Например, цеолиты типа А и X имеют существенные, ярко выраженные особенности: строгое постоянство размеров пор для каждого типа; бидисперсный характер первичной пористой структуры кристаллов — две разновидности пор, соответствующие большим и малым полостям в структуре алюмосиликатных скелетов; взаимосвязь пор, осуществляемую через узкие окна, которыми определяется проникновение в поры адсорбируемых молекул; образованную ионами кислорода поверхность алюмосиликатного скелета (поверхности собственно пор). Положительно заряженные ионы алюминия и кремния расположены в глубине алюмосиликатного скелета.
Свободные полости между элементарными кристаллами и конгломератами кристаллов образуют вторичную пористость гранулированных цеолитов. Размеры этих полостей могут колебаться в широких пределах и зависят как от размеров самих кристаллов, так и от характера упаковки. По данным М. М. Дубинина, эквивалентные радиусы вторичных пор лежат в интервале от нескольких десятков до сотен тысяч ангстрем.
В таких порах, значительно отличающихся по размерам, естественно, различны коэффициенты диффузии и массоперенос составляющих газовой смеси, находящихся под блокирующим воздействием адсорбционных полей.
Коэффициенты диффузии во вторичной пористости зависят от условий получения и гранулирования цеолитов, а также от условий адсорбции: в вакууме или из потока газа-носителя, находящегося при малом или высоком давлении.
Природа адсорбционных сил и кинетика адсорбции на цеолитах зависит от многих факторов и имеет весьма сложный характер.
Адсорбция углекислого газа на калиевом, натриевом и кальциевом цеолитах при 20° С представлена в табл. 2.
Из данных табл. 2 видна четкая зависимость адсорбции от размера окон элементарных полостей кристаллической структуры.
Размер окон элементарных полостей кристаллической структуры цеолитов доступен для молекул воды. Критический диаметр молекул воды соизмерим с размером окон адсорбционных полостей синтезированных кристаллических алюмосиликатов (табл. 3).
Таблица 2. Адсорбция углекислого газа (3,2 А) на калиевом, натриевом и.кальциевом цеолитах при температуре 20° С

Изотермы адсорбции на цеолитах уже при очень низких концентрациях водяных паров круто поднимаются. Синтетические цеолиты — это адсорбенты с весьма тонкими порами. За счет наложения полей противоположных стенок в тонких порах резко выражен эффект адсорбционного потенциала, что приводит к высокой адсорбционной емкости при низких концентрациях адсорбата. В силу этого синтетические цеолиты — хорошие осушители; по своим осушающим свойствам они значительно превосходят силикагели.
Регенерация цеолита осуществляется при его подогреве до определенной температуры и вакуумировании. При этом отдельные марки цеолитов могут выдержать значительное число циклов регенерации.
Применение цеолитов для поглощения и концентрирования углекислоты следует считать перспективным.
В настоящее время имеются лабораторные установки, в которых с успехом применяются цеолиты для поглощения углекислоты и вредных примесей.
Принципиальная схема системы очистки атмосферы от углекислого газа, основанная
Таблица 3. Адсорбция паров воды (2,6 А) накалиевом, натриевом и кальциевом цеолитах при температуре 20° С
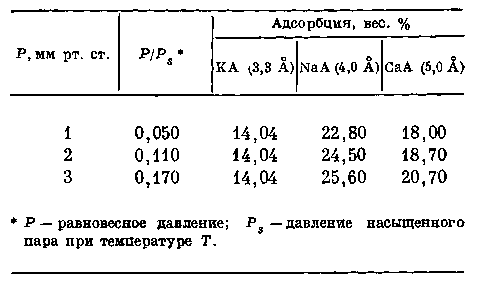
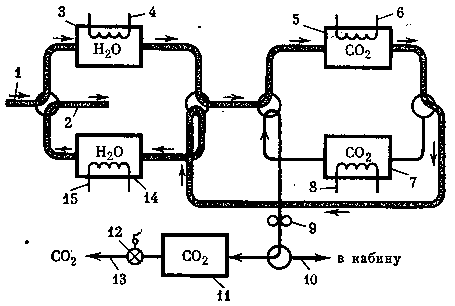
Рис. 14. Принципиальная схема системы удаления углекислого газа на основе синтетических цеолитов
1 — воздух из кабины,
2 — воздух в кабину,
3,14 — адсорберы воды,
4,15 — нагреватели адсорберов воды,
5,7 — адсорберы СО2,
6, 8 — нагреватели адсорберов СО2,
9 — вакуумный насос,
10 — воздух в кабину,
11 — хранилище СО2,
12 — редуктор,
13 — выход концентрированного СО2 в блок
утилизации на использовании синтетических цеолитов, представлена на рис. 14.
По данной схеме воздух из кабины проходит через адсорбер воды 5, освобождаясь от излишней влаги, далее в адсорбер СО2 5. Воздух, очищенный от углекислого газа, направляется на десорбцию в адсорбер воды, нагретый до определенной температуры, затем увлажненный воздух поступает в кабину (2).
В этот же период времени в адсорбере 7 осуществляются термовакуумная десорбция углекислого газа и сбор его в хранилище 11.
По данным ряда авторов, два патрона, наполненные цеолитом, весом 2,26 кг, работающие циклично в режиме сорбции и десорбции, обеспечивают удаление углекислого газа, выделяемого при дыхании человеком. Время сорбции одного патрона — примерно 100 мин. Вес всей системы удаления СО2 составляет 14 кг. Потребляемая мощность на регенерацию (подогрев и вакуумирование) — примерно 700 вт, а на охлаждение — примерно 400 вт. Система очистки атмосферы от СО2, основанная на применении синтетических цеолитов, с успехом использовалась на американской орбитальной станции «Скайлэб» и надежно функционировала в условиях реального космического полета.
Удаление и концентрирование СО2 путем вымораживания.
При абсолютном давлении 760 мм рт. ст. двуокись углерода переходит в твердое состояние при температуре —78,9° С. Тройная точка двуокиси углерода соответствует температуре —56,6° С и абсолютному давлению 5,28 кг/см2.
Ниже этого давления и температуры двуокись углерода переходит в твердое состояние, минуя жидкую фазу. Парциальное абсолютное давление двуокиси углерода при наиболее высоких давлениях в воздухоразделительных аппаратах может достигать величины 0,06 кгс/см2. Поэтому выделение двуокиси углерода из воздуха в аппарате возможно только в твердом виде.
Вымораживание двуокиси углерода производится в регенераторах или в специальных теплообменниках-вымораживателях. Применяются различные конструкции выморажи-вателей: плоские (установки П. JI. Капицы), витые трубчатые высокого давления с прохождением очищаемого воздуха внутри трубок, низкого давления с прямыми трубками и прохождением очищаемого воздуха в меж-трубном пространстве.
Для достижения заданной степени очистки воздуха процесс вымораживания СО2 должен осуществляться при тепловом режиме, обеспечивающем кристаллизацию СО2 только на холодной стенке без выпадения снега в потоке воздуха. В этом случае количество СО2 в очищенном воздухе будет равно или меньше содержания СО2 в воздухе при насыщении для данной температуры и давления. Разность температур воздуха и холодной стенки не должна превышать 30° С, а скорость потока воздуха во избежание срыва инея со стенок и уноса кристаллов с СО2 должна быть не выше 3 м/сек. Вымораживание двуокиси углерода начинается в том сечении теплообменного аппарата, где температура воздуха равна температуре точки росы СО2 в воздушном потоке.
Продолжительность работы вымораживателя до его заполнения пропорциональна его максимальной удельной нагрузке, т. е. количеству СО2 в кг/м*час, высаживающейся в наиболее напряженном сечении. Для приближения максимальной удельной нагрузки к средней нагрузке следует подбирать такое соотношение потоков, чтобы разность температур на теплом конце вымораживателя не превышала среднелогарифмической разности температур.
В системах обеспечения жизнедеятельности экипажей космических кораблей или планетных станций метод вымораживания углекислого газа может найти практическое применение благодаря простоте организации технологического процесса и аппаратурного оформления.
В реальных системах, естественно, вымораживатель будет состоять из двух контуров. В одном будет осуществляться удаление СО2 из воздуха, а в другом — преобразование углекислоты в газообразное состояние.
Принципиальная схема системы очистки атмосферы от углекислого газа вымораживанием представлена на рис. 15.
Воздух из кабины поступает в холодильник-теплообменник 7, где он освобождается от паров влаги, далее в углекислотный холодильник-теплообменник 6, в котором осуществляется вымораживание углекислого газа.
Воздух, очищенный от углекислого газа и паров воды, поступает на десорбцию в водяной холодильник-теплообменник 2 и далее в кабину (10). Одновременно с этим осуществляются десорбция СО2 в блоке 3 и его складирование в хранилище 8.
Удаление и концентрирование СО2 путем диффузии через селективные мембраны
Осуществление процесса очистки атмосферы от СО2 путем применения селективных мембран представляется в настоящее время разумным технологическим решением, отличающимся непрерывностью процесса и малым энергопотреблением. Определяющей движущей силой процесса в аппаратах с селективными мембранами является градиент концентраций по СО2, т. е. разница концентраций СО2 во входящем воздушном потоке и в потоке по другую сторону мембраны. Реализация эффективного удаления СО2 из воздуха кабины обеспечивается за счет выбора высокоселективных мембран, являющихся ответственными за массоперенос СО2, а также вариацией давления и инертными добавками (водород, парогазовая смесь) в концентрационной полости диффузионных аппаратов, обеспечивающих необходимую скорость переноса молекул СО2.
Принципиальная схема очистки атмосферы от СО2 с применением селективных мембран представлена на рис. 16.
Организация технологического процесса очистки атмосферы от СО2 построена по принципу последовательного концентрирования
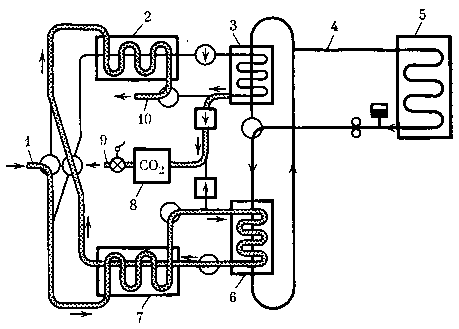
Рис. 15. Принципиальная схема удаления углекислого газа вымораживанием
1 — воздух из кабины,
2,7 — водяные холодильники-теплообменники,
3, в — углекислотные холодильники-теплообменники,
4 — циркуляция жидкостного хладоносителя,
5 — космический радиатор-теплообменник,
8— хранилище углекислого газа,
9 — выход углекислого газа в блок утилизации,
10 — воздух в кабину
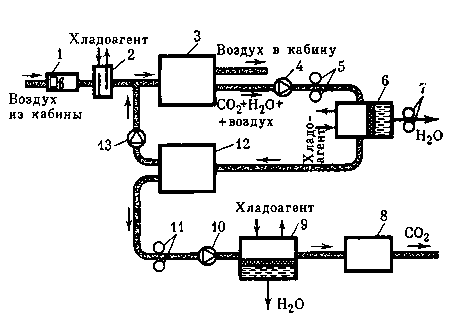
Рис. 16. Принципиальная схема очистки атмосферы от СО2, основанная на использовании диффузии СО2 через селективные мембраны
1 — воздух из кабины,
2 — теплообменник,
3, 12 — диффузионные аппараты,
4, 10, 13 — обратные клапаны,
5, 7, 11 — компрессоры,
6, 9 — теплообменник-влагоотделитель,
8 — сборник СО2
путем применения двух диффузионных аппаратов 3, 12 и использования парогазовой смеси с последовательным удалением влаги в теплообменниках-влагоотделителях 6, 9.
В последних удаление влаги из парогазовой смеси целесообразно осуществлять в условиях динамической невесомости путем использования капиллярно-пористых элементов. Расположение обратных клапанов обеспечивает строго направленную циркуляцию парогазовой смеси и очищаемого от СО2 воздушного потока.
Данный способ очистки атмосферы от СО2 в настоящее время все в большей степени привлекает исследователей, поскольку обладает существенными преимуществами — простотой и малой энергоемкостью.
Удаление и концентрирование СО2 путем абсорбции при электролизе растворов солей Хемосорбция углекислого газа гидроокисью проходит без затраты какой-либо дополнительной энергии. Взаимодействие гидроокисей с СО2 с образованием карбоната можно представить уравнением мется скоростью диффузии углекислого газа, скоростью диффузии активной части католита из основной массы жидкости и скоростью химической реакции.
При очень большой скорости реакции можно считать, что она протекает в узкой реакционной зоне, расположенной в пределах диффузионной пленки, причем скорость процесса в этом случае определяется скоростью диффузии углекислого газа и активной части католита в данной зоне. При большой скорости необратимой реакции, когда ее можно считать мгновенной, газ, реагируя с жидкостью, образует в жидкостной пленке слой, состоящий из продуктов реакции. Этот слой изолирует газовую фазу от активной части католита, и дальнейший процесс абсорбции происходит, с одной стороны, по мере диффузии углекислого газа через этот изолирующий слой и, с другой стороны, по мере диффузии активной части католита из активной массы жидкости.
По мнению некоторых исследователей, реакция взаимодействия углекислого газа с гидроокисью (NaOH, КОН) протекает с большой скоростью.
Можно полагать, что зависимости, выведенные на основании исследований по скорости абсорбции углекислого газа в NaOH при барботаже, будут характеризовать абсорбцию в наших условиях. Граничные условия абсорбции при барботаже и общие закономерности будут проявляться и при абсорбции в отсутствие силы тяжести. На рис. 17 представлена зависимость абсорбционной емкости водных растворов NaOH от концентраций углекислого газа и NaOH.
Из рис. 17 видно, что с увеличением концентрации СО2 скорость абсорбции увеличивается, а с увеличением концентрации NaOH возрастает количество поглощенной СО2.
В ряде исследований показано, что абсорбция углекислого газа растворами NaOH и КОН протекает совершенно идентично и приведенный коэффициент скорости процесса, учитывающий физические свойства абсорбента, оказывается равным в обоих случаях. Движущей силой процесса является концентрация активного абсорбента в жидкости.
Для осуществления процесса десорбции необходимо учитывать, что устойчивое состояние бикарбоната в растворе характеризуется граничными условиями: бикарбонат выпадает в осадок при температуре 60—70° С и концентрации, превышающей 30—33%.
Известно также, что десорбция более интенсивно протекает при температуре 110° С.
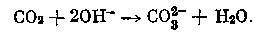
По мнению некоторых авторов, данная реакция протекает не мгновенно, а с определенной скоростью, и поэтому поглощение СО2 следует рассматривать как процесс, идущий в две стадии:
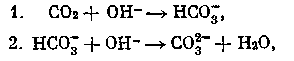
в котором вторая реакция протекает мгновенно, а первая идет с конечной скоростью.
При электролизе раствора карбоната калия в прианодном пространстве образуется бикарбонат калия, который при нагревании распадается:
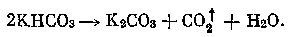
При электролизе раствора сульфата натрия в прианодном пространстве образуется серная кислота, которая при контакте с продуктом реакции абсорбции — карбонатом натрия — химически взаимодействует с ним:

Углекислый газ выделяется в концентрированном виде, а остальные продукты реакции направляются обратно в электролизер. Следует отметить, что данная реакция протекает без подогрева, поэтому при проведении электролиза сульфата натрия энергия затрачивается только на сам процесс электролиза.
При абсорбции католитом углекислого газа последний вступает в химическую реакцию с активной частью католита.
При электролизе сульфатов каких-либо граничных условий для католита и анолита не существует, т. е. их концентрация может быть любой, а температура будет определяться соответствующими условиями проведения электролиза.
В абсорбционных процессах участвуют две фазы — жидкая и газовая и происходит переход веществ от газовой фазы в жидкую.
В процессе, обратном абсорбции, при выделении растворенного газа из раствора происходит переход вещества из жидкой фазы в газовую.
Для устойчивой работы абсорбционно-десорбционных аппаратов необходимо соблюдать следующие основные условия: обеспечивать контакт жидкой и газообразной фаз; подводить католит и анолит к реакционным аппаратам; удалять продукты реакции из реакционных аппаратов; отделять газовую и парогазовую фазы от жидкой; подводить тепло к реагенту; отводить тепло от аппаратов.
В наземных условиях абсорбционные процессы осуществляются в специальных аппаратах, отличающихся друг от друга методом контактирования фаз. В пленочных аппаратах жидкость стекает в виде тонкой пленки, на поверхности которой и происходит соприкосновение фаз. Отекание жидкости обеспечивается за счет действия силы земного притяжения и, следовательно, в условиях невесомости будет нарушено. В аппаратах, работающих по принципу распыления жидкости в массе газа, соприкосновение фаз происходит на поверхности капель. В условиях невесомости соприкосновение фаз будет осуществляться, но отделение жидкой фазы от газообразной нарушится из-за отсутствия разности в удельном весе.
В барботажных аппаратах, работающих по принципу распыления газа в массе жидкости, соприкосновение газа с жидкостью происходит на поверхности пузырьков газа, проходящих через слой жидкости. В этом случае также будет затруднен процесс отделения газа от жидкости из-за отсутствия разности в удельном весе между контактирующими фазами.
Абсорберы поверхностного типа обеспечивают соприкосновение двух фаз за счет пропускания газа над свободной поверхностью неподвижной или медленно текущей жидкости. В условиях невесомости жидкость будет растекаться по стенкам аппарата, в результате чего по газоотводящим каналам пойдет газожидкостная смесь.
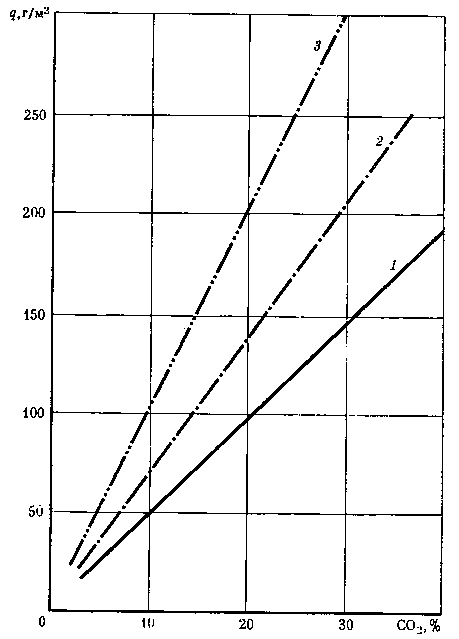
Рис. 17. Зависимость абсорбционной емкости (q) водных растворов едкого натрия от его концентрации и содержания углекислого газа в воздухе NaOH (в г*экв/л):
1 — 1, 2 — 2, 3 — 4
Следует отметить, что при использовании таких аппаратов в условиях невесомости, очевидно, будет затруднено подведение и отведение жидкой фазы, что также приведет к нарушению статики и кинетики абсорбции, т. е. равновесия между жидкой и газовой фазами и скорости процесса массообмена. Следовательно, наземные абсорбционные аппараты использовать в условиях невесомости нельзя.
При использовании десорбционных аппаратов (десорберов) в условиях невесомости для осуществления процесса перехода вещества из жидкой фазы в газовую, как и абсорбционных аппаратов, возникают проблемы, связанные с удержанием электролита в реакционном аппарате, с подведением и отведением жидкости, с разделением жидкой и газовой фаз. По этим причинам использовать наземные десорбционные аппараты в условиях невесомости также невозможно.
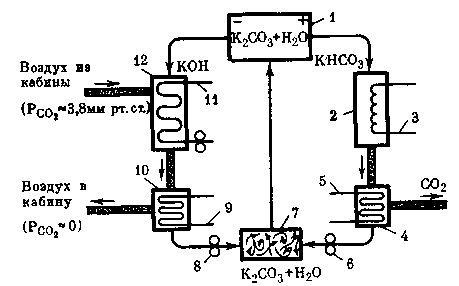
Рис. 18. Принципиальная схема абсорбции СО2 като-литом (КОН) и десорбции СО2 из анолита (КНСОз)
1 — электролизер,
2 — десорбер,
3 — нагревательный элемент,
4,10 — теплообменники-разделители,
5, 9, 11 — контуры хладоносителей,
6, 8 — щелочные насосы,
7 — смеситель,
12 — абсорбер
На основании исследований, проведенных С. Усыскиным и Р. Зигелем, установлено, что подведение тепла к десорберу и сам процесс выделения газа из жидкости при кипении в условиях ослабленного гравитационного поля или невесомости будут отличаться от аналогичных процессов в условиях Земли. При уменьшении интенсивности гравитационного поля, согласно теоретическим исследованиям, критический тепловой поток уменьшается. При пузырьковом кипении с ослаблением гравитационного поля уменьшается скорость свободно поднимающихся пузырьков и увеличивается их диаметр примерно пропорционально интенсивности поля в степени 1/3,5, т. е. при невесомости пленочное и пузырьковое кипение выглядят одинаково.
При рассмотрении данных процессов следует иметь в виду два критерия, касающихся процессов кипения: уровень нагрева, при котором динамические силы пузырьков преобладают и их величина оказывается достаточной для обеспечения удаления пузырьков с поверхности нагрева; скорость вынужденной конвекции, при которой силы сдвига вблизи поверхности нагрева преобладают и их величина является достаточной для удаления пара с поверхности нагрева.
Исследованиями С. Усыскина и Р. Зигеля существенного влияния гравитации на эти критерии процессов кипения не было установлено, т. е. можно полагать, что подвод тепла и кипение в условиях невесомости будут такими же, как и в земных условиях.
При электролизе растворов солей в настоящее время абсорбционно-десорбционные процессы осуществляются за счет искусственной циркуляции электролита с последующим разделением газожидкостной смеси в специальных аппаратах с капиллярно-пористыми элементами.
Принципиальная схема абсорбции и десорбции СО2 с использованием вторичных продуктов электролиза солей представлена на рис. 18.
Как уже отмечалось, по данной схеме абсорбция и десорбция СО2 осуществляются непрерывно и аппараты связаны в единой системе, замкнутой по газовым и жидкостным коммуникациям.
Удаление и концентрирование СО2 путем абсорбции при электролизе растворов солей с ионообменными мембранами
В электрохимических процессах при электролизе водных растворов щелочей и солей существенное влияние на внешнюю диффузионную кинетику оказывает явление, связанное с перераспределением под действием электрического поля в межэлектродном пространстве части ионов, не принимающих непосредственного участия в электродных процессах. Это приводит к возникновению градиентов концентраций и диффузионных потоков, создающих миграцию ионов в направлении, противоположном действию внешнего электрического поля. Такое явление вызывает увеличение общих энергозатрат и снижение возможностей системы в целом.
Как уже отмечалось, при электролизе водных растворов солей необходимо одновременно с получением водорода и кислорода получать в необходимом количестве и определенной концентрации анолит и католит. При электролизе водных растворов солей это достигается подбором удельной скорости электрохимического процесса (плотности тока) и скорости подвода электролита в электролизер с учетом возникающих при этом диффузионных потоков, зависящих прежде всего от разности потенциалов между электродами и температуры, ускоряющей или замедляющей этот процесс. Тесная взаимосвязь основных электрохимических и массообменных процессов в значительной степени усложняет получение анолита и католита в определенных количествах и необходимой концентрации. Локализация этих явлений может быть достигнута интенсификацией внешних массообменных потоков. Применение селективных мембран обеспечивает упорядоченное перемещение ионов различного заряда в межэлектрод-ном пространстве, что упрощает процесс получения необходимой концентрации анолита и католита.
Ионит является гетерогенной системой, состоящей из матрицы и жидкости в порах. В связи с этим скорости диффузионных потоков зависят от пространственного заполнения ионами матрицы и пористой структуры самой мембраны (пористость, тип пор, величина и распределение пор по объему).
Ионные мембраны, предназначенные для использования в электрохимических устройствах, должны обладать определенной селективностью, высокой электропроводностью, допустимым набуханием, прочностью и стойкостью в течение длительного времени.
Применение ионообменных мембран в электрохимических устройствах для регенерации газовой среды в отличие от электролиза растворов солей позволяет создать аппарат, выполняющий одновременно несколько функций: получение кислорода и водорода, очистку атмосферы от СО2 и одновременное получение СО2 100%-ной концентрации.
В аппарате с ионообменными мембранами под действием электрического поля обеспечивается направленный массоперенос ионов определенного заряда с достижением необходимой концентрации в соответствующих полостях, а также одновременное осуществление физико-химических реакций, приводящих к интенсивной хемосорбции СО2 из проходящего воздушного потока и образованию химически нестойких веществ, распадающихся с выделением углекислого газа.
В условиях реального космического полета, как и при электролизе растворов солей, организацию электрохимических и физико-химических процессов в электродиализаторе предполагается осуществлять созданием искусственной циркуляции электролита с последующим разделением газоэлектролитных продуктов в специальных аппаратах и применением капиллярно-пористых элементов.
Принципиальная схема регенерации газовой среды гермокабин, основанная на применении электрохимического устройства с ионообменными мембранами, представлена на рис. 19.
Электродиализатор 6 состоит из трех ионообменных мембран. Воздушный поток из гермообъекта проходит между ионообменными мембранами 8, 9, где осуществляется удаление СО2 посредством его хемосорбции
по реакциям
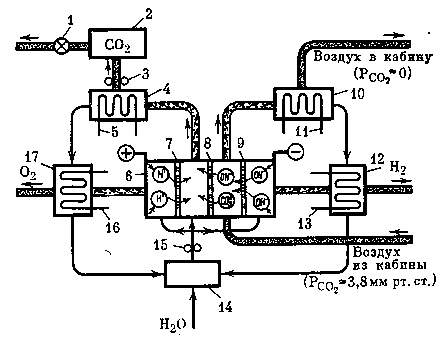
Рис. 19. Принципиальная схема электрохимического устройства (электродиализатора) с ионообменными мембранами
1 — редуктор,
2 — буферная емкость с углекислым газом,
3 — компрессор,
4, 10, 12, 17 — теплообменники-разделители,
5, 11, 13, 16 — контуры хладоносителей,
6 — электродиализатор,
7, 8, 9 — катионные и анионные мембраны,
14 — промежуточная емкость по воде,
15 — щелочной насос
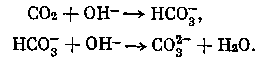
Отрицательно заряженные ионы НСОз СОз- под действием электрического поля переходят в полость, расположенную слева между катионообменной и анионообменной мембранами, в которой осуществляется десорбция СО2 по реакциям
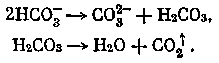
Из электродиализатора воздушный поток и образующиеся газы (СО2, Н2, О2) поступают на соответствующие теплообменники-разделители 4, 10, 12, 27, в которых происходит конденсация паров влаги и отделение жидкой фазы от газообразной. Жидкая фаза (водный раствор электролита и воды) нагнетается насосом 15 в соответствующие полости электродиализатора. Очищенный углекислый газ поступает в буферную емкость 2.
Применение ионообменных мембран в электрохимических аппаратах позволяет значительно интенсифицировать физико-химические процессы абсорбции и десорбции СО2 за счет создания оптимальных условий по концентрациям взаимодействующих реагентов и снижения диффузионных ограничений.
Однако в аппаратах с ионообменными мембранами в межэлектродном пространстве удельные характеристики мощности выше, чем в электрохимических аппаратах с проте-каемыми мембранами: на выделение 1 л О2 в час требуется 16—18 вт.
Удаление и концентрирование СО2 путем абсорбции в кислородо-водородном топливном элементе
Организация технологического процесса очистки атмосферы от СО2 и последующего его концентрирования в электрохимических устройствах типа кислородо-водородного топливного элемента представляет значительный интерес для интенсификации хемосорбцион-ных процессов за счет значительного снижения ограничений диффузионного характера, поскольку массообменные процессы зависят в основном только от скорости электрохимического процесса. Принципиальная схема ячейки топливного элемента представлена на рис. 20.
Ячейка состоит из двух пористых электродов 2, 5, вплотную примыкающих к пористой межэлектродной диафрагме 4. Активной частью пористого диффузионного электрода, находящегося в контакте с жидким электролитом, является область взаимодействия трех фаз — жидкости, газа и твердой фазы самого электрода. Поток воздуха (О2, СО2) из гермо-
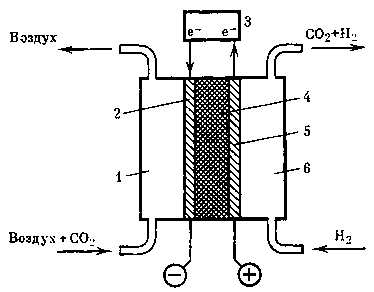
Рис. 20. Принципиальная схема концентратора СО2, основанная на использовании топливного элемента
1 — катодная камера,
2 — катод,
3 — потребитель электрической энергии,
4 — пористый межэлектродный элемент,
5 — анод,
в — анодная камера
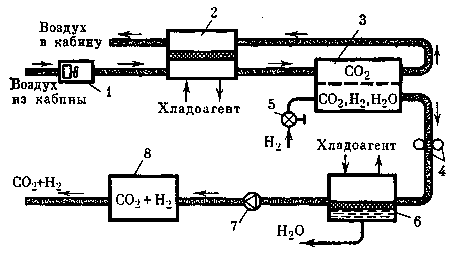
Рис. 21. Принципиальная схема очистки атмосферы от СО2, основанная на использовании топливного элемента
1 — воздухозаборник,
2 — влаготеплообменник,
3 — топливный элемент,
4 — компрессор,
5 — регулятор расхода,
6 — теплообменник-влагоотделитель,
7 — обратный клапан,
8 — буферная емкость
объекта пропускается через катодную камеру. На катоде осуществляется электрохимическая реакция, приводящая к ионизации кислорода и образованию гидроксила, от количества которого зависит процесс хемосорбции СО2. В общем виде катодные и анодные процессы можно представить следующим образом:
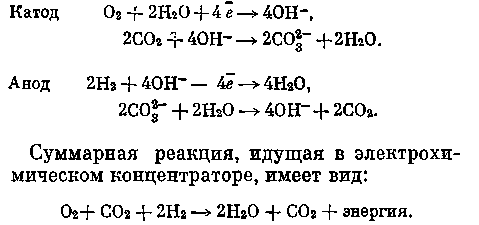
В данном электрохимическом аппарате в основном предполагается получать СО2 не в чистом виде, а в определенном соотношении с водородом. Как будет показано далее, такая газовая система (СО2—-Н2) с успехом может быть утилизирована для получения конечных веществ (С, СН4, Н2О). Одной из проблем организации такого технологического процесса следует считать разработку способа удаления воды, образующейся в результате химической реакции. В принципе удаление Н2О может осуществляться при температуре, близкой к 100°, или при более высокой температуре и повышенном давлении; при низких температурах и пониженном давлении; при циркуляции газа с обеспечением определенной разности температур газа и электролита.
Принципиальная схема очистки атмосферы от СО2, основанная на использовании топливного элемента, представлена на рис. 21.
Электрохимическая система очистки от СО2 состоит из побудителей газовоздушных потоков 1, 4, топливного элемента 3 и двух отдельных аппаратов 2, 6, помещенных на входе и выходе газовоздушных потоков топливного элемента, выполняющих роль основных согласующих и стабилизирующих звеньев в системе. Влаготеплообменник 2 выполняет роль стабилизатора топливного элемента по температуре и по концентрации электролита. Проходящий через катодную камеру воздушный поток за счет диффузионных процессов и чисто механического взаимодействия с электролитом насыщается влагой, изменяя в какой-то степени концентрацию электролита, что, естественно, влияет на качество организации электрохимического процесса. С целью стабилизации процесса в системе используется звено 2, передающее входному потоку влагу, которая была унесена выходящим потоком. Теплообменник-влагоотделитель 6 конденсирует Н2О из газовой смеси СО2 + Н2 и одновременно отделяет образовавшуюся жидкую фазу от газообразной.
Данная система представляет значительный интерес вследствие простоты организации технологического процесса и малой его энергоемкости.
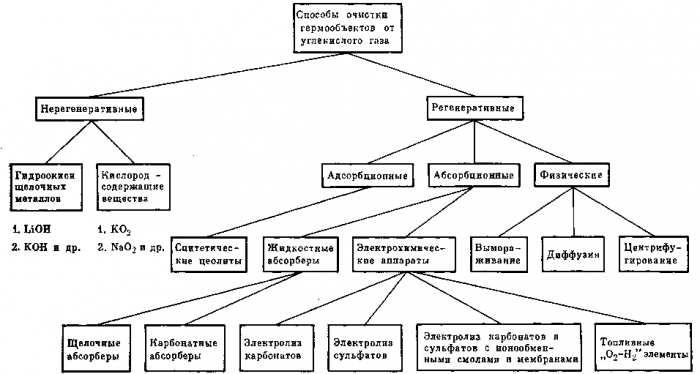
Рис. 22. Способы очистки воздуха гермообъектов от углекислого газа
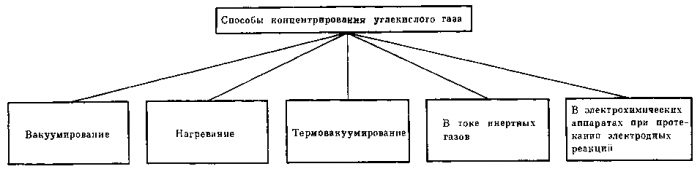
Рис. 23. Способы концентрирования углекислого газа
Систематизация основных способов удаления и концентрирования углекислого газа
Системы очистки атмосферы гермообъектов от углекислого газа и концентрирования его являются первым звеном, ответственным за последующую организацию процесса регенерации кислорода (в системах с кругооборотом по кислороду) и предопределяющим выбор технологических звеньев получения кислорода из СО2, Н2О или из их смеси.
Методы очистки воздуха от углекислого газа можно подразделить по фазовому принципу на «газ — твердое тело» и «газ — жидкость — твердое тело». Технологическая организация адсорбционных процессов в условиях динамической невесомости проста и не требует принципиально новых решений в отличие от абсорбционных процессов. Однако, несмотря на некоторую сложность осуществления абсорбции, она выгодно отличается компактностью и непрерывностью абсорбционно-десорбционных процессов.
Рассмотренные выше методы очистки и концентрирования углекислого газа можно представить в общем виде двумя схемами.
Выбор того или иного метода будет определяться прежде всего надежностью и стабильностью технологических процессов, сохраняющих неизменными свои рабочие характеристики в течение длительного периода эксплуатации.
Скачать реферат:
Пароль на архив: privetstudent.com