ПОНЯТИЕ О КОРРОЗИИ МЕТАЛЛОВ
Коррозией называется разрушение металла под химическим действием окружающей среды.
Металлы встречаются в природе преимущественно в виде соединений с неметаллическими элементами, например, железо — в виде Fe2О3 и др., алюминий — А12О3, медь — Cu2S и т. д.
Для получения металла в чистом виде необходима затрата энергии, так как металлургическими процессами нарушается равновесное состояние между металлом и веществами, с которыми он связан в естественном состоянии.
Полученные в результате металлургических процессов металлы под действием атмосферных условий (газов и влаги) снова стремятся перейти в устойчивые соединения с другими веществами, иначе говоря, корродируют.
В настоящее время коррозия выводит из строя ежегодно около 1 % находящегося в пользовании металла.
В изделиях и сооружениях в результате коррозии может происходить последовательное разрушение поверхности, образование раковин и приобретение металлом губчатого строения. Разработка современной теории коррозии основана на исследованиях Г. В. Акимова, Н. А. Изгарышева, Н. Д. Томашева и др.
ВИДЫ КОРРОЗИИ
Различают два основных вида коррозии металла: химическую и электрохимическую.
Химической коррозией называются процессы разрушения металла в сухих газах или в жидкостях, не проводящих электрического тока (масло, бензин).
Такого рода коррозия имеет, например, место при окислении металла в термических печах, при разъедании топочных связей и пр. Степень химической коррозии сильно возрастает с повышением температуры; в виде примера можно указать на цвета побежалости.
Скорость разрушения металла при химической коррозии определяется степенью сродства металла с кислородом и свойствами образующейся при этом пленки (ее плотностью, отсутствием в ней пор, прочностью прикрепления пленки к металлу).
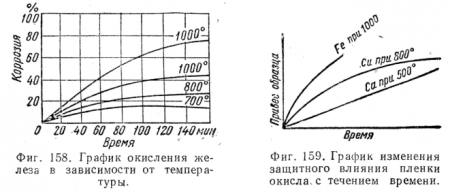
На фиг. 158 приведен график окисления железа в зависимости от температуры.
Опыт показывает, что пленка окисла обнаруживает защитные свойства, если объем окисла больше объема окисленного металла; так, для Са, Сu и Fe отношение объема окисла к объему окисленного металла соответственно равно 0,78; 1,70 и 2,06. Защитные свойства пленки окислов меди и железа можно видеть на фиг. 159; из графика видно, что для Са пленка не обнаруживает защитных свойств.
Переменный нагрев и охлаждение металла увеличивают скорость коррозии, так как колебания температуры нарушают цельность пленки.
Химическая коррозия может разрушать металл не только с поверхности, но и между кристаллическими зернами, проникая в глубь металла. В последнем случае коррозия называется межкристаллитной.
Электрохимической коррозией называется разрушение металла при соприкосновении с жидкостями, проводящими электрический ток. Происходящие здесь явления аналогичны тем, которые имеют место в гальваническом элементе.
Металлическая пластинка, погруженная в жидкость, проводящую ток, выделяет частицы, заряженные положительно, — ионы, а сама заряжается отрицательно — электронами. Между пластинкой и жидкостью устанавливается электростатическое равновесие.
Количество ионов, выделяемое различными металлами, различно, следовательно, различны и их потенциалы.
При соединении погруженных в жидкость пластинок из разнородных металлов проводником, находящимся вне жидкости, по последнему потечет ток (фиг. 160) электронов от А к В; одновременно и в жидкости возникает ток ионов от А к В. На поверхности пластинки В ионы нейтрализуются электронами, притекшими по проводнику.
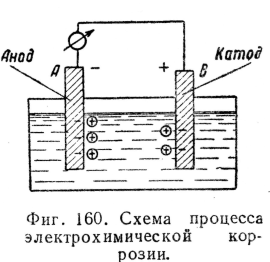
Включенный в цепь гальванометр покажет течение электричества в цепи.
В результате происходит разрушение пластинки А (анода).
В гальванической паре разрушается тот металл, который выделяет большее количество положительно заряженных ионов и, следовательно, сам получает более высокий отрицательный заряд. Для сравнения электроположительных свойств металлов их электродные потенциалы измеряются в одинаковых условиях по отношению к потенциалу водородного электрода, принятому равным нулю.
По мере убывания положительного заряда в паре с водородным электродом пли, как принято говорить, по мере убывания электроположительных свойств, металлы располагаются в ряд, называемый рядом напряжений: Au, Pt, Hg, Ag, Сu, Bi, Sb, (H2), Pb, Sn, Ni, Co, Cd, Fe, Cr, Zn, Mn, Al, Mg, Be, Na, K. Li.
Этот ряд составлен при условии, что определение электродных потенциалов производилось при нормальной концентрации раствора (в растворе, содержащем 1 г-эквивалент ионов данного металла на 1 л при 18° С).
Всякий металл, занимающий в этом ряду более правое положение, будет разрушаться в контакте с занимающими более левое положение и тем сильнее, чем дальше эти металлы находятся друг от друга в ряду.
В зависимости от электролита порядок расположения указанных металлов в ряде напряжений может быть и другой, а следовательно, может измениться и относительная способность к корродированию.
Скорость разъедания характеризуется силой тока между ними.
Величина этого тока может уменьшаться и коррозия замедляется, вследствие поляризации электродов и, в первую очередь, катода, на котором в процессе коррозии накапливаются электроны. Деполяризация катода (удаление электронов) может происходить двумя путями: а) путем выделения водорода на катоде с поглощением при этом электронов; такой процесс деполяризации имеет место в кислой среде; б) путем снятия с катода электронов газообразным кислородом, находящимся в растворе с образованием при этом гидроксил-ионов по уравнению
![]()
такого вида деполяризация характерна для нейтральных растворов.
Поляризация уменьшает электродвижущую силу пары и способна даже изменить знак потенциала. Поэтому интенсивность процесса разрушения металла при электрохимической коррозии зависит также и от степени поляризации электродов: чем больше поляризация, тем слабее коррозия и наоборот.
Различают следующие виды электрохимической коррозии: гальванокоррозйю и коррозию под влиянием блуждающих токов.
Гальваиокоррозией называется процесс разрушения металла при соприкосновении разнородных металлов в присутствии электролита; в качестве примера можно указать на разрушение железа паровых котлов, образующих гальваническую пару с топочной медью. Во многих случаях процесс гальванокоррозии обусловливается неоднородностью структуры металла или сплава. В качестве примера можно указать на разрушение перлита; здесь отрицательно заряженным является феррит (по отношению к цементиту), подвергающийся разрушению в присутствии влаги. Коррозию, возникающую в результате неоднородности структуры, т. е. вследствие наличия микроэлементов, называют микрокоррозией или структурной коррозией.
Распространенное мнение, что микрокоррозии подвергаются только сплавы, нельзя считать вполне правильным, так как неоднородность структуры может иметь место и в чистом металле, например, вследствие наклепа. Кроме того, некоторая возможность микрокоррозии чистого металла может вызываться неодинаковостью потенциалов в различных точках поверхности металла, которая никогда не бывает абсолютно однородной.
Однако очевидно, что чистые металлы могут подвергаться микрокоррозии в меньшей мере по сравнению со сложным по структуре сплавом и что микрокоррозия проявляется тем меньше, чем меньше неоднородность поверхности металла.
Вызывающие микрокоррозию токи весьма малы: величина их может быть равна приблизительно 10-6—10-7 а/см2. Малая величина этих токов компенсируется продолжительностью их действия.
В районах, обслуживаемых электрическими железными дорогами, токи, возвращающиеся из сети на станцию через рельсы, могут частично ответвляться, проходя по металлу предметов, находящихся в почве (водопроводных труб, каркасов железобетонных сооружений и пр.). В этом случае почва, содержащая растворы солей, играет роль электролита; разрушению подвергается металл, являющийся анодом. Такой вид коррозии называют коррозией под влиянием блуждающих токов.
Факторы, влияющие на скорость коррозии
Внутренние факторы. К внутренним факторам, влияющим на скорость коррозии, относятся химический состав, структура, внутренние напряжения и состояние поверхности металла. Чистые металлы при прочих равных условиях менее подвержены коррозии, чем сплавы.
Менее других подвержены коррозии сплавы, имеющие структуру твердого раствора.
Внутренние напряжения материала способствуют коррозии его; наклепанный материал разъедается больше, чем материал с нормальной структурой. Наличие внутренних напряжений и наклеп способствуют образованию гальванопар.
Чем ровнее поверхность металла, тем меньше он корродирует; при повреждении поверхности металл начинает корродировать быстрее. Причиной этого является то обстоятельство, что гладкая поверхность лучше покрывается защитной пленкой.
Внешние факторы. К внешним факторам, влияющим на скорость коррозии, относятся действие на металл окружающей среды: воды, кислот, щелочей, солей и газов, а также температура окружающей среды.
Коррозионная усталость металла
Коррозионной усталостью металла называется разрушение металла, находящегося под одновременным воздействием циклических напряжений и факторов, вызывающих коррозию.
Причиной быстрого разрушения металла является, с одной стороны, разрушение пленки окисла и, следовательно, неиспользование ее защитных свойств, а с другой — поверхностное разрушение металла, вызываемое коррозией, способствующее возникновению трещин усталости. Под влиянием коррозии предел усталости металла снижается в некоторых случаях на 65% против нормальной величины.
Скачать реферат:
Пароль на архив: privetstudent.com