Свойства белков
Молекулярная масса белков
Ученых, изучающих свойства белков, прежде всего интересовали вопросы: каковы размеры белковых молекул, какова их форма, молекулярная масса? Ответы на них получить было не просто. Определять относительную молекулярную массу по повышению температуры кипения белковых растворов, как это принято для других веществ, невозможно из-за того, что белки нельзя кипятить. Определение этого показателя по понижению температуры замерзания дает неточные результаты. К тому же белки никогда не встречаются в чистом виде. Они связаны с химическими соединениями других классов, в том числе и с солями, от которых трудно полностью избавиться. А присутствие солей значительно искажает результаты определения молекулярных масс традиционными методами. И все же методами, разработанными в конце прошлого века и в начале нашего столетия, было доказано, что молекулярная масса белков колеблется в больших пределах — от 14 000 до 45 000 и более. С такими необычными молекулами химики ранее не работали.
Принципиально новый и достаточно точный метод определения молекулярной массы предложил Т. Сведберг. Под действием силы инерции, развивающейся в ультрацентрифугах, белки осаждаются в зависимости от размера и массы их молекул. Центрифуга — это аппарат, основной частью которого является вращающийся ротор с вставленными в него пробирками с исследуемыми белковыми растворами. Ультрацентрифуги дают 70 000 и более оборотов в минуту. Скорость оседания частиц белка при этом значительно увеличивается.
А зная скорость, можно по специальным формулам вычислить относительные молекулярные массы белков. О значительных различиях молекулярных масс свидетельствуют следующие цифры: белок-фермент рибонуклеаза имеет массу 13700, яичный альбумин — 45000, y-глобулин сыворотки крови—160000, а один из растительных белков — вирус помидора—10 млн. За нижний предел молекулярной массы белков принято значение 6000. О числе атомов в составе белков можно судить по элементарному составу, например, лактоглобулина: С1864 H3012 N68 S21.
При растворении в воде белки дают коллоидные растворы, частицы в которых довольно крупные—от 0,1 до 0,001 мкм. Для этих растворов характерен эффект Тиндаля. Эффект заключается в том, что при пропускании пучка света через раствор коллоидных частиц свет рассеивается и становится хорошо заметным в сосуде с раствором.
На разнице в молекулярных массах белков и других низкомолекулярных частиц основан метод очистки белков от примеси. Для этого раствор белка наливают в мешочек из целлофана или пергамента и помещают его в чистый растворитель (воду). Молекулы низкомолекулярных веществ, которые находятся с белком в мешочке и загрязняют его, переходят постепенно через поры целлофана или пергамента в растворитель, а белок остается. Если несколько раз сменить воду, окружающую мешочек, то белковый раствор можно полностью освободить от солей и других сопутствующих низкомолекулярных веществ. Такой метод очистки белков называют диализом.
Растворимость белков
В аминокислотах, входящих в состав белков, содержатся полярные функциональные группы, обладающие сродством к воде. Поэтому белки растворяются в воде хорошо, образуя коллоидные растворы. В то же время из-за большого размера молекул растворы белков оказываются неустойчивыми. Под влиянием различных водоотнимающих веществ (спирт, ацетон, соли и т. д.) белки выпадают в осадок. Действительно, если отнять воду от белка, от его полярных функциональных групп,
то огромные молекулы не смогут уже держаться в растворителе и будут, сталкиваясь друг с другом, осаждаться. Количество воды, которое может связать белок, довольно велико. Например, белки некоторых тканей могут образовывать своеобразный каркас, который способен удержать в своих ячейках до 99 % воды. Именно такое количество воды содержится, например, у медуз за счет своеобразной структуры их тел.
Одним из важных свойств белка является его фракционное высаливание, т. е. выделение белка из раствора после прибавления растворов солей различных концентраций. Так, для выделения из сыворотки крови глобулинов добавляют к ней сульфат аммония (NH4)2 SO4 до полунасыщения. После отделения белков глобулинов можно взять ту же соль, но более насыщенной концентрации, и осадить альбумины. Разделив таким образом две эти фракции, можно избавиться от соли диализом и получить отдельно альбумины и глобулины. Высаливание не приводит к инактивации белка. Он сохраняет все свои природные свойства и может быть опять при необходимости растворен в воде. Такое же действие оказывает на растворы белков этиловый спирт, действующий как мощный водоотнимающий фактор. Но действие спирта должно быть непродолжительным, иначе белок потеряет активность и способность опять растворяться в воде.
Кроме нейтральных солей, осаждение белков вызывают соли тяжелых металлов (Hg, Zn, Ag, Pb и др.) уже в небольших концентрациях. Они образуют комплексы с функциональными группами белков, изменяют структуру белков, которые в связи с этим теряют устойчивость в растворе и осаждаются. В ряде случаев осаждение солями тяжелых металлов приводит к потере природных свойств белка и представляет необратимый процесс. Такие белки теряют способность растворяться в воде, а ферменты не способны катализировать реакции.
Большое практическое применение получил метод осаждения белков органическими кислотами, в частности трихлоруксусной кислотой CCI3COOH. Она осаждает только белки и не осаждает полипептиды. Это очень важно в медицине: когда хотят определить небелковый азот крови, предварительно осаждают белок трихлор-уксусной кислотой, а с надосадочной жидкостью проводят необходимые исследования.
Денатурация
Потеря натуральных свойств белка, которая происходит при его осаждении тяжелыми металлами, носит название денатурации. Она может происходить и под влиянием других физических или химических факторов. В этом случае происходят внутримолекулярные изменения, приводящие чаще всего к потере способности белков растворяться. Денатурация подразумевает различные превращения молекулы белка, но не разрыв полипептидной цепочки, т. е. она не затрагивает первичную структуру белка.
О том, что произошла денатурация белка, можно судить по ряду признаков: а) уменьшается растворимость белка; б) изменяются форма и размеры молекулы; в) теряется ферментативная активность; г) изменяются оптические свойства белка и т. д. У различных белков это проявляется по-разному.
В результате денатурации часто оказывается, что в белке появились какие-то новые, «дополнительные» функциональные группы. Это произошло потому, что при разворачивании молекулы обнажаются замаскированные внутри молекулы SH-, ОН-группы и другие, доступные для реакций.
Кроме указанных причин, денатурация может быть вызвана нагреванием белка. При этом происходит увеличение теплового движения отдельных участков полипептидной нити, водородные связи разрываются, белок разворачивается и приобретает необычную, неприродную форму, водородные связи (и др.) устанавливаются в несвойственных данной молекуле местах и конфигурация молекулы меняется. Гидратная оболочка вокруг такого белка нарушается, отдельные молекулы белка соединяются между собой в более крупные частицы, слипаются и уже не могут держаться в растворе—начинается процесс осаждения денатурированного белка. Процесс восстановления структуры белка после денатурации называют ренатурацией. Иногда денатурированный белок не выпадает из раствора, так как он имеет большое число зарядов, препятствующих сближению и слипанию отдельных частиц. Если эти заряды снять или уменьшить, добавив в раствор ионы с противоположным знаком, то взвешенные частички начнут слипаться и выпадать в осадок.
Какое практическое значение может иметь денатурированный белок? Всегда ли нужно препятствовать процессу денатурации? На все эти вопросы нельзя дать однозначный ответ. Кулинарная обработка мяса, яиц и других белоксодержащих продуктов приводит к денатурации белка. Денатурация в этом случае готовит молекулы белка к воздействию пищеварительных ферментов, содержащихся в желудочном и кишечном соке. Денатурацию используют при отравлении как лечебную процедуру. Например, при отравлении солями тяжелых металлов больному дают молоко или большое количество сырого яичного белка. Белки связывают тяжелые металлы. Образуются нерастворимые комплексы, удерживающие соли тяжелых металлов, которые не могут всосаться из желудка в кровь. Ядовитое действие металлов нейтрализовано. Если после этого у больного вызвать рвоту, яд будет удален из организма.
Однако в ряде случаев с денатурацией необходимо бороться, прежде всего при получении в чистом виде белков, ферментов, гормонов, чтобы сохранить их активность и другие природные свойства, уберечь от повреждения.
При выделении белков из биологического материала (из печени животных, мышц, сыворотки крови и т. д.) часто прибегают к различным физико-химическим приемам: нагреванию, замораживанию с последующим оттаиванием, действию органических и неорганических веществ, ионизирующего излучения, ультразвука. Многие из этих приемов, особенно при продолжительном воздействии, могут вызвать денатурацию. Например, разрушение мембран клеток и субклеточных частиц для последующего извлечения из них белка осуществляют действием ультразвука или чередованием замораживания-оттаивания. Но при этом могут быть повреждены (денатурированы) содержащиеся в клетках белки. Поэтому выделение белков проводят при охлаждении, чтобы исключить тепловую денатурацию, при определенных значениях кислотности, в присутствии веществ, тормозящих денатурацию.
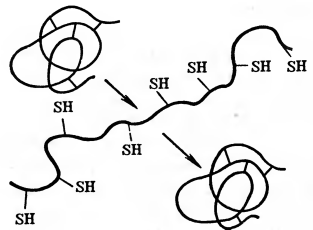
Рис. 1 Схема обратимой денатурации белка.
Денатурация может быть обратимой. Многие вещества действуют на белок до тех пор, пока они находятся в растворе; при их удалении структура и свойства белка восстанавливаются. Однако продолжительное действие денатурирующего агента или сильные денатурирующие факторы приводят к глубоким необратимым изменениям структуры и свойств белка.
Необходимо отметить, что денатурация не приводит к разрушению ковалентных связей. Любые изменения, в результате которых происходит выделение из белка аммиака или других веществ, расщепление до пептидов и другие превращения, связанные с отщеплением части белка, уже не считаются денатурацией.
Белки-электролиты.
Изоэлектрическая точка
Аминокислоты, составляющие белки, относятся к амфотерным веществам, обладающим одновременно свойствами и кислот, и оснований. Это объясняется тем, что не все амино- и карбоксильные группы аминокислот заняты в образовании пептидных связей. В молекулах диаминокислот остаются свободными аминогруппы, а в молекулах моноаминодикарбоновых кислот — карбоксильные группы. Например, при растворении белка в воде от карбоксильных групп отщепляются протоны, и белок приобретает свойства слабой кислоты:
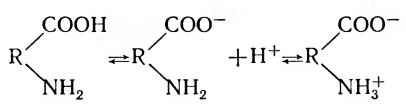
Появляющиеся в растворе протоны тотчас же присоединяются к NН2-группам, имеющим основной характер, вследствие чего они переходят в ионизированную форму — NH3+
Таким образом, белок несет положительные и отрицательные заряды, т. е. является диполярным ионом.
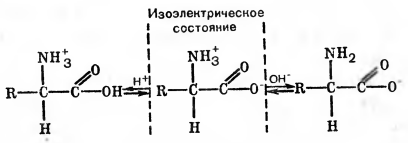
Рис. 2 Как образуются заряды у аминокислоты.
Белки могут изменять свои заряды в зависимости от кислотности растворов. В кислой среде они обычно движутся к катоду, в щелочной — к аноду.
Амфотерность белков определяется не только присутствием свободных карбоксильных или аминогрупп в белке, но и наличием других функциональных группировок. Слабо выраженными кислотными свойствами обладают SH-группа цистеина и ОН-группа тирозина.
Если заряд белковой молекулы изменяется при изменении pH, значит, должна существовать такая точка, в которой белок не несет в избытке положительный и отрицательный заряд. Такое значение pH, когда заряд белка равен нулю, называется изоэлектрической точкой. Изоэлектрические точки некоторых белков представлены в таблице:
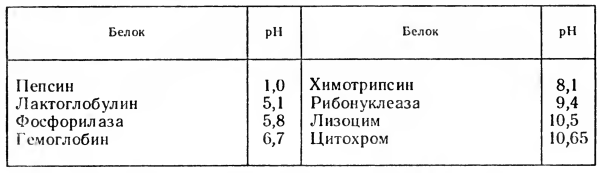
В изоэлектрической точке белки наименее устойчивы. Поэтому для более полного осаждения белка необходимы два условия: устранение гидратной оболочки какими-либо водоотнимающими веществами и снятие избыточного электрического заряда. Для этого осаждение белка рекомендуют проводить при определенных значениях pH, т. е. подкисляют или подщелачивают раствор.
Если белок находится в растворе при значениях pH выше изоэлектрической точки, то он обладает суммарным отрицательным зарядом и движется в электрическом поле к аноду. От присутствия в растворах некоторых даже нейтральных солей белки могут существенно смещать значение своей изоэлектрической точки. Соли влияют на степень ионизации многочисленных боковых функциональных групп в макромолекуле белка. Белок может просто связывать некоторые ионы растворов, например ионы кальция, магния, хлора, фосфаты. После такого связывания изоэлектрическая точка белка существенно меняется.
Таким образом, природа среды, в которой растворен белок, в значительной степени влияет на его изоэлектрическую точку.
Наличие зарядов у белковых молекул позволяет проводить тонкое разделение различных белковых фракции путем электрофореза в зависимости от значения и знака заряда. Этот метод широко используется на практике для изучения состава белков крови. Такие данные дают большую информацию для диагностики заболеваний и контроля за эффективностью проводимого лечения. Большое значение имеет этот метод для биологии и сельского хозяйства.
Скачать реферат:
Пароль на архив: privetstudent.com