Химико-биологический факультет
Кафедра общей биологии
ДИПЛОМНАЯ РАБОТА
Микроструктурная реорганизация и минеральный состав селезенки крыс при введении наночастиц железа
Аннотация
Дипломная работа состоит из 65 страниц, введения, трех глав, заключения, в том числе 7 таблиц, 14 рисунков, 60 источников литературы и приложения.
Во введении представлена актуальность выбранной темы, а также задачи, поставленные перед нами в ходе работы.
В первой главе рассмотрены общая характеристика наночастиц металлов, виды, свойства и получение наночастиц, а также структурнофункциональная организация селезенки и регуляция апоптоза.
Вторая глава отображает собственно методику исследований.
В третьей главе представлены результаты исследований структурнофункциональных изменений селезенки при введении наночастиц железа, а также исследовали химический статус селезенки.
В заключении подведены итоги проделанной работы.
The Summary
The thesis consists of 65 pages, introduction, three chapters, conclusions, including 7 tables, 14 figures, 60 sources and applications.
In the introduction presents the relevance of the theme, as well as the tasks set before us in the course of work.
In the first chapter describes the general characteristics of nanoparticles of metals, types, properties and obtaining nanoparticles, as well as the structure of the spleen and regulation of apoptosis.
The second chapter shows the actual methodology of research.
In the third chapter presents the results of investigations of structural and functional changes of the spleen in the introduction of iron nanoparticles, and examined the chemical status of the spleen.
In conclusion summarized.
Содержание
Введение
1. Обзор литературы
1. 1 Наночастицы (определения, общая информация, история изучения
1. 2 Классификация наночастиц
1. 3 Свойства наночастиц металлов
1. 4 Способы получения наночастиц
1. 5 Биологические эффекты наночастиц при взаимодействии с живыми организмами
1. 6 Структурно-функциональная организация селезенки
1. 7 Общая характеристика и регуляция апоптоза. Микроэлементы и апоптоз
2 Материалы и методы исследования
3 Результаты собственных исследований
3. 1 Структурно-функциональные изменения в селезенке
3. 2 Анализ разницы концентрации химических элементов селезенки при введении наночастиц железа
Заключение
Список использованных источников
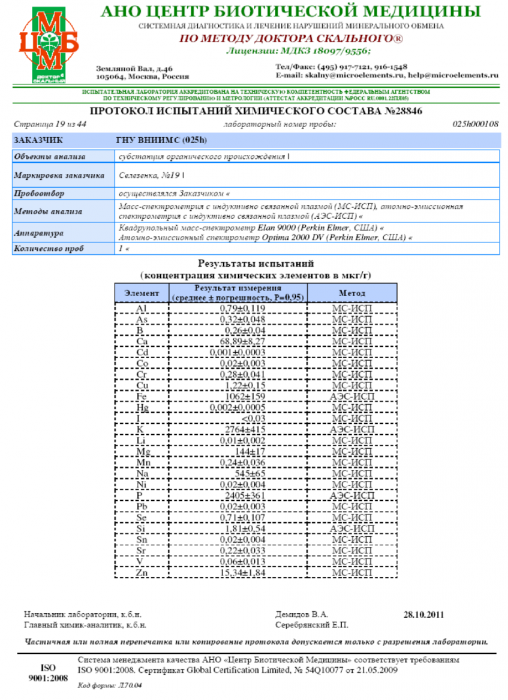
Приложение А Протокол испытаний химического состава
Введение
В развитии современных нанотехнологий значительную роль играют исследования наночастиц металлов. Это обусловлено, прежде всего, широким спектром возможностей их практического применения, в которых используются специфические свойства как самих наночастиц, так и модифицированных ими материалов. Наиболее разработаны, на сегодняшний день, возможности использования наночастиц металлов при создании новых катализаторов для различных промышленных процессов. Хорошие перспективы открываются и для применения наночастиц металлов в других областях техники, а также в биологии и медицине. Возможности применения наночастиц для диагностики и лечения различных (в том числе онкологических) заболеваний, а также в иммунохимических методах исследования уже активно изучаются в новом направлении экспериментальной медицины, получившем название «Наномедицина». Показано, в частности, что наночастицы серебра могут использоваться для получения различных материалов с бактерицидными свойствами, а наночастицы золота - для повышения эффективности и уменьшения побочных эффектов в радиотермальной терапии опухолей.
В то же время, за последнее десятилетие установлено, что наночастицы различных видов, особенно наночастицы металлов, попадая в организм человека, могут стать причиной серьезных заболеваний (нанопатологий). Известно, что наночастицы металлов могут проникать в организм человека различными путями: через слизистые оболочки дыхательных путей и пищеварительного тракта, трансдермально (например, при использовании косметических средств), через кровоток в составе вакцин и сывороток и т. д. Опасность распространения нанопатологий, хотя еще и не вполне осознана, но несомненно велика уже сегодня, и, очевидно, будет нарастать в будущем. Выяснение причин патологического действия наночастиц и разработка способов борьбы с заболеваниями, вызванными проникновением в организм наночастиц, становятся сейчас предметом нового направления в экспериментальной медицине.
Таким образом, можно утверждать, что определение путей и способов воздействия наночастиц металлов на живой организм - это чрезвычайно важная и актуальная работа, необходимая, во-первых, для улучшения имеющихся и создания новых лекарственных средств или способов лечения, то есть для наномедицины, во-вторых, для выяснения причин нанопатологий и, в третьих, для установления научно обоснованных допустимых диапазонов концентраций и размеров наночастиц в воде, воздухе или в составе различных материалов, с которыми контактирует человек.
Возможности исследования свойств наночастиц металлов, разработки вариантов их практического применения, а также выяснения механизмов их биологического действия в значительной степени зависят от способа получения, который во многих случаях определяет их структуру, размеры, физические и химические свойства и, главное, стабильность - время жизни в наноразмерном состоянии.
Цель работы: изучить морфологическую характеристику селезенки при внутримышечном введение наночастиц железа.
Задачи работы:
1 Провести анализ литературы по данной теме.
2 Изучить изменение концентрации химических элементов селезенки крыс при введении наночастиц железа.
3 Исследовать качественную реакцию Перлса в селезенке крыс при введении наночастиц железа.
1 Обзор литературы
1. 1 Наночастицы (история изучения, определения, общая информация)
Многие источники, в первую очередь англоязычные, первое упоминание методов, которые впоследствии будут названы нанотехнологией, связывают с известным выступлением Ричарда Фейнмана «Там внизу много места» (англ. «There’s Plenty of Room at the Bottom»), сделанным им в 1959 году в Калифорнийском технологическом институте на ежегодной встрече Американского физического общества. Ричард Фейнман предположил, что возможно механически перемещать одиночные атомы, при помощи манипулятора соответствующего размера, по крайней мере, такой процесс не противоречил бы известным на сегодняшний день физическим законам. Этот манипулятор он предложил делать следующим способом. Необходимо построить механизм, создававший бы свою копию, только на порядок меньшую. Созданный меньший механизм должен опять создать свою копию, опять на порядок меньшую и так до тех пор, пока размеры механизма не будут соизмеримы с размерами порядка одного атома. При этом необходимо будет делать изменения в устройстве этого механизма, так как силы гравитации, действующие в макромире будут оказывать все меньшее влияние, а силы межмолекулярных взаимодействий и Ван-дер-ваальсовые силы будут все больше влиять на работу механизма. Последний этап — полученный механизм соберёт свою копию из отдельных атомов. Принципиально число таких копий неограниченно, можно будет за короткое время создать любое число таких машин. Эти машины смогут таким же способом, поатомной сборкой собирать макровещи. Это позволит сделать вещи на порядок дешевле — таким роботам (нанороботам) нужно будет дать только необходимое количество молекул и энергию, и написать программу для сборки необходимых предметов. До сих пор никто не смог опровергнуть эту возможность, но и никому пока не удалось создать такие механизмы. Принципиальный недостаток такого робота — невозможность создания механизма из одного атома [2].
Впервые термин «нанотехнология» употребил Норио Танигути в 1974 году. Он назвал этим термином производство изделий размером несколько нанометров. В 1980-х годах этот термин использовал Эрик К. Дрекслер в своих книгах: «Машины создания: грядёт эра нанотехнологии» («Engines of Creation: The Coming Era of Nanotechnology») и «Nanosystems: Molecular Machinery, Manufacturing, and Computation». Центральное место в его исследованиях играли математические расчёты, с помощью которых можно было проанализировать работу устройства размерами в несколько нанометров.
Прежде всего, рассмотрим некоторые общие понятия.
Нанообъект - это физический объект исследований (и разработок), размеры которого принято измерять в нанометрах.
Нанотехнология имеет дело как с отдельными нанообъектами, так и с материалами на их основе, а также процессами на наноуровне. К наноматериалам относятся такие материалы, основные физические характеристики которых определяются содержащимися в них нанообъектами.
Наноматериалы делятся на компактные материалы и нанодисперсии; к первым относятся так называемые «наноструктурированные» материалы, т. е. изотропные по макросоставу материалы, повторяющимися элементами, структуры которых являются группировки (области), имеющие размеры нескольких нанометров, иногда десятки нанометров и более; иными словами, наноструктурированные материалы состоят из непосредственно контактирующих между собой нанообъектов. В отличие от этого, нанодисперсии состоят из среды диспергирования (вакуум, газ, жидкость или твёрдое тело), в которой распределены изолированные друг от друга нанообъекты. Расстояние между нанообъектами в нанодисперсиях может меняться в достаточно широких пределах от десятков нанометров до долей нанометра; в последнем случае мы имеем дело с нанопорошками, где нанообъекты разделены тонкими (часто -моноатомными) слоями из лёгких атомов, препятствущих их агломерации [3].
Наночастицы - это гигантские псевдомолекулы, имеющие сложное внутреннее строение, во многих случаях ядро и оболочку, часто - внешние функциональные группы и т. п. Их уникальные магнитные свойства возникают при размерах 2-30 нм. Ограничение по размерам связано с тем, что наночастицы, будучи, как всякие частицы, частью целого, при достижении некоторых размеров начинают резко отличаться от породившего их целого; оценки показывают, что существенные различия начинают возникать, как правило, при размерах частиц ниже ~ 30 нм. Для магнитных наночастиц это значение по порядку величины совпадает с теоретически оцененными наименьшими размерами магнитного домена для большинства магнитных материалов.
Наночастицы и наноматериалы обладают комплексом физических, химических свойств и биологическим действием, которые часто радикально отличаются от свойств тех же веществ в форме сплошных сред или дисперсий частиц микронного и более крупного размера. Можно выделить следующие физико-химические особенности поведения веществ в наноразмерном состоянии [2].
Во-первых, это увеличение растворимости и реакционной способности веществ на поверхностях высокой кривизны, что хорошо известно из классической коллоидной химии. Для макрочастиц (размерами порядка микрона и более) данный эффект незначителен - не более долей процента. Однако огромная кривизна поверхности наночастиц и изменение топологии связи атомов на поверхности приводит к резкому изменению их химических и токсикологических свойств. Классическим примером этого служит сернокислый барий - BaSO4, который, будучи представлен кристаллами размером в десятки и сотни микрон, практически совершенно нерастворим в воде, биологически инертен, нетоксичен и используется в медицине в качестве рентгеноконтрастного вещества - «бариевая каша». Однако если измельчить эту соль до размера наночастиц, то растворимость входящего в её состав бария резко возрастает - и при попадании таких наночастиц внутрь возможно отравление этим токсичным металлом.
Во-вторых, это очень высокая удельная (в расчёте на единицу массы) поверхность наноматериалов, что увеличивает их адсорбционную ёмкость, химическую реакционную способность и каталитические свойства. Это может приводить, в частности, к увеличению продукции свободных радикалов и активных форм кислорода и далее к повреждению биологических структур -липидов, белков, нуклеиновых кислот, в частности ДНК. Именно таким, по современным данным, является механизм токсического действия наночастиц кварца, двуокиси титана, окислов алюминия, церия, железа.
В-третьих, предполагается, что наночастицы вследствие своих небольших размеров могут воздействовать на нуклеиновые кислоты (вызывая, в частности, образование аддуктов ДНК), белки, встраиваться в мембраны, проникать в клеточные органеллы и тем самым изменять функции биоструктур [10].
Процессы переноса наночастиц в окружающей среде с воздушными и водными потоками, их накопление в почве, воде, донных отложениях могут также значительно отличаться от поведения частиц веществ более крупного размера. Наночастицы ряда веществ, например углерода (сажа), некоторых металлов, двуокиси титана вследствие своих малых размеров глубоко проникают в лёгкие с вдыхаемым воздухом, фиксируются в альвеолах и могут оттуда поступать в кровь и в различные внутренние органы, включая головой мозг [4].
В-четвёртых, из-за своей высокоразвитой поверхности наночастицы двуокиси кремния, титана, окиси алюминия и других веществ способны поглощать на единицу своей массы во много раз больше адсорбируемых веществ (ионов тяжёлых металлов, ядохимикатов, радионуклидов), чем аналогичные макроскопические дисперсии. В результате становится возможным усиление транспорта внутрь клетки вместе с наночастицами этих ядов, что резко усиливает их и без того высокую токсичность (так называемый эффект «троянского коня») [1].
В-пятых, из-за малого размера наночастицы могут не распознаваться защитными системами организма, они не подвергаются биотрансформации и не выводятся из организма. Это может приводить к накоплению наноматериалов в растительных, животных организмах, а также микроорганизмах, передаче по пищевой цепи, что тем самым увеличивает их поступление во внутреннюю среду организма человека.
Многие из перечисленных эффектов в настоящее время выявлены экспериментально, то есть их существование можно считать научно доказанным. Таким образом, с разнообразными наноматериалами связаны серьёзные риски неблагоприятного воздействия на организм человека, характеристика которых во всех случаях внедрения новых наноматериалов в производственную и бытовую сферы обязательна [1].
1. 2 Классификация наночастиц
Формальными признаками наночастиц являются сферическая форма и размер от 1 до 250 - 300 нм. В связи с этим, в группу наночастиц относят весьма разнородные по химическому строению и физическим свойствам частицы (таблица 1) [3].
Таблица 1 - Классификация наночастиц
|
Виды наночастиц |
Разновидности (примеры) |
|
Углеродные наночастицы |
Фуллерены Цельноуглеродные наночастицы |
|
Кремнеземные наночастицы |
Аэросил |
|
Дендримеры |
Полиамидоамин Полилизин |
|
Липосомы |
Малые однослойные липосомы Большие однослойные липосомы Многослойные липосомы |
|
Полимерные мицеллы |
Полиаспартат-b-полиэтиленгликоль Поликапролактон-b-метокси-полиэтиленгликоль |
|
Полимерные биодеградируемые наночастицы |
Синтетические Полиметилметакрилат Полиметилцианакрилат и др. Гамма-полиглутаминовая кислота Полилактид Поли(лактид-ко-гликолид) Натуральные Хитозан Альбумин Желатин Агароза |
|
Квантовые точки |
Селенид кадмия Теллурид кадмия Фосфид индия Арсенид индия |
|
Металлические наночастицы |
Золото Серебро |
|
Суперпарамагнитные частицы |
Оксид железа |
|
Перфторуглеродные наночастицы |
Наночастицы, состоящие из жидкого перфторуглеродного ядра, покрытые липидным монослоем |
Принципиально возможно деление наночастиц на органические (например, фуллерены, дендримеры) и неорганические (металлические и кварцевые наночастицы). Физико-химические свойства наночастиц предопределяют их назначение в наномедицине. Например, четко зависящая от размера квантовой точки флуоресцентная эмиссия делает эти наночастицы незаменимыми для молекулярной визуализации, а разветвленная структура дендримеров дает широкие возможности для их функционализации и, следовательно, превращает их в перспективные средства для доставки лекарственных препаратов [3].
1. 3 Свойства наночастиц металлов
Среди металлических наночастиц наиболее известны наночастицы таких благородных металлов, как золото и серебро. Наночастицы золота, обладающие целым рядом уникальных характеристик (оптические свойства, прочность, высокая площадь поверхности), в основном используются в диагностических целях. Наночастицы золота могут служить для усиления сигнала при проведении иммуноферментного анализа за счет их связывания с антителами, также применяли наночастицы золота для повышения чувствительности иммунохроматографических диагностических полосок. При этом с наночастицами золота связывались как первичные, так и вторичные антитела. Разработанный иммуноаналитический набор позволял определять хорионический гонадотропин в концентрации, приближающейся к 1 пг/мл. Чувствительность хемилюминесцентной детекции антител также может быть во много раз повышена при использовании наночастиц золота нерегулярной формы, каталитическая активность которых в 100 раз выше, чем у наночастиц сферической формы. Электрохимический подход, основанный на частичном замещении электродов наночастицами золота, недавно был использован для безметочной детекции раково-эмбрионального антигена. Полученные иммуноаналитические наборы показали прекрасную воспроизводимость данных. Примечательно, что наночастицы серебра в последние годы с успехом использовались для усиления флуоресценции в иммунодиагностике [7].
В ближайшем будущем ожидается дальнейшее усовершенствование диагностических подходов, основанных на использовании наночастиц золота. В частности, большой потенциал имеют разработки методов функционализации поверхности этих наночастиц с помощью углеводов и повышения чувствительности наносенсоров на основе золотых наночастиц с «профилизацией» их диагностических возможностей.
Типичные наночастицы серебра имеют размеры 25 нм. Они имеют чрезвычайно большую удельную площадь поверхности, что увеличивает область контакта серебра с бактериями или вирусами, значительно улучшая его бактерицидные действия. Таким образом, применение серебра в виде наночастиц позволяет в сотни раз снизить концентрацию серебра с сохранением всех бактерицидных свойств. Бактерицидная добавка на основе наночастиц серебра является одним из последних достижений отечественной науки в области нанобиотехнологий [21].
Действие серебра специфично не по инфекции (как у антибиотиков), а по клеточной структуре. Любая клетка без химически устойчивой стенки (такое клеточное строение имеют бактерии и другие организмы без клеточной стенки, например, внеклеточные вирусы) подвержена воздействию серебра. Поскольку клетки млекопитающих имеют мембрану совершенно другого типа (не содержащую пептидогликанов), серебро никаким образом не действует на них. В связи со способностью особым образом модифицированных наночастиц серебра длительное время сохранять бактерицидные свойства, рационально использовать наносеребро не в качестве дезинфицирующих средств частого применения, а добавлять в краски, лаки и другие материалы, что позволяет экономить деньги, время и трудозатраты [29].
1. 4 Способы получения наночастиц
Пол-учение наночастиц в газовой фазе:
1 Получение наночастиц в процессе «испарение - конденсация».
В газовой фазе наиболее часто проводят следующие процессы: испарение - конденсация (испарение в электрической дуге и в плазме); осаждение; топохимические реакции (восстановления, окисления, разложение частиц твердой фазы). В процессе «испарение - конденсация» жидкие или твердые вещества испаряют при контролируемой температуре в атмосфере инертного газа низкого давления с последующей конденсацией пара в охлаждающей среде или на охлаждающих устройствах. Этот способ позволяет получать частицы размером от двух до нескольких сотен нанометров. Наночастицы с размером менее 20 нм обычно имеют сферическую форму, а у более крупных может появляться огранка.
Обычно испаряемое вещество помещают в нагревательную камеру с нагревателем и отверстием (диафрагмой), через которое испарившиеся частицы вещества попадают в вакуумное пространство (с давлением около 0, 10 Па), где происходит формирование молекулярного пучка. Частицы, двигаясь практически прямолинейно, конденсируются на охлаждаемой подложке. Откачка газа из аппарата осуществляется через клапан. Температуру источника выбирают в зависимости от требуемой интенсивности молекулярного пучка и равновесного давления над испаряемым материалом. Она может быть выше или ниже температуры плавления вещества.
Необходимо отметить, что некоторые вещества (например, Sn и Ge) испаряются как в виде отдельных атомов, так и в виде малых кластеров. В молекулярных пучках малой интенсивности, получаемых при эффузионном истечении через отверстие в нагревательной камере, наблюдается равномерное распределение кластеров малых размеров. Основным достоинством метода молекулярных пучков является возможность достаточно точно регулировать интенсивность пучка и управлять скоростью подачи частиц в зону конденсации [18].
2 Газофазное получение наночастиц.
Метод молекулярных пучков малой интенсивности часто комбинируют с химическими способами осаждения. Осаждение осуществляют вблизи холодной поверхности аппарата или непосредственно на ней при контролируемой температуре и пониженном давлении для уменьшения вероятности столкновения частиц.
Для газофазного получения наночастиц применяются установки, различающиеся способами подвода и нагрева испаряемого материала, составом газовой среды, методами осуществления процесса конденсации и отбора получаемого порошка. Например, порошок осаждают на охлаждаемый вращающийся цилиндр или барабан и счищают с него скребком в приемную емкость [19].
Схема конструкции аппарата для газофазного синтеза металлических нанопорошков включает рабочую камеру, охлаждаемый барабан, скребок, воронку, приемную емкость для порошка, нагреваемый трубчатый реактор, устройство для регулируемой подачи испаряемого материала и несущего газа. В трубчатом реакторе испаряемый материал смешивают с несущим инертным газом и переводят в газофазное состояние.
Полученный непрерывный поток кластеров или наночастиц поступает из реактора в рабочую камеру аппарата, в которой создается давление порядка 1 - 50 Па. Конденсация наночастиц и осаждение их в виде порошка происходит на поверхности охлаждаемого вращающегося барабана. С помощью скребка порошок удаляют с поверхности барабана; затем он через воронку поступает в приемную емкость и направляется на дальнейшую переработку.
В отличие от испарения в вакууме, атомы вещества, испаренного в разреженной атмосфере, быстрее теряют кинетическую энергию из-за столкновения с атомами газа и образуют зародыши кристаллов (кластеры). При их конденсации образуются нанокристаллические частицы. Так в процессе конденсации паров алюминия в среде водорода, гелия и аргона при различных давлениях газов получают частицы размером 20 - 100 нм [18].
3 Получение наночастиц с помощью топохимических реакций.
С помощью топохимических реакций определенных газовых сред с металлическими наночастицами в момент их конденсации из паровой фазы можно получать наночастицы желаемых соединений. Для получения требуемого соединения взаимодействие испаряемого металла с газом-реагентом можно обеспечивать и непосредственно в газовой фазе.
В методе газофазных химических реакций синтез наноматериалов происходит за счет химических превращений, протекающих в атмосфере паров легколетучих веществ. В качестве исходных реагентов широко используются галогениды (особенно хлориды металлов), оксихлориды металлов MeOnClm, алкооксиды Me(OR)n, алкильные соединения Me(R)n, пары металлов и так далее. Этим методом можно получать наноматериалы бора, газовой сажи, металлов, сплавов, нитридов, карбидов, силицидов, сульфидов и других соединений [20].
При синтезе наноматериалов рассматриваемым методом на свойства получаемых продуктов в значительной степени оказывают влияние конструкции реакторов, метод нагревания реагентов, температурный градиент в ходе проведения процесса и ряд других факторов.
Газофазные химические реакции обычно проводят в различного типа трубчатых проточных реакторах. Наибольшее распространение получили реакторы с внешним нагреванием реакционной зоны. В качестве конструкционных материалов реакционной зоны аппаратов используют соединения кварца, керамические материалы или глинозем.
Топохимическое взаимодействие газовой фазы с порошком применяют для нанесения на его частицы различных покрытий и введения модифицирующих добавок. При этом необходимо регулировать степень неравномерности процесса так, чтобы твердая фаза выделялась только на поверхности частиц, а не в объеме между частицами. Например, к топохимическим реакциям можно отнести взаимодействие оксидов с азотом в присутствии углерода для синтеза нитридов. Таким способом синтезируют порошки нитридов кремния, алюминия, титана и циркония.
Состав инертного газа влияет на скорость роста частиц. Более тяжелые атомы окружающей среды интенсивнее отбирают энергию от конденсируемых атомов и этим способствуют росту частиц, так же как понижение температуры охлаждения тоже способствуют росту частиц. Меняя в аппарате давление газа и состав газовой среды, можно получать наночастицы различного размера. Так, замена гелия на аргон или ксенон в несколько раз увеличивает размер получаемых наночастиц [22].
Получению нанопорошков в газовой фазе способствует относительно низкое поверхностное натяжение на границе твердое тело - газ; увеличение поверхностного натяжения приводит к уплотнению наночастиц в агрегате. В то же время высокая температура ускоряет диффузионные процессы, что способствует росту частиц и образованию твердотельных мостиков между частицами. Главная проблема рассматриваемого способа заключается в отделении наночастиц от газовой фазы в условиях, когда концентрация частиц в газовом потоке мала, а температура газа достаточно высокая. Для улавливания наночастиц применяют специальные фильтрующие устройства (например, металлокерамические фильтры, электрофильтры), центробежное осаждение твердых частиц в циклонных аппаратах и гидроциклонах, специальные газовые центрифуги.
Наночастицы могут образовываться в результате разложения при высокой температуре твердых веществ, содержащих катионы металлов, молекулярные анионы или металлорганические соединения. Такой процесс называется термолизом. Например, малые частицы лития можно получить разложением азида лития Li№. Вещество помещается в откачанную кварцевую трубку и нагревается до 400 C в установке. При температуре около 370 С азид разлагается с выделением газообразного N2, что можно определить по увеличению давления в вакуумированном пространстве. Через несколько минут давление падает до первоначального уровня, показывая, что весь N2 удален. Оставшиеся атомы лития объединяются в маленькие коллоидные металлические частицы. Таким методом можно получить частицы с размерами менее 5 нм. Частицы можно пассивировать, вводя в камеру соответствующий газ [25].
Получение наночастиц в жидкой фазе:
1 Химическая конденсация.
Химические методы получения наночастиц и ультрадисперсных систем известны достаточно давно. Коллоидный раствор золя золота (красного) с размером частиц 20 нм был получен в 1857г. М. Фарадеем. Агрегативная устойчивость золя объясняется образованием двойного электрического слоя на поверхности раздела твердое тело-раствор и возникновением электростатической составляющей расклинивающего давления, являющегося основным фактором стабилизации данной системы [23].
Наиболее простым и часто используемым способом является синтез наночастиц в растворах при протекании различных реакций. Для получения металлических наночастиц применяют реакции восстановления, при которых в качестве восстановителя используют алюмо- и борогидриды, тетрабораты, гипофосфиты и многие другие неорганические и органические соединения.
Наноразмерные частицы солей и оксидов металлов получают чаще всего в реакциях обмена и гидролиза. Например, золь золота с размером частиц 7 нм может быть получен восстановлением хлорида золота боргидридом натрия с использованием в качестве стабилизатора додекантиола. Тиолы широко используются для стабилизации наночастиц полупроводников. Этот метод обладает чрезвычайно широкими возможностями и позволяет получать материалы, содержащие и биологически активные макромолекулы [27].
2 Осаждение в растворах и расплавах.
Осаждение в растворах.
Общие закономерности образования наночастиц в жидких средах зависят от множества факторов: состава и свойств исходного вещества (раствора, расплава); характера диаграммы равновесия фаз рассматриваемой системы; способа создания пересыщения раствора или расплава; используемого оборудования и режимов его работы.
В случае синтеза необходимых фаз проводят термообработку порошка после его сушки или эти фазы объединяют в одну. После термообработки проводят дезагрегацию агрегатов до размеров наночастиц.
Исходные вещества и растворитель выбирают так, чтобы побочные продукты можно было полностью удалять из целевого продукта при промывании и последующей термообработки без загрязнения окружающей среды. Для эффективного смешения реагентов используют перемешивающие устройства с различными типами мешалок (пропеллерные, стержневые, турбинные), циркуляционное перемешивание с помощью насосов (центробежных и шестеренчатых), диспергирующих устройств (форсунки, сопла, инжекторы, вращающиеся диски, акустические распылители и так далее) [27].
С одной стороны, для увеличения производительности реактора растворимость исходных веществ должна быть большой. Однако при получении наночастиц это будет повышать их массовое содержание в образующейся суспензии и вероятность объединения в агрегаты.
С другой стороны, для обеспечения высокой степени неравновесности процесса образования твердой фазы необходимо использовать насыщенные растворы исходных веществ. Чтобы при этом сохранить малую долю наночастиц в суспензии, целесообразно использовать малорастворимые исходные вещества. При этом производительность реактора будет уменьшаться. Другой возможностью является использование малого количества осаждаемого вещества и большого избытка осадителя. При осаждении в водных растворах в качестве осадителей чаще всего используют растворы аммиака, углекислого аммония, щавелевую кислоту или оксолат аммония. В качестве исходных веществ при осаждении выбирают хорошо растворимые соли азотной, соляной или уксусной кислот [28].
При регулировании pH м температуры раствора возможно создание условий для получения высокодисперсных гидроксидов. Затем продукт прокаливают и при необходимости восстанавливают. Полученные порошки металлов имеют размер 50 - 150 нм сферической или близкой к сфере формы. Методом осаждения можно получать оксидные металлические и металлоксидные материалы, композиции на их основе, различные ферриты и соли [25].
Ответственной стадией, определяющей свойства полученного порошка, является его отделение от жидкой фазы. С возникновением межфазной границы газ-жидкость резко увеличиваются силы Лапласа, сжимаемые частицы. В результате действия этих сил в частицах наноразмерного спектра возникают сжимающие давления порядка мегапаскалей, которые используются при компактировании макрочастиц в монолитные пористые изделия. При этом в порах агрегата создаются гидротермальные условия, приводящие к увеличению растворимости частиц и упрочнению агрегатов за счет механизма растворение-конденсация. Частицы объединяются в прочный агрегат, а далее -в отдельный кристалл.
Для удаления жидкой фазы из осадка используют процессы фильтрования, центрифугирования, электрофореза, сушки. Вероятность образования прочных агрегатов можно уменьшить за счет замещения воды органическими растворителями, а также использованием ПАВ, сублимационной сушки, применением сушильного агента в сверхкритических условиях.
Разновидностью технологии получения наночастиц в жидких средах является управляемое растворение более крупных частиц в подходящих растворителях. Для этого необходимо затормозить или вообще прекратить процесс их растворения в интервале наноразмеров. Этим же способом можно проводить коррекцию размеров получаемых перечисленными методами частиц в случаях, когда их размер оказался больше необходимого [30].
Осаждение в расплавах.
При этом способе жидкой средой являются расплавы солей или металлов (чаще всего используют расплавы солей). Образование твердой фазы происходит при достаточно высокой температуре, когда диффузионные процессы вызывают высокую скорость роста кристаллов. Основной проблемой при этом является исключение захвата синтезируемым порошком компонентов побочных соединений. Для выделения синтезированного порошка после охлаждения соль растворяют в подходящих растворителях.
Изменяя степень неравновесности процесса можно регулировать структуру материала. Если остановить процесс на стадии, когда твердая фаза имеет наноразмеры, можно получать наноматериал. Однако сделать это весьма трудно из-за большой скорости диффузионного массопереноса при достаточно высокой температуре среды [29].
Более перспективен этот метод для получения наночастиц растворением исходных более крупных частиц. В этом случае можно сразу получать нанокомпозит, если растворяющаяся среда, например стеклообразная, будет играть роль матрицы для наночастиц.
3 Золь-гель метод.
Золь-гель метод включает несколько основных технологических фаз. Первоначально получают водные или органические растворы исходных веществ. Из растворов образуют золи (коллоидные системы) с твердой дисперсной фазой и жидкой дисперсионной средой для получения золя используют, например, гидролиз солей слабых оснований или алкоголятов. Можно использовать и другие реакции, приводящие к образованию стабильных и концентрированных золей (например, применение пептизаторов - веществ, препятствующих распаду агрегатов частиц в дисперсных системах). Эффективным является нанесение на наночастицы в процессе гидролиза защитного слоя из водорастворимых полимеров или ПАВ, добавляемых вместе с водой в процессе гидролиза [25].
В дальнейшем золь переводят в гель при удалении из него части воды нагреванием, экстракцией соответствующим растворителем. В ряде случаев проводят распыление водного золя в нагретую несмешивающуюся с водой органическую жидкость.
Переводя золь в гель, получают структурированные коллоидные системы. Твердые частицы дисперсной фазы соединены между собой в рыхлую пространственную сетку, которая содержит в своих ячейках жидкую дисперсионную среду, лишая текучести систему в целом. Контакты между частицами легко и обратимо разрушаются при механических и тепловых воздействиях. Гели с водной дисперсионной средой называются гидрогелями, а с углеводородной - органогелями.
Высушиванием геля можно получать аэрогели или ксерогели - хрупкие микропористые тела (порошки). Порошки используют для формования изделий, плазменного напыления и так далее. Гель можно использоват непосредственно для получения пленок или монолитных изделий. В настоящее время золь-гель метод широко используется для получения наночастиц из неорганических неметаллических материалов [25].
4 Электрохимический метод получения наночастиц.
Электрохимический метод связан с выделением на катоде вещества в процессе электролиза простых и комплексных катионов и анионов. Если в цепь постоянного электрического тока включить систему, состоящую из двух электродов и раствора (расплава) электролита, то у электродов будут протекать реакции окисления-восстановления. На аноде (положительный электрод) анионы отдают электроны и окисляются; на катоде (отрицательный электрод) катионы присоединяют электроны и восстанавливаются. Образующийся на катоде осадок в результате, например, электрокристаллизации, в морфологическом отношении может быть как рыхлым, так и плотным слоем из множества микрокристаллитов.
На текстуру осадка влияют многие факторы, такие, например, как природа вещества и растворителя, тип и концентрация ионов целевого продукта и посторонних примесей, адгезионные свойства осаждаемых частиц, температура среды, электрический потенциал, условия диффузии и другие. Одним из перспективных научных направлений является использования электрохимического синтеза для конструирования наноструктурных материалов. Суть его заключается в формировании в ходе кинетически контролируемого электровосстановления двухмерных (лэнгмюровских) монослоев металлических наночастиц под монослойными матрицами ПАВ. Основными достоинствами метода являются экспериментальная доступность и возможность контроля и управления процессом получения наночастиц [26].
Получение наночастиц с использованием плазмы:
1 Плазмохимический синтез.
Одним из самых распространенных химических методов получения ультрадисперсных порошков металлов, нитридов, карбидов, оксидов, боридов, а также их смесей является плазмохимический синтез. Для этого метода характерны очень быстрое (за 10, 3 - 10, 6 с) протекание реакции вдали от равновесия и высокая скорость образования новой фазы при относительно малой скорости их роста.
При плазмохимическом синтезе используют низкотемпературную (400 - 800 К) азотную, аммиачную, углеводородную, аргонную плазму, которую создают с помощью электрической дуги, электромагнитного высокочастотного поля или их комбинации в реакторах, называемых плазмотронами. В них поток исходных веществ (газообразных, жидких или твердых) быстро пролетает через зону, где поддерживается плазма, получая от нее энергию для проведения реакций химического превращения. Плазмообразующим газом может быть и само исходное вещество [23].
Реактор включает следующие основные узлы: электроды, патрубки для входа плазмообразующего газа, катушки электромагнитов, для поддержания плазменной дуги, патрубки для ввода реагентов, устройства ввода холодного газа, приемное устройство продуктов синтеза. Образующийся между электродами столб дуги образует поток плазмы, при этом в реакторе достигается температура 1200 - 4500 К. Полученные продукты закаляют различными способами: в трубчатых теплообменниках, посредством затапливания потока реагирующей смеси струями холодных газов или жидкости, в охлаждаемых соплах Лаваля.
Характеристики получаемых порошков зависят от используемого сырья, технологии синтеза и типа плазмотрона; их частицы являются монокристаллами и имеют размеры 10 - 100 нм и более. Процессы, происходящие при плазмохимическом синтезе и газофазном методе получения наночастиц, близки между собой. После взаимодействия в плазме происходит образование активных частиц, находящихся в газовой фазе. В дальнейшем необходимо сохранить их наноразмеры и выделить из газовой фазы.
Для порошков плазмохимического синтеза характерны широкое распределение наночастиц по размерам и, как следствие этого, наличие довольно крупных (до 1 - 5 мкм) частиц, то есть низкая селективность процесса, а также высокое содержание примесей в порошке [23].
Для получения наночастиц можно использовать не только метод их роста, но и растворение в плазме более крупных частиц. На практике используются реакторы, в рабочий объем которых вводятся излучения лазера через специальное окно и поток реакционной смеси. В области их пересечения возникает реакционная зона, где происходит образование частиц. Размер частиц зависит от давления реактора и интенсивности излучения лазера. Параметрами лазерного излучения управлять значительно легче (чем высокочастотной или дуговой плазмой), что позволяет получать более узкое распределение частиц по размерам. Таким способом получили порошок нитрида кремния с размерами частиц 10 - 20 нм.
2 Электроэрозионный метод.
Суть метода заключается в образовании дуги между электродами, погруженными в ванну с жидкостью. В этих условиях вещество электродов частично диспергируется и взаимодействует с жидкостью с образованием дисперсного порошка. Например, электроэрозия алюминиевых электродов в воде приводит к образованию порошка гидроксида алюминия.
Полученный твердый осадок отделяют от жидкой фазы методами фильтрации, центрифугирования, электрофореза. Затем порошок сушат и в случае необходимости предварительно измельчают. В процессе последующей термообработки из порошка синтезируют целевой продукт, из которого в процессе дезагрегации получают частицы нужного размера. Этим методом можно получать частицы наноразмеров, если в жидкую фазу помещать частицы большого размера [29].
3 Ударно-волновой или детонационный синтез.
Данным методом наночастицы получают в плазме, образованной в процессе взрыва бризантных взрывчатых веществ (ВВ) во взрывной камере (детонационной трубе).
В зависимости от мощности и типа взрывного устройства ударно -волновое взаимодействие на материал осуществляется за очень короткий промежуток времени (десятые доли микросекунд) при температуре более 3000 К и давлении в несколько десятков гектопаскалей. При таких условиях возможен фазовый переход в веществах с образованием упорядоченных диссипативных наноразмерных структур. Ударно-волновой метод наиболее эффективен для материалов, синтез которых осуществляется при высоких давлениях, например, порошков алмаза, кубического нитрата бора и других.
При взрывном превращении конденсированных ВВ с отрицательным кислородным балансом (смесь тротила и гексогена) в продуктах реакции присутствует углерод, из которого и образуется алмазная дисперсная фаза с размером частиц порядка 4 - 5 нм [24].
Подвергая ударно-волновому воздействию от заряда ВВ пористые структуры различных металлов и их солей, гели гидрооксидов металлов, можно получать нанопорошки оксидов Al, Mg, Ti, Zn, Si и другие.
Достоинством метода ударно-волнового синтеза является возможность получения нанопорошков различных соединений не только обычных фаз, но и фаз высокого давления. Вместе с тем практическое применение способа требует специальных помещений и технологического оборудования для проведения взрывных работ [24].
Механохимический синтез.
При этом способе обеспечивают механическую обработку твердых тел, в результате которой происходят измельчение и пластическая деформация веществ. Измельчение материалов сопровождается разрывом химических связей, что предопределяет возможность последующего образования новых химических связей, то есть протекание механохимических реакций.
Механическое воздействие при измельчении материалов является импульсным; при этом возникновение поля напряжений и его последующая релаксация происходят не в течение всего времени пребывания частиц в реакторе, а только в момент соударения частиц и в короткое время после него. Механическое воздействие бывает не только импульсивным, но и локальным, так как происходит не во всей массе твердого вещества, а лишь там, где возникает и затем релаксирует поле напряжений.
Воздействие энергии, выделяющей при высокой степени неравновесно-сти во время удара или истирания, из-за низкой теплопроводности твердых тел приводит к тому, что какая-то часть вещества находится в виде ионов и электронов - в состоянии плазмы. Механохимические процессы в твердом теле можно объяснить с использованием фононной теории разрушения хрупких тел (фонон - квант энергии упругих колебаний кристаллической решетки).
Механическое измельчение твердых материалов осуществляют в мельницах сверхтонкого измельчения (шаровых, планетарных, вибрационных, струйных). При взаимодействии рабочих органов с измельчаемым материалом возможен его локальный кратковременный разогрев до высоких (плазменных) температур, получение которых в обычных условиях осуществляется при высоких температурах.
Механическим способом можно получать нанопорошки с размером частиц от 200 до 5 - 10 нм. Так, при помоле смеси металла и углерода в течении
48 часов были получены частицы TiC, ZrC, VC и NbC с размером 7 - 10 нм. В шаровой мельнице из смеси порошков вольфрама углерода и кобальта с исходным размером частиц около 75 мкм за 100 часов были получены частицы нанокомпозита WC - Co с размером частиц 11 - 12 нм [25].
Биохимические методы получения наноматериалов.
Наноматериалы могут производиться и в биологических системах. Во многих случаях живые организмы, например, некоторые бактерии и простейшие организмы, производят минеральные вещества с частицами и микроскопическими структурами в нанометровом диапазоне размеров.
В процессах биоминерализации действуют механизмы тонкого биохимического контроля, в результате чего производятся материалы с четко определенными характеристиками [25].
Живые организмы могут быть использованы как прямой источник ультрадисперсных материалов, свойства которых могут быть изменены путем варьирования биологических условий синтеза или переработки. Ультрадис-персные материалы, полученные биохимическими методами синтеза, могут быть исходными материалами для некоторых уже опробованных и известных методов синтеза и обработки наноматериалов, а также в ряде технологических процессов. Пока работ в этом направлении исследований немного, но уже можно указать ряд примеров получения и использования биологических наноматериалов.
В настоящее время ультрадисперсные материалы могут быть получены из ряда биологических объектов, например, ферритинов и связанных с ними белков, содержащих железо, магнетических бактерий и другое. Так, ферритины (вид белков) обеспечивают для живых организмов возможность синтезировать частицы гидроксидов и оксифосфатов железа нанометрового размера. Способность магнетотактических бактерий использовать линии магнитного поля Земли для собственной ориентации позволяет иметь цепочки наноразмерных (40 - 100 нм) однодоменных частиц магнетита.
Возможно также получение наноматериалов с помощью микроорганизмов. В настоящее время открыты бактерии, окисляющие серу, железо, водород и другие вещества. С помощью микроорганизмов стало возможным проводить химические реакции для извлечения из руд различных металлов, минуя традиционные технологические процессы. В качестве примера можно привести технологию бактериального выщелачивания меди из сульфидных материалов, урана из руд, отделение примесей мышьяка от концентратов олова и золота.
В некоторых странах в настоящее время до 5 % меди, большое количество урана и цинка получают микробиологическими методами. Существуют хорошие предпосылки, подтвержденными лабораторными исследованиями, использования микробиологических процессов извлечения марганца, висмута, свинца, германия из бедных карбонатных руд. С помощью микроорганизмов можно вскрыть тонко вкрапленное золото арсенопиритных концентратов. Поэтому в технической микробиологии появилось новое направление, которое называют микробиологической гидрометаллургией [26].
Криохимический синтез.
Высокая активность атомов и кластеров металлов в отсутствие стабилизаторов обуславливает реакцию в более крупные частицы. Процесс агрегации атомов металлов идет практически без энергии активации. Стабилизацию активных атомов почти всех элементов периодической системы удалось осуществить при низких (77 К) и сверхнизких (4 - 10 К) температурах методом матричной изоляции. Суть этого метода состоит в применении инертных газов при сверхнизких температурах. Чаще всего в качестве матрицы используются аргон и ксенон. Пары атомов металлов конденсируют с большим, обычно тысячекратным, избытком инертного газа на поверхность, охлаждаемую, до 10 - 12 К. Значительное разбавление инертных газов и низкие температуры практически исключают возможность диффузии атомов металлов, и в конденсате происходит их стабилизация. Физико-химические свойства таких атомов исследуют различными спектральными и радиоспектральными методами [18].
Основные процессы криохимической нанотехнологии:
1 Приготовление и диспергирование растворов.
В результате растворения исходного вещества или веществ в том или ином растворителе удается достичь максимально возможной степени смешивания компонентов в гомогенном растворе, в котором гарантирована высокая степень точности соответствия заданного состава. В качестве растворителя чаще всего используют воду; однако, возможно применять и другие растворители, которые легко замораживаются и сублимируются.
Затем полученный раствор диспергируют в отдельные капли требуемого размера, и их охлаждают до полного замораживания влаги. Процесс гидродинамического диспергирования осуществляют за счет истечения раствора через различные насадки и фильтры, а также с использование форсунок [18].
2 Замораживание жидких капель.
Данный процесс обеспечивает при непосредственном контакте с хладоагентами или на охлаждаемых поверхностях. При непосредственном контакте с хладоагентами замораживание производят в объеме жидкого хладоагента, например, жидкого азота или охлажденной органической жидкости (например, гексан). При этом получают гранулы сферической формы.
При кристаллизации на охлаждаемых поверхностях капля раствора теряет сферическую форму, приобретая вид чечевицеобразных гранул. В ряде случаев процесс кристаллизации осуществляют в тонкой пленке, которую перед замораживанием наносят на охлаждаемую поверхность.
Нашел широкое промышленное применение процесс испарительного замораживания (или самозамораживание) диспергируемых фрагментов раствора в вакууме при давлении более низком, чем давление, соответствующее тройной точке диаграммы состояния растворителя. Скорость охлаждения капель раствора на стадии замораживания существенно влияет на структуру образующихся кристаллов льда и высушиваемого продукта. Режим замораживания особенно важен при получении наноструктурных элементов на последующей стадии сублимационного обезвоживания гранул. Для этого процесс замораживания должен протекать настолько быстро, чтобы предотвратить согрегацию компонентов раствора [18].
Обычно скорость охлаждения определяют на основании теоретических расчетов или подбирают опытным путем; она зависит от состава продукта, его теплофизических свойств, способа охлаждения и других факторов. Затем замороженные гранулы просеивают (в случае необходимости) и помешают в сублимационную камеру, где происходит их сублимационная сушка.
Малоразмерные фрагменты раствора (капли, тонкие пленки) можно замораживать также в самой камере сушки при вакуумировании. В этом случае в результате понижения давления происходит интенсивное практически адиабатное испарения влаги. При этом за счет отвода теплоты испарения наблюдается самоохлаждение продукта - вплоть до его полного замораживания. При осуществлении такого процесса обычно удаляется до 10 % влаги.
Главная цель процесса криокристаллизации заключается в сохранении высокой химической и гранулометрической однородности, присущей диспергируемому раствору. Возможность сохранения высокой химической однородности определяется различными условиями, в том числе размером замораживаемых капель раствора, его температурой, физико-химической природой и температурой хладоагента [27].
3 Сублимация.
Стадию испарения (сублимации) влаги реализуют ниже тройной точки на диаграмме равновесия «растворитель - растворенное вещество». Параметры данной точки (температура, давление) зависят от свойств растворителя и растворенного вещества, а также от состава раствора. Например, для чистой воды эти температуры составляют: давление р = 610 Па и Т = 273, 0076 К.
На стадии сублимации теплоту, затрачиваемую на испарение льда, к продукту подводят путем кондуктивного теплопереноса (теплопроводностью) или с использованием источников инфракрасного, электромагнитного и других видов излучения (радиационный электропровод); в ряде случаев используют их комбинацию.
При сублимационном обезвоживании удается избежать химических изменений компонентов, свести к минимуму потери летучих компонентов материала, высушить продукт без вспенивания, сохранить дисперсность составных частей композиции материала, поддержать стерильность и свести к минимуму окисление продукта.
Удалять растворитель из замороженного материала можно также способом криоэкстракции и криоосаждения. При криоэкстракции извлечение льда из гранул материала производится жидкими экстрагентами (например, ацетоном, метанолом, пропанолом, спиртом и другими). При этом температура среды и экстрагента должна быть ниже температуры замерзания солевого раствора. В этом случае лимитирующей стадией процесса является внешняя диффузия, то есть скорость диффузии молекул воды от поверхности гранул в объем экстрагента.
При криоосаждении удаление растворителя из замороженных гранул осуществляют при температуре ниже температуры плавления целевого продукта путем обработки осадителями (например, щавелевой кислотой, гидроксидом аммония и другими) [30].
4 Десублимация.
Обычно с понижением влажности материала интенсивность парообразования также падает. В соответствии с этим следует снижать количество подводимой теплоты, так как излишек может привести к нагреву материала -вплоть до плавления льда, что нарушит режим сублимационной сушки.
Для поддержания движущей силы в процессе сублимационной сушки необходимо обеспечивать непрерывный отвод паров влаги из сушильной камеры (сублиматора). Это можно сделать двумя способами.
Во-первых, необходимый вакуум можно поддерживать, используя прямой отсос образующихся паров из сушильной камеры с помощью вакуумных насосов (пароструйных, эжекторных).
Во-вторых, поддерживать вакуум в сушильной камере можно путем адсорбционного поглощения паров растворителя (воды) цеолитами или другими адсорбентами [28].
Более эффективным является удаление паров влаги путем их конденсации. Поскольку процесс сублимации осуществляют при достаточно высоком вакууме (остаточном давлении порядка 50 - 150 Па и температуре -20 - 50 С), то в этих условиях происходит твердофазная конденсация (десублимация) паров растворителя. Такой процесс десублимации можно проводить с использованием как поверхностных, так и контактных конденсаторов.
Продукт сублимационного обезвоживания получается в виде пористых гранул, состоящих из равномерной смеси ультрадисперсных элементов (частичек) твердых растворов солей. Отдельные частички структуры гранул скреплены по зонам контакта хрупкими кристаллическими «мостиками». В случае необходимости такие гранулы подвергаются термообработке, при которой происходит дегидратизация солевых компонентов и разложение солей окислов.
Лимитирующей стадией получения наночастиц методом криохимической технологии является процесс сублимационной сушки, продолжительность которого составляет 10 - 20 часов. Также необходимо отметить, что криохимический метод нашел применение для получения различных ультрадисперсных материалов неорганических солей; он перспективен и для сложных органических соединений. Способ можно использовать не только для водных, но и неводных растворов, а также смесей вода - неводный растворитель [28].
1. 5 Биологические эффекты наночастиц при взаимодействии с живыми организмами
Изменения, вносимые в жизнь развитием нанотехнологий, по глубине сравнимы с последствиями открытия радиоактивности или с компьютерной революцией. Опыт подсказывает, что изменения такого масштаба могут нести не только положительные, но и негативные последствия. Имеющиеся опасения по поводу безопасности нанотехнологий выходят на первый план, если речь идёт об их медицинских приложениях — той области, где наночастицы целенаправленно воздействуют на человеческий организм [4].
Разработка новых лекарственных средств на основе наноматериалов является одним из направлений современной нанотехнологии. Так, созданы повязки на основе наночастиц серебра. По данным исследователей, разработанные повязки обладают высокой эффективностью, ускоряя заживление ожогов, ран, экземы, угревой сыпи. Это объясняется особенностью действия наночастиц металлов на организм, легко проникать во все органы и ткани, в биотических дозах стимулировать обменные процессы и т. д. В тоже время перечисленные особенности наночастиц могут оказывать на живые системы такое действие, которое будет способствовать развитию различных патологических состояний и даже приводить к гибели [4].
Обсуждаемые в настоящее время перспективные области применения медицинских нанотехнологий весьма многообразны, и не существует даже их общепринятой классификации. Можно, по-видимому, выделить три генеральных направления.
Первое — диагностика заболеваний на ранней стадии, в перспективе — на уровне единичных клеток. В качестве примера можно привести диагностику с помощью магнитных наночастиц. При введении в организм суспензии из таких частиц они захватываются макрофагами. Если где-то есть опухоль или протекает воспалительный процесс, «меченые» макрофаги устремляются туда и могут быть легко обнаружены с помощью магнитного томографа. Другим примером служат квантовые точки, обладающие, подобно атомам, дискретным спектром излучения. Обработанные определённым образом, они могут маркировать раковые клетки, что уже подтверждено экспериментами на мышах. Или же суспензию из зелёных квантовых точек можно вводить в сосуды для визуализации кровеносной системы. Если в каком-то месте повреждён маленький сосуд или капилляр, это будет отчётливо видно, поскольку в тканях человеческого организма нет зелёного цвета.
Второе направление — это адресная доставка лекарств, а в более отдалённой перспективе — и генов, к поражённым клеткам. Это намного повышает возможности лечения онкологических и некоторых других заболеваний сильнодействующими препаратами с ярко выраженными побочными действиями.
Третьим направлением является регенеративная медицина. Её цель — мобилизация собственных возможностей организма на борьбу с такими заболеваниями, как диабет, остеоартрит, поражения сердечной мышцы и центральной нервной системы. В основе регенеративной медицины лежит доставка к поражённым участкам тела биосовместимых материалов, стволовых клеток, а также сигнальных молекул, инициирующих регенеративные процессы на клеточном уровне [5].
Разумеется, применение нанотехнологий должно быть с самого начала поставлено под строгий контроль. Ведь помимо недопустимого вреда здоровью человека и окружающей среде следует учитывать возможную негативную реакцию общества. Главным фактором риска применения медицинских нанотехнологий является недостаток информации о взаимодействии конкретных наночастиц с человеческим организмом. Учёные сегодня лучше понимают, как происходит поглощение наночастиц позвоночными и беспозвоночными животными, но не знают, как они влияют на отдельный организм или даже на колонию микроорганизмов. Опубликованные в настоящее время обзоры литературы об отрицательном влиянии наночастиц на здоровье человека содержат лишь первые данные, касающиеся их возможной токсичности. Имеются наблюдения, описывающие связь между наноразмер-ными частицами, циркулирующими в атмосфере, и заболеваемостью, особенно у пожилых людей и лиц с пониженным иммунитетом [10].
Были проведены исследования влияния наночастиц меди на минеральный состав печени крыс. Для исследования влияния увеличивающейся нагрузки наночастиц меди на организм и микроэлементный статус были использованы наночастицы со следующими физико-химическими характеристиками: средний размер наночастиц меди, имеющих сферическую форму, составляет 103, 0 ± 2, 0 нм; кристаллической меди в ядре частиц содержится 96, 0 ± 4, 5 %, меди оксида - 4, 0 ± 0, 4 %; толщина оксидной пленки на поверхности наночастиц - 6 нм [33, 35].
При усилении нагрузки меди на организм в виде наночастиц происходит увеличение уровня меди в печени. Известно, что в системе регуляции уровня микроэлементов в организме большое значение принадлежит взаимоотношениям элементов, носящих конкурентный или неконкурентный характер. Еще в 1970 году Хилл выдвинул гипотезу, что «физически и химически похожие элементы будут антагонистами в биологических системах». Эта работа положила начало многочисленным исследованиям в этой области, и на основании экспериментов были построены схемы взаимоотношений элементов в живых системах [34, 36, 37, 38].
Рассмотрим с этих позиций изменение микроэлементов в печени при введении наночастиц меди. Через сутки после первой инъекции наночастиц в печени животных происходит резкое в 2, 93 раза увеличение меди, которое приводит к снижению содержания железа (1 сутки, 7 суток после I инъекции), кальция (1 сутки после I инъекции), цинка (7 суток после I инъекции), кадмия (на 85 %), кобальта (на 23 %), олова (67 %). Снижение уровня железа способствует увеличению в 2, 33 раза концентрации йода, на 9, 0 % содержания селена, на 17 % концентрации марганца в ткани. В ответ на увеличение концентрации селена происходит снижение уровня свинца, мышьяка и кадмия, причем уровень кадмия падает на 75 % по сравнению с контролем, но не изменяет содержание ртути. Такое выраженное снижение концентрации кадмия происходит не только за счет увеличения селена, но благодаря антагонистическим отношениям с медью. Повышение содержания йода способствует незначительному на 9 % снижению концентрации кальция по сравнению с контролем. При этом содержание магния уменьшается на 3 %, что в свою очередь сопровождается увеличением содержания калия на 36 % по сравнению с контролем и как следствие - снижение концентрации натрия на 6 % по сравнению с контролем. В то же время уровень лития остается неизменным через 1 и 7 суток после введения меди. Содержание алюминия увеличивается на 5 % через 1 сутки и на 21 % через 7 суток после I введения наночастиц меди, что приводит к снижению уровня кальция, магния, железа, однако уровень кремния при этом увеличивается. Концентрации хрома и ванадия изменяются в противофазе: содержание хрома снижается на 12 %, ванадия увеличивается на 64 % по сравнению с контролем. Антагонистами никеля являются элементы: кальций, цинк, железо, селен. Антагонистические отношения при введении наночастиц меди сохраняются для никеля и селена [41].
Известно, что стронций может замещать кальций в костях. Что касается изменений содержания стронция в печени при введении наночастиц меди, то наблюдается его снижение на 12 %, при этом концентрация кальция также становиться меньше на 19 %. Бор - синергист цинка и антагонист меди. В рассматриваемом случае увеличение уровня меди сопряжено с увеличением на 37 % содержания бора в печени. Следовательно, введение наночастиц меди стимулирует систему регуляции уровня микроэлементов, причем наблюдаемое увеличение уровня меди сразу после введения приводит к изменению концентрации 25 исследованных элементов в печени. Характер этих изменений согласован и за исключением нескольких элементов, амплитуда колебаний концентрации которых очень мала, например, цинка (через 1 сутки после введения содержание элемента равно контролю, через 7 суток на 3 % ниже контроля), построен на антагонистических взаимоотношениях. Дальнейшее увеличение нагрузки (суммарная доза 4 мг/кг массы животного) наночастиц на организм не нарушает системы гомеостатического регулирования уровня микроэлементов в ткани, и антагонистические взаимоотношения микроэлементов сохраняются. После третьей инъекции (суммарная доза 6 мг/кг массы животного наночастиц, близкая к МПД - 10 мг/кг массы животного) содержание меди в печени увеличивается на 29 % по сравнению с контролем, но антагонистические взаимоотношения между элементами нарушаются. Как результат, происходит увеличение концентрации следующих элементов в печени по сравнению с контролем: Fe, Zn, Mg, Na, Co, Al, Li, K, V, I, Se, B, P, As, Sn, Cd; снижение: Ca, Si, Sr, Pb, Cr; концентрации элементов Ni, Hg не отличается от контроля. Наконец, после 12-кратного введения наночастиц меди в организм, когда суммарная доза наночастиц меди приближается к ЛД100, происходит увеличение концентрации всех элементов в печени, кроме йода, селена (элемента антиоксидантной защиты). Таким образом, введение наночастиц меди приводит к изменению микроэлементного статуса печени. Дальнейшее увеличение нагрузки вплоть до дозы, близкой к ЛД100, вызывает такой дисбаланс микроэлементов, что наблюдается увеличение соотношения микроэлементов [38].
Также было проведено исследование обмена химических элементов в организме карпа при использовании наночастиц кольбата и железа в корме. Целью исследования являлась оценка влияния железа и кобальта в различной химической форме на обмен минеральных веществ.
Минеральные вещества не являются питательными веществами, однако необходимы рыбе для нормального роста и развития. Минеральные вещества играют важную роль для построения структурных частей и тканей организма. Их недостаток или избыток в пище вызывает нарушения обмена веществ, приводящие к снижению роста, патологии развития, а иногда к смерти рыб [39, 40, 41].
Кобальт поступает в организм рыб с пищей и осмотическим путем. Дефицит его сопровождается снижением синтеза гемоглобина, что может привести к возникновению анемии и снижению общей резистентности организма, повышению смертности при одновременном замедлении роста рыб.
К числу наиболее важных эссенциальных химических элементов относятся железо и кобальт. Кобальт активирует аргиназу, костную и кишечную фосфатазу, инактивирует уреазу, пепсин, используется при синтезе мышечных белков. Кобальт может вызвать наступление полицитемии, т. е. нарастания количества эритроцитов и гемоглобина без изменения объема крови, стимулирует образование ретикулоцитов и созревание эритроцитов в костном мозге. Кобальт стимулирует синтез витаминов группы B, повышает усвоение железа, подавляет развитие кишечной палочки и других вредных микроорганизмов. Организм рыб тонко реагирует на те или иные физиологические сдвиги, что находит отражение в изменении уровня сывороточного железа, которое изменяется в зависимости от пола, сезона года и других факторов. Железо служит необходимым материалом для синтеза гемоглобина. Этот процесс нормально протекает при наличии адекватных количеств железа, кобальта и меди. Биологическая роль железа в организме объясняется его участием в аэробном метаболизме, нарушение которого может иметь серьезные биохимические и физиологические последствия [42].
В свете данной проблемы большой интерес вызывают биопрепараты нового поколения - наноформы микроэлементов. За последние годы было установлено, что наночастицы эссенциальных элементов обладают высокой биологической активностью и усиливают обмен веществ и способствуют повышению естественной резистентности организма, повышению темпов роста, работоспособности и экстерьерных признаков.
Особый интерес представляют порошки, активными компонентами которых являются наночастицы железа и кобальта. Данные препараты заметно отличаются от ранее известных форм микродобавок: они экологически чистые, высокоэффективные и экономически выгодные, способствуют более эффективному повышению продуктивности сельскохозяйственных растений и животных. Наночастицы благодаря своим малым размерам легко проникают в организм через защитные барьеры. Абсорбирующие свойства наночастиц значительно выше, чем у других молекул. Ранее проведенные исследования биологической активности наночастиц металлов на экспериментальных животных позволили установить, что нанокристаллическое железо и цинк в биотических дозах ускоряют рост животных и птиц, усиливают регенерацию печени после частичной гепатэктомии, ускоряют заживление тканей. Целью исследования являлась оценка влияния железа и кобальта в различной химической форме на обмен минеральных веществ в теле рыб [45, 46].
Кальций, натрий, магний, калий составляют группу основных элементов, определяющих механизм осморегуляции у рыб [47]. Увеличение содержания кальция и фосфора во II и VI группах неудивительно, так как железо может способствовать усвоению кальция, а кальций в обмене тесно связан с фосфором. Обмен этих элементов идет параллельно. Повышение содержания железа, меди и цинка можно объяснить активным участием этих элементов в процессах кроветворения и тканевого дыхания. Медь и железо выполняют роль катализаторов в процессе превращения неорганического железа в составную часть гемоглобина. Аддитивный эффект, полученный в результате взаимодействия кобальта и железа, существенно влияет на баланс этих металлов в органах и тканях рыб. Кобальт, взаимодействуя с железом, вызывает синергетический эффект, способствуя включению атома железа в молекулу гемоглобина, усиливая ионизацию и резорбцию железа, ускоряя созревание эритроцитов [41, 49, 50].
Изменение состава комбикормов с помощью микроэлементов железа и кобальта сопровождалось достоверными изменениями отдельных токсических элементов в тканях рыбы. Так, во всех группах наблюдалось снижение содержания стронция. Также стоит отметить снижение содержания кадмия и олова во всех группах, кроме VI группы - здесь наблюдается увеличение на 24, 7 %. Токсичность кадмия связывают с координацией металла с SH - группами белка - это проявление первичной токсичности металла. В живых организмах происходит процесс химического и биохимического метилирования неорганических солей тяжелых металлов, и образующиеся в результате этих реакций органические производные обладают токсичностью, на несколько порядков превышающей токсичность их неорганических предшественников [51, 52].
Воздействие элемента на ту или иную функцию организма зависит от присутствия в среде других веществ. Это взаимодействие в метаболизме может осуществляться через реакцию элементов с металлотионинами. В связи с этим введение железа повышает всасывание в кишечнике цинка, ртути и кадмия Попадая в организм, металлы токсиканты чаще всего не подвергаются каким-либо существенным превращением, а включаются в биохимический цикл, они крайне медленно покидают его. По мнению А. В. Скального, увеличение содержания токсических элементов связано с отсутствием у организма животного механизма противодействия всасыванию и отложению в тканях токсических элементов.
В соответствии с этим, чем больше содержится токсикантов в корме, тем потенциально больше их может откладываться в тканях рыб. Основными синергистами железа являются кальций и медь, антагонистом - цинк, а основными синергистами кобальта являются медь и цинк, антагонистом - йод. Как видно из полученных результатов, наночастицы оказали наиболее положительный эффект на синергизм как железа, так и кобальта, возможно введение наночастиц приводит к активизации функционирования регуляторных систем организма на клеточном уровне, а их биологическая активность положительно влияет на рост и развитие рыб.
Обмен и усвоение железа зависят от многих факторов, одним из которых является интенсивность образования железосвязывающего белка. Всасывание железа ингибируют некоторые органические кислоты, образуют с ним нерастворимые соли, а также избыток в комбикорме (рационе) фосфатов, танина, цинка, марганца, меди, кадмия. На усвоение железа влияет величина рН содержимого желудка. Из природных и химических соединений железо сравнительно хорошо усваивается из сульфатов, хлорида, фумарата, глюконата, хелатных соединений. И плохо усваивается из нерастворимых солей железа, таких как оксалаты, цитраты, закиси, окиси, ортофосфаты, сернистое железо. Кальций способствует усвоению железа, за исключением тех случаев, когда дозы кальция чрезвычайно велики. Железо входит в состав некоторых тканевых ферментов и принимает активное участие в окислительновосстановительных процессах, способствует росту и развитию тканей [33, 48].
Кобальт может приводить к нарушению метаболизма йода в щитовидной железе и оказывает выраженное влияние на активность некоторых гидролитических ферментов. Он значительно влияет на обмен веществ и рост, поскольку входит в состав гормонов, витаминов, играет важную биологическую роль в процессах гемопоэза - стимулирует образование ретикулоцитов и повышает интенсивность созревания эритроцитов в костном мозге. Кобальт поступает в организм с кормами и добавками, частично в виде витамина В12. Усвояемость элемента у них невелика, поскольку потребность в нем небольшая и возрастает лишь при недостатке витамина В12 [48, 49, 50].
Таким образом, полученные результаты свидетельствуют о перспективности использования наночастиц железа и кобальта в кормлении рыб. При анализе метаболизма этих элементов было установлено, что Co и Fe в наноформе оказывают наиболее положительный эффект на увеличение эссенциальных и макроэлементов в теле рыб. Кроме того, был установлен значительный синергетический и антагонистический эффект этих элементов в виде наночастиц по сравнению с использованием в виде солей и микрочастиц.
Особенности наночастиц, обуславливающие их токсичность.
Прежде всего, это химическая и каталитическая активность поверхности наночастиц, отсутствующая у этого же вещества, имеющего более крупную дисперсность. Второй особенностью наночастиц, проявляющейся их токсичностью, является их высокая концентрация в воздухе при незначительном количестве самого распыленного вещества. И третья особенность наночастиц — это их способность к ингаляционному, трансдермальному, транснейральному и энтеральному проникновению в любые органы и ткани человека, включая ЦНС. Наночастицы по размеру сходны с рецепторами клеток и молекулами, осуществляющими сигнальную функцию. Исследования, проведенные в условиях in vitro с использованием различных клеточных систем, показали развитие у клеток, экспонированных к наночастицам, прововоспалительных и связанных с окислительным стрессом реакций.
В опытах на лабораторных животных был подтвержден высокий воспалительный потенциал наночастиц, и было установлено, что он тем выше, чем меньше размер частиц, к которым экспонировано животное. Также было установлено значительное разрушительное действие наночастиц на легочную ткань.
Показано, что введение в организм млекопитающих полимерных наночастиц, несущих нуклеиновые кислоты, помимо специфического действия, обусловленного экспрессией нуклеиновых кислот, вызывает целый ряд неспецифических генерализованых реакций, а именно: синтез цитокинов, скоротечную лимфопению, тромбоцитопению, канцерогенные и острые токсические эффекты.
В патологическом эффекте нанообъектов прослеживается определенная специфичность, обусловленная их структурой и химическим строением. Например, агрегированные одностеночные углеродные нанотрубки в легочной ткани мышей индуцируют образование гранулем, главным образом связанных с гипертрофией эпителиальных клеток. Эти же трубки, но в диспергированном состоянии, вызывают развитие диффузного интерстициального фиброза с утолщением стенок альвеол [31, 32].
Пути проникновения наночастиц в организм человека.
Их четыре — через легкие, обонятельный эпителий, кожу и желудочнокишечный тракт. Наиболее доступны для наночастиц легкие. Они состоят из двух различных частей — воздушных путей, транспортирующих воздух в легочную ткань (трахеобронхиальный и назофарингеальный регионы), и составляющих легочную ткань альвеол, где происходит газообмен. Легкие человека содержат около 2300 км воздушных путей и 300 млн альвеол. Общая поверхность легких взрослого человека 140 м2. Воздушные пути хорошо защищены от проникновения крупных частиц благодаря активному эпителию и вязкому слизистому слою на его поверхности. Но в газообменной области альвеол барьер между альвеолярной стенкой и капиллярами очень тонок, всего 500 нм и легко для них проницаем.
Например, до 90 % ингалированных 1-нм частиц оседает в назофарингеальном тракте, до альвеол они «не доходят». 5-нм частицы распределяются относительно равномерно по назофарингельному тракту, трахеобронхиальному тракту и альвеолам (~ по 30 %). Частицы диаметром в 20 нм наиболее эффективно оседают в альвеолах (~ 50 %). В тоже время в трахеобронхиальном и назофарингеальном регионах задерживается ~ по 15 % от их общего количества. Такое дифференцированное распределение наночастиц разных размеров в различных разделах легких неизбежно сказывается на их экстрапульмонарном распределении [4].
Наночастицы после ингаляции проникают в кровеносное русло по разным механизмам. Скорость этого процесса может варьировать для наночастиц разных размеров и химического состава. Но в некоторых случаях этот процесс может осуществляться очень быстро. Например, ингалированные углеродные частицы размером менее 100 нм уже через одну минуту после экспозиции можно обнаружит в крови экспериментального животного.
«Новинкой», характерной именно для частиц нанодиапазона, является возможность их проникновения в организм человека по нервным волокнам, идущим от обонятельного эпителия; и через кожу. Еще 60 лет назад было установлено, что полиовирус (30 нм), введенный экспериментальному животному интраназально, может через луковицу обонятельного нерва проникать непосредственно в ЦНС. Но, как оказалось, наночастицы способны проникать в ЦНС этим же путем.
Скорость транспорта полиовирусов и наночастиц по обонятельному нерву примерно одинакова — 2, 4 - 2, 5 мм/час. Помимо транснейронального проникновения в ЦНС, наночастицы легко преодолевают гематоэнцефаличе-ский барьер.
Возможны три пути проникновения наночастиц через кожу: между клеток, через клетки и через волосяные фолликулы. Например, липосомы с размерами в пределах от 20 нм до 200 нм легко «проходят» между клетками. Проникновение в организм человека через кожные покровы для наночастиц облегчается тонкостью верхнего слоя кожи - эпидермиса. Лежащий же под ним слой - дерма - очень богат макрофагами крови и тканей, лимфатическими узлами, дендритными клетками, в него «выходят» окончания сенсорных нервов пяти различных типов; все эти «обитатели» дермального слоя способны поглощать и распространять нанообъекты за пределы их первоначальной аппликации. Любые незначительные механические повреждения кожи делают ее «проницаемой» для наночастиц. Уже в 2008 году опубликованы экспериментальные данные, показывающие, что ультрафиолетовое облучение кожи значительно повышает ее проницаемость для наночастиц. Видимо, в ближайшие годы будут обнаружены и другие сюрпризы подобного рода, так как изучение проблемы проникновения в организм человека объектов наноразмера, еще только начинается [31].
1. 6 Структурно-функциональная организация селезенки
Селезенка - непарный орган, расположенный в брюшной полости. Селезенка обычно находится под реберной частью левой половины диафрагмы, около желудка и левой почки на уровне IX - XII ребер. Селезенка направлена продольной осью сзади и сверху вперед и вниз. Ее нижний полюс может располагаться на уровне I - II поясничных позвонков, верхний полюс обычно находится медиальнее нижнего.
Однако, встречается горизонтальное, косое и вертикальное положение селезенки. В типичном случае селезенка имеет бобовидную форму с ровными контурами. В длину она не превышает 150 мм (чаще 80 - 120 мм), в поперечнике - 80 мм (чаще 50 - 60 мм). Фиксация селезенки осуществляется главным образом за счет внутрибрюшного давления, диафрагмальноселезеночной связки, а также диафрагмально-ободочной связки [7].
Кровоснабжение осуществляет селезеночная артерия (артерия мышечного типа). Она является наиболее крупной ветвью чревного ствола. Ее диаметр от 5 до 12 мм. Под серозной оболочкой селезенки, состоящей из одного слоя мезотелиальных клеток, располагается фиброзная оболочка. От ворот селезенки радиально расходятся трабекулы, которые затем соединяются с фиброзной оболочкой. В них проходят артерии, вены, лимфа, сосуды и нервные волокна. Соединительнотканный остов и немногочисленные гладкомышечные клетки составляют опорно-сократительный аппарат селезенки, способный выдерживать ее значительное увеличение в объеме.
В селезенке различают белую и красную пульпу. Белая пульпа состоит в основном из лимфоцитов, на нее приходится от 6 до 20 % веса селезенки. Между свободными клетками белой пульпы (лимфоциты, моноциты, макрофаги и незначительное количество гранулоцитов) располагаются ретикулярные волокна, которые выполняют опорную функцию. Предполагают, что они состоят из вещества, синтезируемого ретикулярными клетками.
Маргинальная зона - плохо различимая часть селезенки - окружает белую пульпу и лежит на границе с красной пульпой. В эту зону из белой пульпы впадает множество мелких артериальных веточек. В ней в первую очередь накапливаются поврежденные и дефектные клетки, инородные частицы [9].
Красная пульпа, на которую приходится от 70 до 80 % веса селезенки состоит из ретикулярного остова, артерий, капилляров, вен, свободных клеток и различных отложений. Между ретикулярными волокнами красной пульпы располагаются свободные клетки: лимфоциты, эритроциты, тромбоциты, макрофаги, плазматические клетки. Форма, размеры и соотношение структурных элементов селезенки у животных, относящихся к различным систематическим группам, чрезвычайно многообразны. Селезенка у рептилий редуцирована, у рыб и земноводных представлена в виде отдельных скоплений лимфоидной ткани, располагающихся под серозной оболочкой желудка или кишечника. У птиц и млекопитающих - это отдельный небольшой по размеру орган, отличающийся разнообразием форм [7].
Функции селезенки.
Наиболее важной функцией селезенки является иммунная функция. Она заключается в захвате и переработке вредных веществ, очищении крови от различных чужеродных агентов (бактерий, вирусов). Селезенка захватывает и разрушает эндотоксины, нерастворимые компоненты клеточного детрита при ожогах, травмах и других тканевых повреждениях. Селезенка активно участвует в иммунном ответе - ее клетки распознают чужеродные для организма антигены и синтезируют специфические антитела [8].
Фильтрационная функция осуществляется, в частности в виде контроля за циркулирующими клетками крови. Прежде всего это относится к эритроцитам, как стареющим так и дефектным. Физиологическая гибель эритроцитов наступает после достижения ими примерно 120-дневного возраста. Точно не выяснено как фагоциты различают стареющие и жизнеспособные клетки. По-видимому имеет значение характер происходящих в этих клетках биохимических и биофизических изменений. Например, существует предположение, согласно которому селезенка очищает циркулирующую кровь от клеток селезенки измененной мембраной. Так, при некоторых болезнях зараженные эритроциты не могут пройти через селезенку, слишком долго задерживаются в пульпе и погибают. При этом показано, что селезенка обладает лучшей, чем печень, способностью распознавать менее дефектные клетки и функционирует как фильтр [10].
В селезенке происходит удаление из эритроцитов гранулярных включений (телец Жолли, телец Гейнца, гранул железа) без разрушения самих клеток. Спленэктомия и атрофия селезенки приводят в повышению содержания этих клеток в крови. Особенно четко выявляется нарастание числа сидероцитов (клеток, содержащих гранулы железа) после спленэктомии, причем эти изменения являются стойкими, что указывает на специфичность данной функции селезенки. Селезеночные макрофаги утилизируют железо из разрушенных эритроцитов, превращая его в трансферрин, то есть селезенка принимает участие в обмене железа [10, 11].
Роль селезенки в разрушении лейкоцитов изучена недостаточно. Существует мнение, что эти клетки в физиологических условиях погибают в легких, печени и селезенке, тромбоциты у здорового человека также разрушаются главным образом в печени и селезенке. Вероятно, селезенка принимает и другое участие в обмене тромбоцитов, так как после удаления селезенки по поводу повреждения этого органа наступает тромбоцитоз. Селезенка не только разрушает, но и накапливает форменные элементы крови -эритроциты, лейкоциты, тромбоциты. В частности, в ней содержится от 30 до
50 % и более циркулирующих тромбоцитов, которые при необходимости могут быть выброшены в периферическое русло. При патологических состояниях скопление их иногда столь велико, что может привести к тромбоцитопении.
При нарушении оттока крови селезенка увеличивается и, по мнению некоторых исследователей, может вместить большое количество крови, являясь ее депо. Сокращаясь, селезенка способна выбрасывать в сосудистое русло накопившуюся в ней кровь. При этом объем селезенки уменьшается, а количество эритроцитов в крови увеличивается. Однако, в норме селезенка содержит не более 20 - 40 мл крови [55].
Селезенка участвует в обмене белков и синтезирует альбумин, глобин (белковый компонент гемоглобина), фактор VIII свертывающей системы крови. Важное значение имеет участие селезенки в образовании иммуноглобулинов, которое обеспечивается многочисленными клетками, продуцирующими иммуноглобулины, вероятно, всех классов.
Селезенка принимает активное участие в кроветворении, особенно у плода. Взрослого человека она продуцирует лимфоциты и моноциты. Селезенка является главным органом экстрамедуллярного гемопоэза при нарушении нормальных процессов кроветворения в костном мозге, например при хронической кровопотере, сепсисе и др. Имеются косвенные данные, подтверждающие возможность участия селезенки в регуляции костномозгового кроветворения. Влияние селезенки на выработку эритроцитов пытаются подтвердить на основании факта появления ретикулоцитоза после удаления нормальной селезенки, например, при ее повреждении. Однако, это может быть связано с тем, что селезенка задерживает раннее выхождение ретикулоцитов.
Остается неясным механизм повышения числа гранулоцитов после удаления селезенки - либо их больше образуется и они быстро выходят из костного мозга, либо они менее активно разрушаются. Также неясен механизм появления развивающегося при этом тромбоцитоза, скорее всего, он возникает за счет удаления с селезенки депо этих клеток. Перечисленные изменения носят временный характер и обычно наблюдаются лишь в течение первого месяца после удаления селезенки.
Селезенка, вероятно, регулирует созревание и выход из костного мозга клеток эритроцитов и гранулоцитов, продукцию тромбоцитов, процесс денулеации созревающих эритроцитов, продукцию лимфоцитов. Вполне вероятно, что ингибирующее влияние на гемопоэз могут оказывать лимфокины, синтезируемые лимфоцитами селезенки.
Данные об изменениях отдельных видов обмена веществ после удаления селезенки противоречивы. Наиболее характерным изменением в печени является повышение в ней гликогена. Усиление гликогенфиксирующей функции печени, стойко удерживается и при воздействиях на печень, ведущих к ослаблению этой функции. Опыты с удаление селезенки у животных позволяют сделать вывод, что в селезенке продуцируются гуморальные факторы, отсутствие которых вызывает повышенную фиксацию гликогена и, тем самым, вторично влияет на процессы накопления жира в этом органе [56, 57].
Большую роль селезенка играет в процессах гемолиза. В патологических условиях она может задерживать и разрушать большое количество измененных эритроцитов, особенно при некоторых врожденных и приобретенных гемолитических анемиях. Большое количество эритроцитов задерживается в селезенке при застойном полнокровии и других болезнях. Установлено также, что механическая и осмотическая резистентность лейкоцитов при прохождении их через селезенку снижается.
Селезенка не принадлежит к числу жизненно важных органов, но в связи с перечисленными функциональными особенностями играет существенную роль в организме. Пониженная функция селезенки наблюдается при атрофии селезенки в пожилом возрасте, при голодании, гиповитаминозах [57].
1. 7 Общая характеристика и регуляция апоптоза. Микроэлементы и апоптоз.
В организме здорового человека клеточный гомеостаз определяется балансом между гибелью и пролиферацией клеток. Апоптоз -программированная клеточная гибель, энергетически зависимый, генетически контролируемый процесс, который запускается специфическими сигналами и избавляет организм от ослабленных, ненужных или повреждённых клеток. Ежедневно, примерно около 5 % клеток организма подвергаются апоптозу, а их место занимают новые клетки. В процессе апоптоза клетка исчезает бесследно в течение 15 - 120 минут.
Апоптоз - это биохимически специфический тип гибели клетки, который характеризуется активацией нелизосомных эндогенных эндонуклеаз, которые расщепляют ядерную ДНК на маленькие фрагменты. Морфологически апоптоз проявляется гибелью единичных, беспорядочно расположенных клеток, что сопровождается формированием округлых, окруженных мембраной телец, которые тут же фагоцитируются окружающими клетками.
Это энергозависимый процесс, посредством которого удаляются нежелательные и дефектные клетки организма. Он играет большую роль в морфогенезе и является механизмом постоянного контроля размеров органов. При снижении апоптоза происходит накопление клеток, пример - опухолевый рост. При увеличении апоптоза наблюдается прогрессивное уменьшение количества клеток в ткани, пример - атрофия [12].
Морфологические проявления апоптоз.
Апоптоз имеет свои отличительные морфологические признаки, как на светооптическом, так и на ультраструктурном уровне. При окраске гематоксилином и эозином апоптоз определяется в единичных клетках или небольших группах клеток. Апоптотические клетки выглядят как округлые или овальные скопления интенсивно эозинофильной цитоплазмы с плотными фрагментами ядерного хроматина. Поскольку сжатие клетки и формирование апоптотических телец происходит быстро и также быстро они фагоцитируются, распадаются или выбрасываются в просвет органа, то на гистологических препаратах он обнаруживается в случаях его значительной выраженности. К тому же апоптоз - в отличие от некроза - никогда не сопровождается воспалительной реакцией, что также затрудняет его гистологическое выявление [13].
Апоптоз - это механизм гибели клеток, который имеет ряд биохимических и морфологических отличий от некроза. Наиболее четко морфологические признаки выявляются при электронной микроскопии.
Таблица 2 - Сравнительная характеристика апоптоза и некроза
|
Признак |
Апоптоз |
Некроз |
|
Индукция |
Активируется физиологическими или патологическими стимулами |
Различная в зависимости от повреждающего фактора |
|
Распространять |
Одиночная клетка |
Группа клеток |
|
Биохимичекие изменения |
Энергозависимая фрагментация ДНК эндогенными эндонуклеазами |
Нарушение или прекращение ионного обмена |
|
Целостность клеточной мембраны |
Сохранена |
Нарушена |
|
Воспалительный ответ |
Нет |
Обычно есть |
|
Удаление погибших клеток |
Поглощение (фагоцитоз) соседними клетками |
Поглощение (фагоцитоз) нейтрафилами и макрофагами |
Для клетки, подвергающейся апоптозу характерно (рисунок 1):
Рисунок 1 - Последовательность ультраструктурных изменений при апоптозе (справа) и некрозе (слева)
1 - нормальная клетка; 2 - начало апоптоза; 3 - фрагментация апоптотической клетки; 4 - фагоцитоз апоптотических телец окружающими клетками; 5 -гибель внутриклеточных структур при некрозе; 6 - разрушение клеточной мембраны.
1 Сжатие клетки.
Клетка уменьшается в размерах; цитоплазма уплотняется; органеллы, которые выглядят относительно нормальными, располагаются более компактно. Предполагается, что нарушение формы и объема клетки происходит в результате активации в апоптотических клетках трансглютаминазы. Этот фермент вызывает прогрессивное образование перекрестных связей в цитоплазматических белках, что приводит к формированию своеобразной оболочки под клеточной мембраной, подобно ороговевающим клеткам эпителия.
2 Конденсация хроматина.
Это наиболее характерное проявление апоптоза. Хроматин конденсируется по периферии, под мембраной ядра, при этом образуются четко очерченные плотные массы различной формы и размеров. Ядро же может разрываться на два или несколько фрагментов. Механизм конденсации хроматина изучен достаточно хорошо. Он обусловлен расщеплением ядерной ДНК в местах, связывающих отдельные нуклеосомы, что приводит к развитию большого количества фрагментов, в которых число пар оснований делится на 180 - 200. При электрофорезе фрагменты дают характерную картину лестницы. Эта картина отличается от таковой при некрозе клеток, где длина фрагментов ДНК варьирует. Фрагментация ДНК в нуклеосомах происходит под действием кальций чувствительной эндонуклеазы. Эндонуклеаза в некоторых клетках находится постоянно (например, в тимоцитах), где она активируется появлением в цитоплазме свободного кальция, а в других клетках синтезируется перед началом апоптоза. Однако еще не установлено, каким образом после расщепления ДНК эндонуклеазой происходит конденсация хроматина [14, 15].
3 Формирование в цитоплазме полостей и апоптотических телец.
В апоптотической клетке первоначально формируются глубокие впячивания поверхности с образованием полостей, что приводит к фрагментации клетки и формированию окруженных мембраной апоптотиче-ских телец, состоящих из цитоплазмы и плотно расположенных органелл, с или без фрагментов ядра.
4 Фагоцитоз апоптотических клеток или телец.
Фагоцитоз апоптотических клеток или телец осуществляется окружающими здоровыми клетками, или паренхиматозными, или макрофагами. Апоптотические тельца быстро разрушаются в лизосомах, а окружающие клетки либо мигрируют, либо делятся, чтобы заполнить освободившееся после гибели клетки пространство. Фагоцитоз апоптотических телец макрофагами или другими клетками активируется рецепторами на этих клетках: они захватывают и поглощают апоптотические клетки. Один из таких рецепторов на макрофагах - рецептор витронектина, который является Рз-интегрином и активирует фагоцитоз апоптотических нейтрофилов [16].
Апоптоз принимает участие в следующих физиологических и патологических процессах:
1) запрограммированном разрушении клеток во время эмбриогенеза (включая имплантацию, органогенез). Несмотря на то, что при эмбриогенезе апоптоз не всегда является отражением «запрограммированной смерти клетки», это определение апоптоза широко используют различные исследователи;
2) гормон-зависимой инволюции органов у взрослых, например, отторжение эндометрия во время менструального цикла, атрезии фолликулов в яичниках в менопаузе и регрессия молочной железы после прекращения лактации;
3) удалении некоторых клеток при пролиферации клеточной популяции. Гибели отдельных клеток в опухолях, в основном при ее регрессии, но также и в активно растущей опухоли;
4) гибели клеток иммунной системы, как В-, так и Т-лимфоцитов, после истощения запасов цитокинов, а также гибели аутореактивных Т-клеток при развитии в тимусе;
5) патологической атрофии гормон-зависимых органов и истощении лимфоцитов в тимусе при терапии глюкокортикоидами;
6) патологической атрофии паренхиматозных органов после обтурации выводных протоков, что наблюдается в поджелудочной и слюнных железах, почках;
7) гибели клеток, вызванных действием цитотоксических Т-клеток, например, при отторжении трансплантата и болезни «трансплантат против хозяина» [16];
8) повреждении клеток при некоторых вирусных заболеваниях, например, при вирусном гепатите, когда фрагменты апоптотических клеток обнаруживаются в печени, как тельца Каунсильмана;
9) гибели клеток при действии различных повреждающих факторов, которые способны вызвать некроз, но действующих в небольших дозах, например, при действии высокой температуры, ионизирующего излучения, противоопухолевых препаратов [17].
Регуляция апоптоза.
Апоптоз это генетически контролируемая смерть клетки. В настоящее время выявлено большое число генов, которые кодируют вещества, необходимые для регуляции апоптоза. Многие из этих генов сохранились в ходе эволюции - от круглых червей до насекомых и млекопитающих. Некоторые из них обнаруживаются также в геноме вирусов. Таким образом, основные биохимические процессы апоптоза в разных экспериментальных системах (исследования ведутся на круглых червях и мухах) являются идентичными, поэтому результаты исследований можно прямо переносить на другие системы (например, организм человека).
Апоптоз может регулироваться:
1) внешними факторами;
2) автономными механизмами.
Воздействие внешних факторов.
Апоптоз может регулироваться действием многих внешних факторов, которые ведут к повреждению ДНК. При невосстановимом повреждении ДНК путем апоптоза происходит элиминация потенциально опасных для организма клеток. В данном процессе большую роль играет ген супрессии опухолей р53. К активации апоптоза также приводят вирусные инфекции, нарушение регуляции клеточного роста, повреждение клетки и потеря контакта с окружающими или основным веществом ткани. Апоптоз - это защита организма от персистенции поврежденных клеток, которые могут оказаться потенциально опасными для многоклеточного организма.
При стимуляции тканей каким-либо митогеном ее клетки переходят в состояние повышенной митотической активности, которая обязательно сопровождается некоторой активацией апоптоза. Судьба дочерних клеток (выживут они или подвергнутся апоптозу) зависит от соотношения активаторов и ингибиторов апоптоза:
- ингибиторы включают факторы роста, клеточный матрикс, половые стероиды, некоторые вирусные белки;
- активаторы включают недостаток факторов роста, потерю связи с матриксом, глюкокортикоиды, некоторые вирусы, свободные радикалы, ионизирующую радиацию [58].
При воздействии активаторов или отсутствии ингибиторов происходит активация эндогенных протеаз и эндонуклеаз. Это приводит к разрушению цитоскелета, фрагментации ДНК и нарушению функционирования митохондрий. Клетка сморщивается, но клеточная мембрана остается интактной, однако повреждение ее приводит к активации фагоцитоза. Погибшие клетки распадаются на небольшие, окруженные мембраной, фрагменты, которые обозначаются как апоптотические тельца. Воспалительная реакция на апоптотические клетки не возникает.
Автономный механизм апоптоза.
При развитии эмбриона различают три категории автономного апоптоза: морфогенетический, гистогенетический и филогенетический.
Морфогенетический апоптоз участвует в разрушении различных тканевых зачатков. Примерами являются:
- разрушение клеток в межпальцевых промежутках;
- гибель клеток приводит к разрушению избыточного эпителия при слиянии небных отростков, когда формируется твердое небо.
- гибель клеток в дорсальной части нервной трубки во время смыкания, что необходимо для достижения единства эпителия двух сторон нервной трубки и связанной с ними мезодермы.
Гистогенетический апоптоз наблюдается при дифференцировке тканей и органов, что наблюдается, например, при гормональнозависимой дифференцировке половых органов из тканевых зачатков. Так, у мужчин клетками Сертоли в яичках плода синтезируется гормон, который вызывает регрессию протоков Мюллера путем апоптоза. Филогенетический апоптоз участвует в удалении рудиментарных структур у эмбриона, например, пронефроса.
При различных состояниях может наблюдаться как ускорение, так и замедление апоптоза. Несмотря на то, что апоптоз могут активировать различные факторы, характерные для определенных типов клеток, однако конечный путь апоптоза регулируется точно установленными генами и является общим, независимо от причины активации апоптоза. Все факторы, усиливающие или ослабляющие апоптоз, могут действовать прямо на механизм гибели клетки или опосредованно, путем влияния на регуляцию транскрипции [59].
В некоторых случаях влияние этих факторов на апоптоз является решающим (например, при глюкокортикоид-зависимом апоптозе тимоцитов), а в других не имеет особой важности (например, при Fas- и TNF-зависимом апоптозе). В процессе регуляции принимает участие большое количество веществ. Наиболее изученными из них являются вещества из семейства bcl-2. Bcl-2 ген впервые был описан как ген, который транслоцируется в клетках фолликулярной лимфомы и ингибирует апоптоз. При дальнейших исследованиях оказалось, что Bcl-2 является мультигеном, который обнаруживается даже у круглых червей. Гомологичные гены были также обнаружены в некоторых вирусах. Все вещества, относящиеся к данному классу делятся на активаторы и ингибиторы апоптоза.
Снижение апоптоза.
Продукт р53 гена следит за целостностью генома при митозе. При нарушении целостности генома клетка переключается на апоптоз. Наоборот, белок bcl-2 ингибирует апоптоз. Таким образом, недостаток р53 или избыток bcl-2 приводит к накоплению клеток: эти нарушения наблюдаются в различных опухолях. Изучение факторов регулирующих апоптоз имеет важное значение в разработке лекарственных препаратов, усиливающих гибель клеток злокачественных новообразований.
Аутоиммунные заболевания могут отражать нарушения в индукции апоптоза лимфоидных клеток, способных реагировать с собственными антигенами. Например, при системной красной волчанке наблюдается нарушение Fas-рецепторов на клеточной поверхности лимфоцитов, что ведет к активации апоптоза. Некоторые вирусы повышают свою выживаемость путем ингибирования апоптоза инфицированных клеток, например, вирус Эпштейна-Барра может воздействовать на обмен bcl-2.
Ускорение апоптоза.
Ускорение апоптоза доказано при синдроме приобретенного иммунодефицита (СПИД), нейротрофических заболеваниях и некоторых заболеваниях крови, при которых наблюдается дефицит каких-либо форменных элементов. При СПИДе вирус иммунодефицита может активировать CD4 рецептор на неинфицированных Т-лимфоцитах, ускоряя, таким образом, апоптоз, что приводит к истощению клеток данного типа [60].
Микроэлементы и апоптоз.
Дефицит или избыток микроэлементов оказывают влияние на регуляцию количества клеток и регуляции апоптоза. Избыточное накопление или усиленное высвобождение связанных в комплексы эссенциальных микроэлементов (железо, медь, цинк, селен) и, в особенности, накопление токсичных (кадмий, ртуть, свинец) провоцирует генерацию активных форм кислорода, что ведет к увеличению потенциального риска по повреждению генов опухоль-супрессирующих белков. По этой причине происходит торможение апоптоза клеток, содержащих мутации, что, в свою очередь, может способствовать развитию канцерогенеза. Даже умеренный дефицит или избыток микроэлементов оказывает влияние на процессы репопуляции клеток и регуляцию апоптоза. С другой стороны, апоптоз вносит вклад во внутриклеточное накопление и потерю микроэлементов. Например, гемохроматоз и болезнь Вильсона-Коновалова увеличивают риск возникновения рака печени из-за накопления мутанта р53.
Токсический эффект воздействия металлов обычно обусловлен взаимодействием с клеточной мишенью. Такими мишенями являются специфические биохимические процессы и клеточные, субклеточные мембраны, органеллы клетки. Токсические эффекты металлов в своей основе связаны с двумя главными механизмами действия. Многие металлы имеют значительную аффинность к сульфгидрильным группам (-SH) белков. Формирование ковалентных связей с этими группами металлы могут ингибировать активность ферментов или нарушить целостность клеточных мембран. Последнее подтверждается признаками дестабилизации липопротеиновых комплексов, происходящей за счет конформационной перестройки апопротеиновой части комплексов из-за блокирования SH-групп. Другой механизм проявления токсичности металлов - конкуренция и замещение эссенциальных катионов [53].
Апоптоз является важным механизмом в поддержании гомеостаза в самообновляющихся тканях. Г омеостаз в коже сохраняется благодаря апоптозу. Нарушение регуляции апоптоза в коже приводит к развитию аутоиммунных и злокачественных заболеваний. Возможно, что облысение также связано с индукцией апоптоза в волосяном фолликуле. Быстрая и часто внезапная утрата волос (алопеция) является осложнением многих терапевтических протоколов в онкологии. Алопеция может быть результатом нарушения в регуляции апоптоза.
Было проведено изучение апоптоза в волосяном фолликуле в эксперименте на модели алопеции, индуцированной лучевой терапией. Изучена экспрессия в волосяном фолликуле регуляторов апоптоза: р53, bcl-2, bax, Fas-лиганда, а также влияние на регуляцию апоптоза комплексных соединений метронидазола с металлами (Co, Zn, Ni, Cu) и солей (сульфатов) этих металлов. Исследование выполнено на биопсийных образцах кожи экспериментальных животных после различной интенсивности дистанционной лучевой терапии опухолей с использованием линейного ускорителя электронов с выводом пучков тормозного и электронного излучения [53].
Индукция апоптоза в волосяном фолликуле сопровождалась значительным повышением уровня кадмия и железа в биологических жидкостях животных при достоверном снижении цинка и меди как в биосубстратах, так и в шерсти экспериментальных животных (крыс).
Комплексы цинка и никеля с метронидазолом в отличие от сульфатов цинка и никеля, свободного лиганда (метранидазола), а также комплексов меди и кольбата, введенные как до начала лучевой терапии опухолей, так и во время облучения, замедляли процесс апоптоза в волосяных фолликулах, что приводило к отсутствию облысения в среднем у 50 % экспериментальных животных и значительно снижало его проявление среди особей другой половины экспериментальных животных [53].
2 Материалы и методы
В проведении исследований были использованы наночастицы железа. Они были синтезированы методом высокотемпературной конденсации с их последующей модификацией кислородом на установке Миген. Наночастицы железа представляют собой сферические частицы размером 80 ± 2 нм.
Исследования выполнены в условиях экспериментально-биологической клиники (вивария) Оренбургского Государственного университета на самцах крыс линии «Wistar», средняя масса которых составила 190 ± 8 г. В ходе опыта изучено морфологическое состояние селезенки животных.
Для проведения эксперимента было отобрано 24 трехмесячных крыс, количество животных в опытной группе - 12 голов, в контроле 12, находящихся на общевиварийном рационе кормления. В ходе эксперимента опытной группе крыс внутримышечно в бедренную группу мышц вводили водную суспензию наночастиц железа (Fe3O4, cFe0) с периодичностью 1 один раз в неделю в дозе 2 мг/кг массы животного. Контрольной группе внутримышечно вводили воду для суспензий в том же объеме. Забой животных проводили путем декапитации под нембуталовым наркозом.
Таблица 3 - Схема убоя опытной и контрольной группы
|
Г руппа |
Количество |
Характеристика группы |
||
|
1 |
К1 |
3 |
3 |
Седьмые сутки после 1 инъекции |
|
2 |
К2 |
3 |
3 |
Седьмые сутки после 2 инъекции |
|
3 |
К3 |
3 |
3 |
Седьмые сутки после 3 инъекции |
|
4 |
К4 |
3 |
3 |
Седьмые сутки после 7 инъекции |
|
Итого: |
12 |
12 |
|
|
Материал для исследования (селезенка) мы получали, используя
анатомический метод. Для этого вскрытие лабораторных животных проводили
на металлических столиках. Методика вскрытия одинакова для всех
животных. Животное фиксировали марлевыми петлями за лапки в положении на
спине. Волосяной покров на участке предполагаемого разреза выбривали.
Нижнюю часть передней стенки живота приподнимали пинцетом по средней
линии, разрезали до грудины, не задевая органов брюшной полости. Грудную
полость вскрывали, иссекая грудину двумя параллельными разрезами через
реберные хрящи. Далее из брюшной полости извлекали селезенки.
Для гистологического исследования берут кусочки органов и тканей величиной не более 1 см3. Материал желательно получать как можно раньше после убоя.
Приготовление препаратов, для последующего гистологического исследования, проходило в несколько этапов:
1 Фиксация.
Взятый для гистологического исследования материал сразу же должен подвергаться фиксации. Фиксация - метод обработки ткани с целью закрепления ее прижизненной структуры. Это достигается путем воздействия на ткань специальных растворов (фиксаторов). Количество фиксатора следует брать в 20 - 100 раз больше объема кусочка фиксируемого материала.
Кусочки ткани, взятые для гистологического исследования, не должны быть толще 0, 5 - 0, 7 см. Чтобы кусочки ткани не прилегали плотно к стенкам банки, их кладут на вату или фильтровальную бумагу. Фиксация водным раствором формалина нежелательна в тех случаях, когда исследование ткани имеет целью обнаружение веществ, растворимых в воде.
Фиксируемые ткани претерпевают ряд физико-химических изменений. Наиболее существенными из них являются: быстрое свертывание белков и отчасти липоидов и переход их в такое состояние, при котором ткани не изменяются от длительного хранения и во время последующих обработок.
Существуют фиксаторы простые и сложные. К простым относятся 10 - 20 % раствор формалина, 96° спирт, 100° (абсолютный) спирт, 1 - 2 % раствор осмиевой кислоты и др. Сложные фиксаторы: спирт - формол (спирт 70° - 100 мл и формалин 2 - 5 мл) жидкость Ценкера (сулема - 5 г, сернокислый натрий — 1 г, двухромовокиолый калий - 2, 5 г, дистиллированная вода -100 мл, ледяная уксусная кислота 5 мл) и др. Продолжительность фиксации -от нескольких часов до 1 суток и более в зависимости от свойств фиксатора и характера исследуемого материала. Наиболее употребляемыми являются формалин, спирт, реже ацетон, сулема и др.
Фиксация формалином.
Отобранный материал мы фиксировали в 10 % растворе нейтрального формалина (100 мл 37 - 40 % формальдегида, 900 мл дистиллированной воды, карбонат кальция или магния в избытке). Продолжительность фиксации при комнатной температуре составила 1 - 2 суток.
Формалин в указанной концентрации сравнительно быстро (48 - 72 ч) пропитывает ткань и хорошо фиксирует ее. Нельзя фиксировать материал в растворе формалина более высокой концентрации или в неразведенном продажном формалине. В этом случае поверхностные слои ткани быстро уплотняются, образуют корочку, которая препятствует проникновению фиксирующей жидкости вглубь, где процессы аутолиза могут продолжаться.
В связи с тем, что в формалине всегда содержится какое-то количество муравьиной кислоты, которая может оказать отрицательное воздействие на ткань и помешать некоторым методам дальнейшей обработки материала (серебрение и др. ) его следует нейтрализовать мелом. Следует также иметь в виду, что при хранении формалина в холодном помещении формальдегид способен к полимеризации и выпадению из крепких растворов в виде белых осадков. В целях предупреждения этого рекомендуют хранить формалин в теплом помещении, в темной посуде.
В случаях, когда требуется быстрое исследование, кусочки ткани фиксируют в формалине, нагретом до 85 - 90°С. Продолжительность фиксации кусочков толщиной 2 - 3 мм при такой температуре 10 - 15 мин. При длительном хранении материала; в формалине в фиксируемой ткани образуются темно-бурые осадки, которые загрязняют препараты. Для удаления осадков рекомендуется опускать гистологические срезы в 2 - 3 %-ный раствор перекиси водорода или в 1 %-ный раствор едкого калия, затем их несколько раз промывать водой.
Фиксация спиртом.
Этот метод целесообразен только в тех случаях, когда необходимо зафиксировать в тканях вещества, растворимые в воде и водных растворах фиксаторов. Для фиксации применяют спирт 95° или 100°. Спирт, извлекая воду из кусочков ткани, сам разбавляется и делается менее крепким. Поэтому рекомендуется менять спирт несколько раз. Кусочки ткани при фиксации спиртом должны быть толщиной 2 - 3 мм. В зимнее время рекомендуется применять спирт-формалин (спирта 70° - 90, 0, формалина 10, 0).
2 Помывка материала.
После фиксации материал промывают (чаще всего в течение нескольких часов в проточной воде) с тем, чтобы избавить его от избытка фиксатора и различных осадков фиксирующих жидкостей. Изучить с помощью микроскопа такие фиксированные кусочки органов невозможно, т. к. они не прозрачны. Чтобы кусочек органа можно было микроскопировать, его надо разрезать на очень тонкие пластинки - срезы, толщина которых измеряется в микрометрах. Такие срезы получают с помощью специальных приборов -микротомов. Но для того, чтобы резать на микротоме кусочек ткани, ее надо предварительно уплотнить. Это достигается путем пропитывания застывающими жидкостями - расплавленным парафином. Парафин в воде не растворяется, и поэтому промытый после фиксации кусочек ткани необходимо предварительно обезводить, и только затем пропитывать.
3 Обезвоживание.
Обезвоживание ткани производятся постепенно (чтобы не произошло сморщивания) путем проведения ее через спирты возрастающей крепости: 50°, 60°, 70°, 80°, 90°, 96°, 100°. В каждом спирте кусочки находятся от нескольких часов до 1 суток в зависимости от величины кусочка.
4 Уплотнение (заливка).
При заливке кусочки предварительно пропитываются теми жидкостями, которые служат растворителями для парафина (ксилол или толуол). Для изготовления гистологических срезов фиксированная ткань нуждается в дополнительном уплотнении. Для этого существует несколько методов: замораживание ткани, пропитывание ее целлоидином, парафином и т. п. После фиксации и уплотнения ткани тем или иным способом приготовляют срезы.
В своей работе мы использовали парафин. При заливке в парафин кусочки из абсолютного спирта переносятся в смесь абсолютного спирта с хлороформом или ксилолом, взятых поровну, затем чистый ксилол и, наконец, в расплавленный насыщенный раствор парафина в хлороформе, где они находятся в термостате при температуре 37° до 1 суток и более. Дальнейшая заливка проводится в термостате при температуре 54 - 56°С в трех порциях парафина. Окончательная заливка проводится в парафин с добавлением воска, который наливают в специальные бумажные коробочки или стеклянные чашки, а затем эти коробочки или чашки после появления на поверхности парафина пленки, погружают в воду.
Происходит полное затвердение парафина. Кусочки с окружающим их парафином извлекают из коробочек и с помощью расплавленного парафина, наклеивают на деревянные кубики, получаются парафиновые блоки. Уплотнения также можно добиться замораживанием кусочка органа (срочная биопсия).
5 Приготовление срезов.
Срезы с блоков изготовляются на микротоме. Наиболее распространены микротомы санный и замораживающий. В специальных устройствах микротома зажимается парафиновый блок и микротомный нож. Существует механизм, поднимающий объектодержатель с блоком на заданное количество микрометров. Это позволяет при каждом скольжении ножа в плоскости параллельной поверхности блока получать срезы толщиной 5 - 10 микрометров с парафиновых блоков.
6 Окрашивание.
Изготовленные на микротоме срезы окрашиваются. Перед окраской из парафиновых срезов обязательно удаляют парафин (растворением в ксилоле). Окрашивание необходимо производить для того, чтобы отчетливо выявить под микроскопом тонкие структуры объекта. В неокрашенных срезах большинство структур одинаково преломляет свет, поэтому рассмотреть их не удается.
Выявление на срезе гистологических структур основано на неодинаковом их отношении к красителям. Одни структуры среза вступают в реакцию с кислыми красителями и ими окрашиваются (ацидофильные, оксифильные структуры), другие реагируют с основными красителями и окрашиваются преимущественно ими (базофильные структуры). Некоторые структуры окрашиваются и кислыми и основными красителями.
По происхождению различают краски естественные, к которым относятся краски растительного и животного происхождения, и краски искусственные. Краской растительного происхождения является гематоксилин, который добывается из кампешевого дерева, растущего в Америке и в Армении.
К краскам животного происхождения относится кармин, который добывается из насекомых кошенили, живущих на кактусовых деревьях в Мексике, Армении и др. В настоящее время большинство красок готовят синтетически (искусственные краски).
По окрашиванию определенных гистологических структур различают краски ядерные (окрашивание ядра), цитоплазматические (окрашивающие цитоплазму), и специальные, окрашивающие избирательно определенные структуры. Ядерные краски - гематоксилин, кармин, сафранин, метиленовая синь, азур, тионин. Цитоплазматические краски - эозин, пикрофуксин.
Существуют специальные краски и реактивы: судан Ш (окрашивает жир в оранжевый цвет), осмиевая кислота (импрегнируемый ею жир окрашиватся в черный цвет), резорцинфуксин Вейгерта (дает темно-синюю окраску эластических волокон), орсеин (окрашивает эластические волокна в бурый цвет). Метиленовый синий окрашивает нервные элементы в синий цвет, а при импрегнации серебром они приобретают коричневый цвет. Чаще всего для окрашивания гистологических срезов применяется окрашивание раствором гематоксилина (приготовленным по методу Бемера) и 1 - 2 % эозином.
В своей работе мы использовали окраску гематоксилин-эозином. Окрашивают срезы в маленьких чашках Петри или на стеклах. Этот метод применяется для окраски срезов, приготовленных любым способом. При этом ядра клеток приобретают фиолетово-синий или густо-синий цвет, а цитоплазма и волокнистое вещество — светло-синий или розово-красный. Жиры и липоиды не окрашиваются. Эритроциты млекопитающих, поскольку они ядер не содержат, окрашиваются только эозином.
Окраску срезов в чашках Петри производят следующим образом:
1 Срез переносят препаровальной иглой из воды в раствор гематоксилина на 2 - 5 мин.
2 Промывают в воде 2 - 5 мин.
3 Погружают на 10 - 20 с в 1 %-ный раствор соляной кислоты на 70° спирте (если срез сильно перекрашен гематоксилином, его следует держать в этом растворе несколько дольше).
4 Промывают в чистой воде 5 - 10 мин.
5 Промывают в слабощелочном растворе (в баночку с водой прибавляют 1 - 2 капли нашатырного спирта) 10 мин.
6 Промывают снова чистой водой в течение 10 - 15 мин. Если срез после щелочной воды недостаточно промыт, он плохо опрашивается эозином.
7 Окрашивают эозином в течение 3 - 5 мин.
8 Промывают в течение 1 - 2 мин водой.
9 Обезвоживают в спиртах восходящей крепости - 75°, 90°, 100°. Если срез перекрашен эозином, его следует несколько дольше держать в 75° спирте.
10 Просветляют в карболксилоле.
11 При помощи шпателя и иголки срез переносят на предметное стекло.
12 Высушивают фильтровальной бумагой.
13 На срез наносят каплю канадского или пихтового бальзама и накрывают покровным стеклом.
7 Заключение среза.
Окрашенные и промытые в воде срезы во избежание помутнения обезвоживают в спиртах (70°, 96°), просветляют в карбол-ксилоле, ксилоле, а затем на предметное стекло, где находится срез, помещают каплю бальзама и срез накрывают покровным стеклом. Бальзам представляет собой растворенную в ксилоле смолу одного из видов сосны, растущей в Канаде (канадский бальзам), смолу пихты (сибирский бальзам) или специальную синтетическую среду.
Анализ исследуемых образцов осуществлялся в лаборатории АНО «Центр биотической медицины», г. Москва (аттестат аккредитации ГСЭН. Яи. ЦОА. 311, регистрационный номер в Государственном реестре РОСС RU. 0001. 513118 от 29 мая 2003 г. ) Все полученные в ходе исследования данные были подвергнуты статистической обработке с использованием программ Excel, Statistica 5.
С использованием атомно-эмиссионной и масс-спектрометрии изучен минеральный состав селезенки по 25 химическим элементам, при однократной и многократных внутримышечных инъекциях наночастиц железа, как наиболее восприимчивого органа к воздействию внешних факторов.
3. Результаты собственных исследований
3. 1 Морфологическая характеристика селезенки при внутримышечном введении наночастиц железа
При исследовании материала (селезенка) использованы: окраска гематоксилин Майера-эозин, специфическая реакция на наличие железа -реакция Перлса (Э. Пирс, 1962), морфометрические методы исследования (подсчет средних по размеру макрофагов красной пульпы селезенки на условной единице площади, дающие положительную реакцию Перлса).
На протяжении всего эксперимента при введении наночастиц железа 60 - 100 нм, поверхность которых окислена до Fe3O4, c Fe0 в дозе 2 мг/кг массы животного в селезенке, которая в норме является одним из основных депо железа, где трудно разграничить эндогенное железо и экзогенно введенное, по сравнению с контролем количество клеток, дающих положительную реакцию Перлса было недостоверно различным (Рисунок 2).
По оси ординат - количество клеток на условной единице площади; По оси
абсцисс - серии эксперимента: к-контроль, 1 - седьмые сутки после
однократного введения; 2 - 7 сутки после второго введения; 3 - 7 сутки
после третьего введения; 4 - 7 сутки после седьмого введения наночастиц.
Рисунок 2 - Плотность средних по размеру макрофагов селезенки, дающих положительную реакцию Перлса
В селезенке на седьмые сутки после введения наночастиц железа на фоне одинакового по численности клеток, дающих положительную реакцию Перлса на условной единице площади по сравнению с предыдущим сроком исследования увеличивается число крупных перенасыщенных железом макрофагов, они встречаются небольшими группами вблизи капсулы органа (Рисунок 3, 4).
Рисунок 3 - Красная пульпа селезенки. Опыт. Реакция Перлса
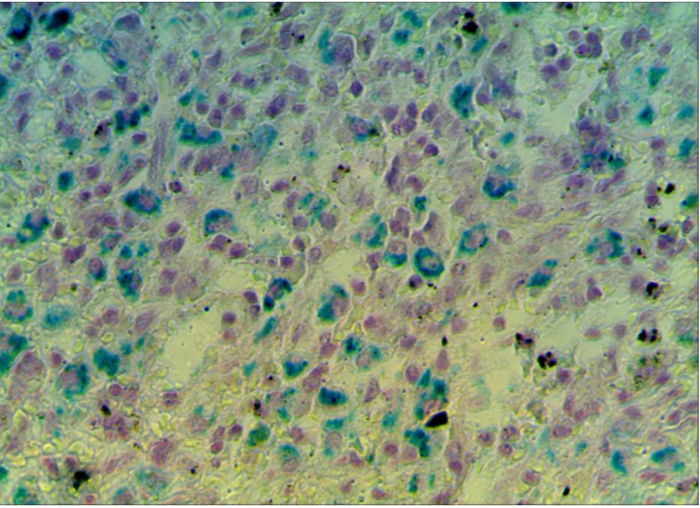
Рисунок 4 - Красная пульпа селезенки. Контроль. Реакция Перлса. Увел. 600
На седьмые сутки после второго внутримышечного введения наночастиц железа в селезенке опытных животных при этом сроке исследования увеличивается число средних по размеру макрофагов, содержащих железо и крупных клеток, дающих интенсивную положительную реакцию Перлса (Рисунок 5).
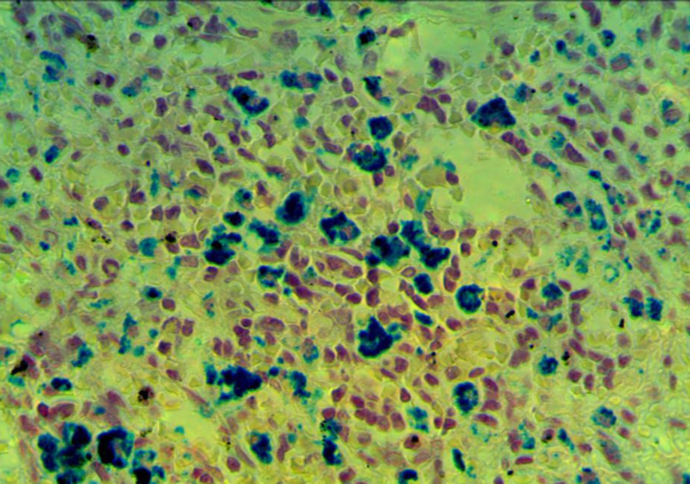
Рисунок 5 - Красная пульпа селезенки.
Опыт. 7 сутки после второго внутримышечного введения наночастиц железа. Реакция Перлса. Увел. 600
На седьмые сутки после третьей инъекции наночастиц железа в селезенке увеличивается число средних по размерам макрофагов на условной единице площади и особенно увеличивается количество гигантских клеток, дающих интенсивную положительную реакцию Перлса (Рисунок 6, 7).
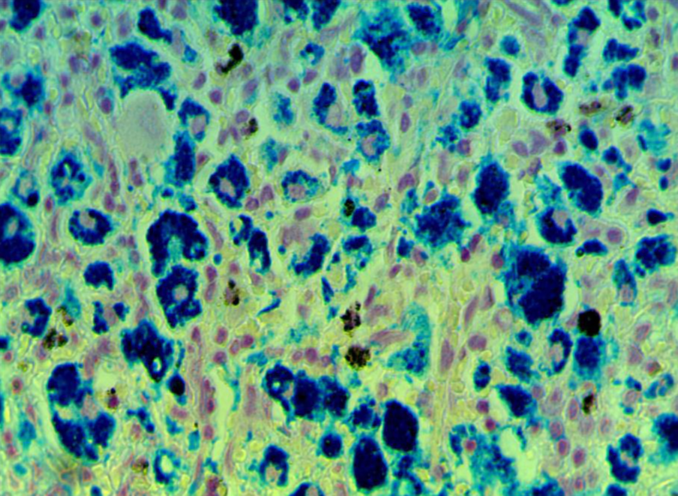
Рисунок 6 - Красная пульпа селезенки.
Опыт. 7 сутки после третьей инъекции наночастиц железа. Гиганские макрофаги, дающие интенсивную реакцию Перлса. Увел. 600
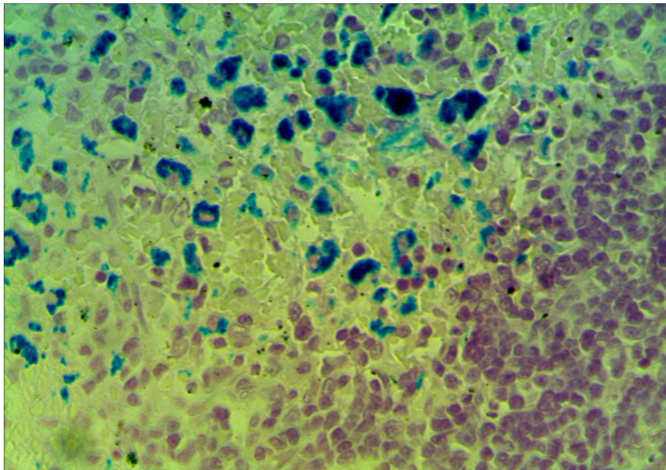
Рисунок 7 - Красная пульпа селезенки. Контроль. Реакция Перлса. Увел. 600
На седьмые сутки после седьмой внутримышечной инъекции наночастиц железа в селезенке опытных животных по сравнению с контролем содержание макрофагов, дающих положительную реакцию Перлса, уменьшено (Рисунок 8, 9).
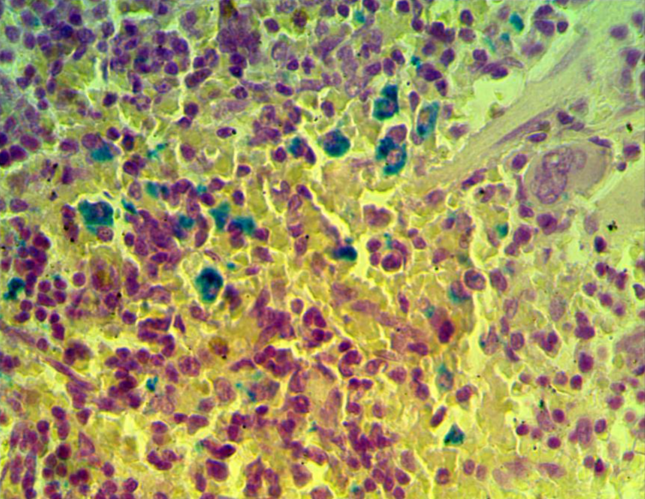
Рисунок 8 - Красная пульпа селезенки.
Опыт. 7 сутки после седьмой инъекции наночастиц железа. Уменьшение числа клеток, дающих положительную реакцию Перлса. Увел. 600
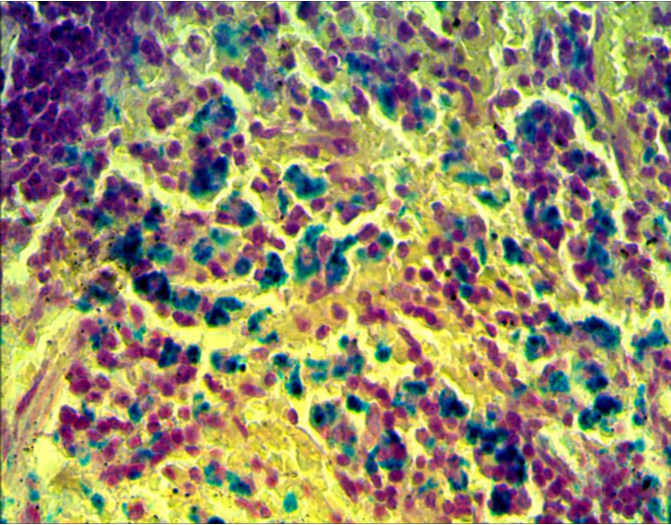
Рисунок 9 - Красная пульпа селезенки. Контроль. Реакция Перлса. Увел. 600
3. 2 Анализ разницы концентрации химических элементов селезенки
Введение наночастиц железа не однозначно сказывается на минеральном составе селезенки. Общее количество эссенциальных элементов селезенке на протяжении эксперимента было повышено в первой, второй и четвертой опытных группах по сравнению с контрольными, наиболее выраженное для четвертой группы - седьмые сутки после седьмой инъекции и превышает значение контроля на 1356, 78 %. Характер таких изменений концентрации эссенциальных элементов в опытных группах связан со специфическими изменениями содержания отдельных элементов. В первой опытной группе по сравнению с контрольной колебание уровня эссенциальных элементов на 91, 47 % происходит за счет увеличения концентрации Ni на 100 %, Se - 41, 5 %, Cr - 28, 6 %, V - 20 %, Si - 16, 4 %, Fe - 11, 9 %, на фоне снижения As на 4, 16 %, Cu - 1, 5 %.
Через семь суток после второй инъекции повышение общей концентрации эссенциальных элементов в опытной группе по сравнению с контрольной достигает 289, 97 % за счет возрастания концентрация I на 35 %, Si - 211, 1 %, Fe - 96, 9 %, As - 30, 7 %. При этом снижается содержание Ni на 50 %, Cu - 5, 6 %, Se - 2, 8 %.
На седьмые сутки после третьей инъекции в третьей опытной группе снижается общее количество эссенциальных на 11, 23 % по сравнению с контрольной, в основном за счет снижения концентрации Fe на 10, 27 %. При этом происходит синхронное увеличение следующих элементов: Ni, Si, Cu, Se.
Полученные данные после седьмой инъекции свидетельствуют, что положительной динамикой к накоплению обладают почти все эссенциальные элементы, за исключением As концентрация которого не изменяется. В опытной группе по сравнению с контрольной происходило увеличение концентрации Mn на 9743, 7 %, Cu - 3531, 7 %, Co - 3300 %, Si - 2490 %. Концентрация Fe повышалась на 581, 5 %.
При анализе соотношения макроэлементов Ca, K, Na, выявлено, что при введении наночастиц железа их амплитуда колебаний составляет 4 - 18 %. Концентрация Mg и P на протяжении всего эксперимента выше в опытной группе по сравнению с контрольной. На седьмые сутки после седьмой инъекции происходит резкое увеличение содержания макроэлементов. В начале эксперимента (седьмые сутки после первой инъекции) общее содержание макроэлементов в опытной группе по сравнению с контрольной выше на 0, 15 %, а в конце эксперимента (седьмые сутки после седьмой инъекции) на 78, 52 %. В четвертой опытной группе увеличивается содержание P на 4723, 4 %, Ca - 3350 %, Mg - 1700, Na - 1634, 1%, K - 1066, 1 % по сравнению с контролем.
Проведя анализ соотношения общего пула токсических элементов, необходимо отметить, что основные изменения происходят в начале опыта и на конечной стадии эксперимента. На седьмые сутки после первой инъекции в опытной группе по сравнению с контрольной наблюдается снижение концентрации Pb на 33, 4 % и Al на 32, 2 %, содержание Hg и Sn остается стабильным, при этом происходит резкое увеличение Cd на 600 %.
На седьмые сутки после второй инъекции содержание большинства токсических элементов (Cd, Hg, Pb, Sn ) остается стабильным, за исключением Al концентрация которого повышается на 41, 6 % и Sr концентрация которого снижается на 33, 4 %.
На седьмые сутки после третьей инъекции в опытной группе по сравнению с контрольной увеличивается содержание Cd на 100 %, Pb - 50 %, Sr - 14, 3 % и уменьшается концентрация Al на 21, 7 %.
Семикратное введение наночастиц железа приводит к возрастанию общего количества токсичных элементов в опытной группе по сравнению с контрольной. Увеличение происходит за счет накопления таких элементов как: Al, Sr, Sn, Pb, Hg.
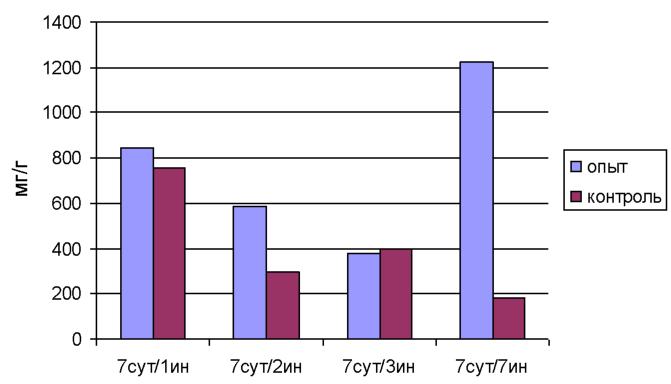
Рисунок 10 - Содержание железа в селезенке
Общий анализ концентрации всех химических элементов селезенки на седьмые сутки после первой инъекции свидетельствует о повышении концентрации Cd, Ni, Se, Cr, V, Si, Fe, Mg на 600, 100, 41, 5, 28, 6, 20, 16, 4, 11, 9, 11, 8 % соответственно на фоне снижения Pb, Al, As, Cu на 33, 4, 32, 2, 4, 16, 1, 5 % соответственно (рисунок 11).
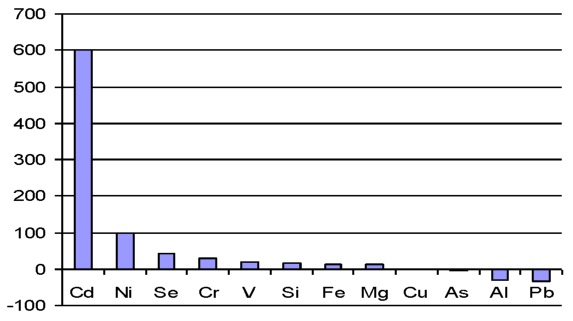
Рисунок 11 - Разница концентрации химических элементов в селезенке 1 опытной группы, относительно контрольной, %
На седьмые сутки после второй инъекции концентрация химических элементов Ni, Sr, Na, Cu, Se снижалась на 50, 33, 4, 7, 2, 5, 6, 2, 8 %. Некоторые элементы имели тенденцию к накоплению. Концентрация I, Si, Fe, Al, As, Cr увеличивалась на 350, 211, 1, 96, 9, 41, 6, 30, 7, 9, 1% (рисунок 12).
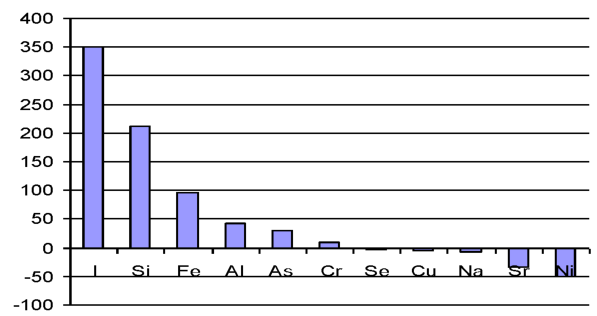
Рисунок 12 - Разница концентрации химических элементов в селезенке 2 опытной группы, относительно контрольной, %
После третьей инъекции повышалась концентрация Ni, Cd, Pb, Si, Cu, Sr на 150, 100, 50, 27, 2, 16, 9, 14, 3 % соответственно. Концентрация I, Al, As, Na, Zn уменьшается на 25, 23, 7, 21, 7, 8, 1, 6, 5 % (рисунок 13).
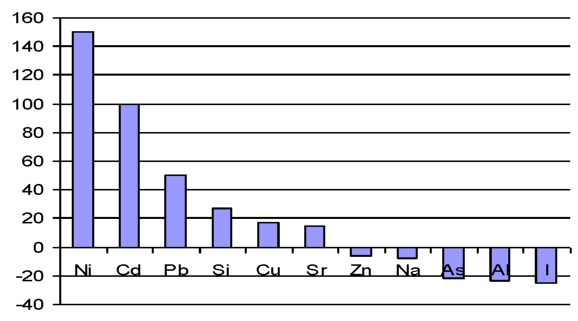
Рисунок 13 - Разница концентрации химических элементов в селезенке 3 опытной группы, относительно контрольной, %
В четвертой опытной группе по сравнению с контрольной происходило увеличение концентрации Mn, P, Cu, Ca, Si, Na на 974, 3, 472, 3, 353, 1, 335, 249, 163, 4 % соответственно. Концентрация Fe повышалась на 581, 5 % (рисунок 14).
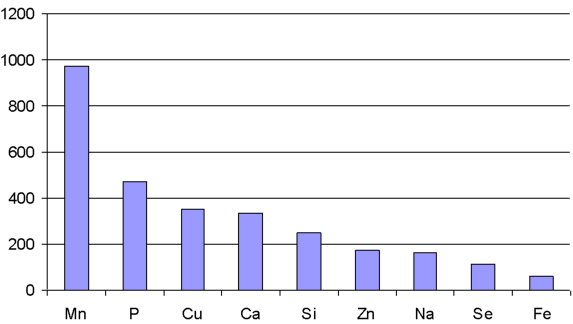
Рисунок 14 - Разница концентрации химических элементов в селезенке 4 опытной группы, относительно контрольной, %
По реакции концентрации элементов на введение наночастиц железа их можно разделить на следующие группы:
1 Элементы, амплитуда колебания которых в контрольных и опытных группах совпадает, но уровень концентрации в контрольной группе выше, чем в опытной: K, Al, As, Na.
2 Элементы, амплитуда колебания которых в контрольных и опытных группах совпадает, но уровень концентрации которых в контрольной группе ниже, чем в опытной: Zn, Si, B, Fe, Cu.
3 Элементы, которые обладают высокой амплитудой колебания и их концентрация превышает контрольные значения: Cd, Mn, P, Ni, I.
Заключение
Уменьшение клеток, дающих положительную реакцию Перлса, на условной единице площади красной пульпы после семикратного введения наночастиц железа свидетельствует о развертывании компенсаторноприспособительных реакций направленных на предотвращения гемосидероза в органе.
Таким образом, морфологический анализ селезенки экспериментальных животных при многократном внутримышечном введении наночастиц железа позволил сделать следующие выводы:
1 ;Однократное введение наночастиц железа не сказывается на структуре одного из основных депо железа - селезенке вне зависимости от срока исследования.
2 После последующих инъекций, особенно после третьей инъекции, в селезенке по сравнению с контролем увеличивается на условной единице площади число макрофагов, содержащих железо и число гигантских макрофагов, дающих интенсивную реакцию Перлса. Это возможно связано с активным поступлением наночастиц железа и депонированием железа в макрофагах органа. Уменьшение клеток, дающих положительную реакцию Перлса, красной пульпы после шести- и семикратного введения наночастиц железа свидетельствует о развертывании компенсатоно-приспособительных реакций направленных на предотвращения гемосидероза в органе.
3 Введение наночастиц железа не приводит к обеднению селезенки химическими элементами, при этом концентрация железа увеличивается на 581, 5 %. Минеральный профиль органа выглядит следующим образом:
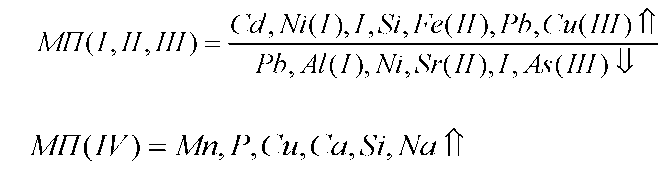
Список использованных источников
1 Губин, С. П. Наночастицы благородных металлов и материалы на их основе / С. П. Губин, Г. Ю. Юрков, Н. А. Катаева. - Москва: - ИОНХ РАН, 2006. - 63 с.
2 Губин, С. П. Магнитные наночастицы: методы получения, строение, свойства / Ю. А. Кокшаров, Г. Б. Хомутов, Г. Ю. Юрков. // Успехи Химии. - 2005. - Т. 74. - № 6. - С. 539-574.
3 Гусев, А. И. Нанокристаллические материалы / А. И. Гусев, А. А. Рампель. - Москва: Физматлит, 2001. - 126 с.
4 Ерофеев, Н. П. Наноструктуры: физическая сущность и варианты применения в медицине / Н. П. Ерофеев, Г. Г. Зегря, Д. Б. Вчерашний // Успехи химии. - 2011. - № 8. - С. 48-53.
5 Петрищев, Н. П. Направленная доставка лекарственных препаратов в поврежденные ткани с использованием наноразмерных частиц / Н. П. Петрищев, М. М. Галагудза, С. М. Минасян, Д. В. Королев // Химическая физика. - 2009. - № 2. - С. 92-98.
6 Дыкман, Л. А. Золотые наночастицы: синтез, свойства, биомедицинское применение / Л. А. Дыкман. - М.: Наука, 2008. - 319 с.
7 Смирнова, Т. С. Строение и функции селезенки / Т. С. Смирнова, О. Д. Ягмуров // Морфология. - 1993. - № 5 - С. 28-35.
8 Бородин, Ю. И. Функциональная морфология иммунной системы / Ю. И. Бородин. - Новосибирск: Наука, 1987. - 315 с.
9 Баранов, В. Н. Современные представления о тонкой структуре селезенки / В. Н. Баранов // Арх. Анат. - 1984. - Т. 57. - № 12. - С. 91-100.
10 Полянский, А. А. Наномедецина будущего: Трансдермальная доставка с использованием наночастиц / А. А. Полянский // Молекула. Взгляд изнутри. - 2008. - № 10. - С. 72-79.
11 Гистология: учебник / под редакцией Э. Г. Улумбекова, Ю. А. Челышева - М.: ГОЭТАР Мед., 2001. - 206 с.
12 Киселевский, Д. Б. Программируемая гибель клеток растений: сигналы, передача сигналов, роль митохондрий и хлоропластов / В. Д. Самуилов, М. В. Гусев // Вестн. Моск. ун-та. - 2006. - № 6. - C. 51-60.
13 Самуилов, В. Д. Программируемая клеточная смерть / В. Д. Самуилов, А. В. Олескин, Е. М. Лагунова // Биохимия. - 2000. - № 5. - С. 129146.
14 Лушников, Е. Ф. Апоптоз клеток: морфология, биологическая роль, механизмы развития / Е. Ф. Лушников, В. М. Загребин // Архив патологии. -1987. - Т. 49. - С. 84-89.
15 Уманский, С. Р. Апоптоз: молекулярные и клеточные механизмы / С. Р. Уманский // Молекулярная биология. - 1996. - Т. 30. - № 3 - С. 487-502.
16 Программированная клеточная гибель / под ред. В. С. Новикова, Санкт-Петербург. Наука, 1996. - 75 с.
17 Ярилин, А. А. Апоптоз и его место в иммунных процессах / А. А. Ярилин // Иммунология. - 1996. - Т. 6. - С. 10-23.
18 Генералов, М. Б. Криохимическая нанотехнология: учеб. пособие для вузов / М. Б. Генералов // - М.: ИКЦ «Академкнига», 2006. - 325 с.
19 Сергеев, Г. Б. Нанохимия / Г. Б. Сергеев - М.: Изд. Московского унта, 2003. - 126 с.
20 Пул, Ч. Нанотехнологии / Ч. Пул, Ф. Оуэнс - М.: Техносфера, 2004. - 132 с.
21 Особенности строения и функциональные свойства наночастиц металлов / под ред. И. П. Арсентьева. - М.: Наука, 2006. - 339 с.
22 Гусев, А. И. Нанокристаллические материалы / А. И. Гусев, А. А. Ремпель - М.: ФИЗМАТЛИТ, 2001. - 224 с.
23 Балабанов, В. И. Нанотехнологии. Наука будущего / В. И. Балабанов - М.: Эксмо, 2009 г. - 256 с.
24 Рыбалкина, М. В. Нанотехнологии для всех. Большое в малом / М. В. Рыбалкина. - 2005. - 84 с.
25 Мальцева, П. П. Нанотехнологии. Наноматериалы. Наносистемная техника / П. П. Мальцева. - М.: Техносфера, 2008. - 432 с.
26 Старостин, В. В. Материалы и методы нанотехнологии: учебное пособие / В. В. Старостин. - М.: Бином. Лаборатория знаний, 2008. - 431 с.
27 Суздалев, И. П. Нанотехнология / И. П. Суздалев - М.: Комкнига, 2006 - 592 с.
28 Артюхов, И. В. Применение нанотехнологий в медицине: состояние на сегодняшний день / И. В. Артюхов, В. Н. Кеменов, С. Б. Нестеров // Биоинформатика и познания. - 2008. - № 9. - С. 86-91.
29 Помогайло, А. Д. Наночастицы металлов в полимерах / А. Д. Помогайло, А. С. Розенберг, И. Е. Уфлянд. - М.: Химия. - 2000. - 144 с.
30 Косбаяси, Н. А. Введение в нанотехнологию / Н. А. Косбаяси. - М.: Бином. Лаборатория знаний, 2007. - 134 с.
31 Шаталова, Н. А. Медицина и фармацевтика в наномире / Н. А. Шаталова // В мире нано. - 2010. - № 4. - С. 21-23.
32 Мильто, И. В. Структура печени, легкого и почек крыс при внутривенном введении магнитолипосом / И. В. Мильто, А. Н. Дзюман // Морфология. - 2009. - Т. 135. - № 3. - С. 63-66.
33 Богословская, О. А. Изучение безопасности введения наночастиц меди с различными физико-химическими характеристиками в организм животных / О. А. Богословская, Е. А. Сизова, В. С. Полякова, С. А. Мирошников, И. О. Лейпунский, И. П. Ольховская, Н. Н. Глущенко // Вестник Оренбургского государственного университета. - 2009. - № 2. - С. 124-127.
34 Вишняков, А. И. Особенности костномозгового кроветворения при введение наночастиц меди per os и intramuscularly / А. И. Вишняков, А. С. Ушаков, С. В. Лебедев // Вестник мясного скотоводства. - 2011. - Т. 2 - № 64. -С. 96-102.
35 Глущенко, Н. Н. Физико-химические закономерности биологического действия высокодисперсных порошков металлов / Н. Н. Глущенко, О. А. Богословская, И. П. Ольховская // Химическая физика. - 2002. - Т. 21 - № 4. - С. 79-85.
36 Жигач, А. Н. Установка для получения и исследования физикохимических свойств наночастиц металлов / А. Н. Жигач, И. О. Лейпунский, М. Л. Кусков, Н. И. Стоенко, В. Б. Сторожев // Приборы и техника эксперимента. -2000. - № 6. - С. 122-129.
37 Рахметова, А. А. Ранозаживляющие свойства наночастиц меди в зависимости от их физико-химических характеристик / А. А. Рахметова, Т. П. Алексеева, О. А. Богословская, И. О. Лейпунский, И. П. Ольховская, А. Н. Жигач, Н. Н. Глущенко // Российские нанотехнологии. - 2010. - Т. 5. - № 3 - 4. - С. 102-107.
38 Сизова, Е. А. Влияние многократного введения наночастиц меди на элементный состав печени крыс / Е. А. Сизова, С. А. Мирошников, С. В. Лебедев, Н. Н. Глущенко // Вестник Оренбургского государственного университета. - 2011. - № 4. - С. 104-110.
39 Мирошникова, Е. П. Биологические особенности и качество продукции кур и карпа при использовании различных энзимсодержащих рационов: автореф. дис.... д-ра биол. наук / Е. П. Мирошникова. - Волгоград, 2006. - 46 с.
40 Воробьев, В. И. Биогеохимия и рыбоводство / В. И. Воробьев. -Саратов: «М. П. Литера», 1993. - 224 с.
41 Алиджанова, И. Э. Влияние стрессорных факторов различной природы на накопление химических элементов в теле лабораторных животных / И. Э. Алиджанова, С. В. Нотова, Е. В. Кияева // Вестник Оренбургского государственного университета. - 2010. - № 12. - С. 18-21.
42 Мелякина, Э. И. Анализ содержания железа и кобальта в органах и тканях щуки (Esox Lucius) / Э. И. Мелякина, О. Н. Бичарева // Вестник Астраханского государственного технического университета. Сер. Рыбное хозяйство. - 2009. - № 2. - С. 67-69.
43 Коваленко, Л. В. Фармакологические свойства ультрадисперсного железа низкотемпературного водородного восстановления / Л. В. Коваленко, Г. В. Павлов, Г. Э. Фолманис // Докл. РАН. - 1998. - Т. 360. - № 4. - С. 571-573.
44 Дерябин, Д. Г. Биологическая активность ионов, нано- и микрочастиц Cu и Fe в тесте ингибирования бактериальной биолюминесценции / Д. Г. Дерябин, Е. С. Алешина, Т. Д. Дерябина, Л. В. Ефремова // Вопросы биологической, медицинской и фармацевтической химии. - 2011. - № 6. - С. 31-36.
45 Амплеева, Л. Е. Физиологическое состояние кроликов при введении в рацион вики, выращенной с использованием ультрадисперсных порошков железа и кобальта: дис.... канд. биол. наук. / Л. Е. Амплеева. Рязань, 2006. -142 с.
46 Богословская, О. А. Изучение безопасности введения наночастиц меди с различными физико-химическими характеристиками в организм животных / О. А. Богословская, Е. А. Сизова, В. С. Полякова, С. А. Мирошников, И. О. Лейпунский, И. П. Ольховская, Н. Н. Глущенко // Вестник Оренбургского государственного университета. - 2009. - № 2. - С. 124-127.
47 Лакин, Г. Ф. Биометрия. / Г. Ф. Лакин. - М.: Высшая школа, 1990. - 352 с.
48 Барабаш, А. А. Особенности межэлементных взаимодействий в организме животных при различной нутриевой обеспеченности / А. А. Барабаш, Е. П. Мирошникова, А. И. Г речушкин, О. Ю. Сипайлова // Вестник Оренбургского государственного университета. - 2008. - № 12. - С. 72-75.
49 Воробьев, В. И. Микроэлементы и их применение в рыбоводстве. / В. И. Воробьев - М.: Пищ. промышленность, 1979. - 184 с.
50 Войнар, А. И. Микроэлементы в живой природе. / А. И. Войнар. - М.: Наука, 1962. - 94 с.
51 Морозов, Н. П. Переходные и тяжелые металлы в промысловой ихтиофауне океанических, морских и пресных вод / Н. П. Морозов, С. А. Петухов // Рыбное хозяйство. - 1977. - № 5. - С. 98-120.
52 Скальный, А. В. Биоэлементы в медицине / А. В. Скальный, И. А. Рудаков. - М.: Издательский дом «ОНИКС 21 век», Мир, 2004. - 272 с.
53 Калетин, Г. И. Влияние дисбаланса микроэлементов на регуляцию апоптоза / Г. И. Калетин // Вестник Оренбургского государственного университета. - 2006. - № 12. - С. 111-113.
54 Генералов, М. Б. Криохимическая нанотехнология: учебное пособие для вузов / М. Б. Генералов. - М.: ИКЦ «Академкнига», 2006. - 325 с.
55 Саленко, Т. П. О топографической анатомии животных / Т. П. Саленко // Ветеринария. - 2001. - № 4. - С. 34-38.
56 Каспарова, И. С. Гистоферментативная характеристика лимфоузлов и селезенки при антигеном воздействии / И. С. Каспарова, А. В. Азнаурян, Э. С. Акопджанян // Журн. Экспер. И клин. Мед. - 1982. - № 1. - С. 15-19.
57 Петров, Р. В. Иммуногенез и клеточная дифференцировка / Р. В. Петров, А. А. Михаилов. - М.: Медицина, 1978. - 205 с.
58 Робинсон, М. В. Апоптоз клеток иммунной системы / М. В. Робинсон, В. А. Труфакин // Успехи совр. биол. - 1991. - Т. 111. - № 2. - С. 246259.
59 Цыпленкова, В. Г. Апоптоз / В. Г. Цыпленкова, Н. Н. Бескровнова // Арх. патол. - 1996. - Т. 58. - № 5. - С. 71-74.
60 Певницкий, Л. А. Программированная гибель клеток и апоптоз: значение для развития и функционирования иммунной системы / Л. А. Певницкий // Вестник РАМН. - 1996. - № 6. - С. 43-50.
Приложение А
(справочное)
Протокол испытаний химического состава
Скачать диплом: