Превращение белков в организме
Биологическое значение белков
В процессе обмена веществ благодаря своему поистине всеобъемлющему участию в жизненно важных процессах белок непрерывно расходуется. Следовательно, для обеспечения важнейших физиологических функций организма человека и животных, их жизнедеятельности необходимо доставлять белок с пищей. Белок является чрезвычайно важной и обязательной составной частью пищи. Для определения его роли в питании существенно также и то, что ни в функциональном отношении, ни как пластический материал белок не может быть заменен другими пищевыми веществами. В то же время белок может в довольно широких пределах замещать собой жиры и углеводы, т. е. идти на синтез этих соединений в организме.
Организм часто испытывает недостаток или дефицит белка. Эксперты Всемирной организации здравоохранения считают, что примерно половина населения земного шара находится в состоянии белкового голодания, а мировая нехватка пищевого белка составляет около 15 млн. т в год. Выраженная белковая недостаточность — явление обычное в слаборазвитых странах. Особенно широко распространена скрытая, т. е. еще не приводящая к болезни, так называемая субклиническая, белковая недостаточность. Она встречается во всех возрастных группах, но чаще всего наблюдается у детей в период грудного вскармливания и первые годы жизни. Заболевание детей вследствие белковой недостаточности получило название квашиоркора, что в переводе с одного из африканских языков означает «отнятый от груди». Причем на каждый случай заболевания приходится около ста случаев скрытой формы белковой недостаточности. Помимо детей, другой чрезвычайно уязвимой группой в отношении нарушений, вызываемых низким потреблением белка, являются беременные женщины и кормящие матери.
Белковая недостаточность чаще всего возникает при общем недостатке пищи. При этом понижается количество белка в крови, понижается осмотическое давление крови, кровь начинает хуже отбирать воду у тканей, возникают так называемые голодные отеки. Дефицит белка на фоне общего недоедания приводит к состоянию, носящему название алиментарной (пищевой) дистрофии.
Различные пищевые вещества содержат неодинаковое количество белка. Его больше всего в мясе, рыбе, сыре, яйцах, сое, орехах, горохе. Большинство других пищевых веществ содержит мало белка. В то же время для организма человека и животных крайне важно достаточное поступление белка. И дело здесь даже не в том, какое количество энергии может получиться при распаде белков. Эту энергию вполне могут компенсировать жиры и углеводы. Важнее другое: недостаточное поступление белка с пищей приводит к серьезным нарушениям в организме, а безбелковое питание неизбежно кончается смертью подопытных животных.
В организме постоянно, хотя и с различной скоростью, происходит обновление и разрушение клеток, внеклеточного вещества и других структурных компонентов, в состав которых входят белки. Это постоянное обновление организма и требует непрерывного поступления белков или аминокислот. Поэтому пластическая роль белков в отличие от энергетической просто незаменима. К тому же, как известно из предыдущих разделов, без белков и аминокислот невозможно обновление таких важных для живого организма веществ, как гормоны и ферменты.
Основная масса азота в пищевых продуктах приходится на белки. Если введенного в организм с пищевыми продуктами азота больше, чем выведенного в виде конечных продуктов, то происходит накопление белков в организме. Это наблюдается в молодом растущем организме, при восстановлении организма после болезни, во время беременности. В случае избыточного выведения азотистых продуктов в сравнении с количеством поступившего азота можно говорить о распаде белков, что происходит при заболевании или белковом голодании.
Важным для организма является не только количество белка, потребляемого с пищей, но и его качество. Например, для компенсации распавшегося в организме белка необходимо, чтобы с пищей поступил 1 г аминокислоты метионина. В одних продуктах такое количество метионина содержится в 50 г белка, в других — в 200 г белка, т. е. биологическая ценность первого белка выше, его требуется меньше для покрытия потребностей организма в метионине. Наиболее нужными для человека являются белки мяса, молока, яиц, картофеля. Некоторые белки имеют полноценный аминокислотный состав, но они плохо расщепляются в пищеварительном тракте. Это белки шерсти, перьев, волос и пр.
Неодинаково значение различных аминокислот в белке. Если исключить некоторые аминокислоты из пищи, то организм «не заметит» их отсутствия, т. е. они могут синтезироваться в организме из других соединений: углеводов, жиров, кетокислот. Недостаток же других аминокислот приводит к нарушению синтеза белка, расстройству нервной системы, болевым явлениям, потере массы и трудоспособности.
К 1915 г. выяснили, что белок зеин, основной белок кукурузы, не способствует росту, и животные погибали, если их кормили только этим белком. Если же к зеину добавлять аминокислоту триптофан, то животные жили гораздо дольше, хотя и этого не было достаточно для их нормального роста. Если же к зеину добавить, помимо триптофана, еще одну аминокислоту — лизин, то животные нормально росли и развивались. Такие эксперименты доказали, что питательная ценность белка зависит от его аминокислотного состава.
Не все аминокислоты, входящие в состав белковой молекулы, являются равноценными. Оказалось, что часть из них не может быть синтезирована в организме человека и они должны обязательно поступать в организм с пищей. Эти аминокислоты принято называть незаменимыми. К ним относятся валин, лейцин, изолейцин, лизин, триптофан, треонин, фенилаланин, метионин. Для детей необходимы также аргинин и гистидин. Следовательно, организму требуются белки, содержащие необходимое количество незаменимых аминокислот. Большинство аминокислот, встречающихся в пищевых белках, могут синтезироваться в теле человека. К ним относятся аланин, гликокол, глутаминовая кислота, серии, тирозин, цистеин и др. Они получили название заменимых. Однако нельзя недооценивать их роли в организме, так как они входят непременными компонентами в состав белков нашего организма. Отсутствие или недостаточность заменимых аминокислот в пище ведет к необходимости их синтеза в организме, причем нужный для этих целей азот черпается в таком случае из незаменимых аминокислот, поступающих с пищей. Наилучшим соотношением заменимых и незаменимых аминокислот для человека отличается белок куриных яиц. Он считается эталонным, т. е. содержит полный достаточный набор аминокислот. В других белках может быть меньшее по сравнению с эталонным относительное количество той или иной незаменимой аминокислоты.
Чаще всего не хватает следующих аминокислот: триптофана, лизина, реже метионина. Поэтому организму требуется эталонного белка меньше всего, а других белков больше. И чем хуже соотношение аминокислот, тем больше требуется белка. Если же в белке не хватает какой-нибудь незаменимой аминокислоты (хотя бы одной), то покрыть потребности организма он не может, сколько бы его ни поступало. Так, нехватка одной незаменимой аминокислоты приведет к тому, что в организме не смогут синтезироваться молекулы белков, в составе которых содержится эта незаменимая аминокислота.
В настоящее время считается, что для взрослого человека нужно в сутки около 115 г белка. Если же использовать белок куриного яйца, то достаточно 40 г, а смеси незаменимых аминокислот—13 г. Зная примерный аминокислотный состав различных пищевых продуктов, специалисты помогают составить диету таким образом, чтобы компенсировать недостаток аминокислот в одних продуктах за счет высокого содержания этих аминокислот в других.
Опыты на животных показали, что при белковом голодании не все органы уменьшают свою массу равномерно. Белки мышц, печени, плазмы крови расходуются при белковом голодании в первую очередь. Эти белки выполняют многообразные жизненные функции, но в критический период голодания они становятся белковыми источ
никами для жизненно наиболее важных органов: мозга, сердца, эндокринных желез. Особенно большим колебаниям в концентрации белка подвержена плазма крови: в случае уменьшения поступления белка с пищей уменьшается и количество белка в крови, при хорошем белковом питании идет быстрое восстановление содержания белка в плазме.
Распад белков в организме до аминокислот
Белки различных органов, тканей и тем более организмов очень отличаются друг от друга по молекулярной массе, аминокислотному составу, заряду, форме макромолекулы и многим другим параметрам. В связи с этим белок одного организма является чужим для другого. Поэтому пищевой белок никогда не используется организмом в нерасщепленном виде. К тому же на чужеродные белки, если они как-то попали в клетку в неизменном виде, выработались бы антитела, иммунитет лишил бы их видовой специфичности, т. е. попытался расщепить. Организм использует для питания клеток не сам белок, а аминокислоты, его составляющие.
Мы уже знаем из предыдущих разделов, что для получения из белка смеси аминокислот необходимо их продолжительно кипятить с кислотами или щелочами. В организме же процесс гидролиза белка идет под действием пищеварительных протеолитических ферментов при невысоких температурах. Все протеолитические ферменты желудочно-кишечного тракта действуют на пептидную связь —СО—NH—, но каждый из ферментов выбирает «свои» связи, образованные определенными аминокислотами. Например, пепсин быстрее разрывает связи между двумя остатками аланина или между аланином и серином, а трипсин «узнает» группы аргинина и лизина.
В отличие от углеводов белки в ротовой полости не подвергаются никаким изменениям, так как слюна не содержит ферментов, расщепляющих белки. Разрушение их начинается в желудке под действием двух мощных фaктopoв: сильно кислой реакции желудочного сока и активного фермента пепсина. pH желудочного сока — 1,5—2,5. Это очень кислая среда, в которой пепсин наиболее активен. Кислотность желудочного сока создает соляная кислота, роль которой многообразна: она стимулирует превращение неактивного пепсиногена в активный пепсин, создает оптимальную концентрацию Н+ для действия пепсина, вызывает денатурацию и набухание белков и предотвращает гниение в желудке.
Превращение неактивного пепсиногена в пепсин, как и в случае с трипсином, происходит при отщеплении части молекул полипептида с молекулярной массой около 7000. Об активности пепсина можно судить по скорости переваривания яичного белка или нитей фибрина. Пепсин разрывает в белке преимущественно внутренние связи, хотя находят и небольшое количество отдельных аминокислот, полученных при гидролизе концевых участков белковой нити. Однако основными продуктами гидролиза белка после обработки пепсином являются крупные обломки белковой молекулы — пептоны. Это все еще высокомолекулярные соединения. Они не всасываются в желудке, а поступают в двенадцатиперстную кишку. Здесь происходит дальнейшее превращение этих веществ под действием кишечного сока, в котором находится несколько разных ферментов: трипсин, химотрипсин, различные пептидазы.
Трипсин, как и пепсин в желудке, выделяется в неактивной форме, затем от него отщепляется небольшой пептид, что делает трипсин активным. Выделение пищеварительных ферментов в неактивной форме имеет очень важное значение: ведь в кишечном соке есть много других белков-ферментов, которые трипсин сразу же переварил бы, если бы он выделялся в активной форме. Трипсин гидролизует тоже не все пептидные связи в белке, а примерно 1/3 общего их количества. Он воздействует также на целые белковые молекулы, которые почему-то не расщепились в желудке.
Химотропсин расщепляет те связи, на которые не действует трипсин, прежде всего связи, образованные тирозином, фенилаланином, триптофаном и метионином. После обработки химотрипсином гидролизоваиными оказываются больше половины пептидных связей. Химотрипсин может воздействовать (как и трипсин) на негидролизованные пепсином белки. Поэтому операция полного удаления желудка не исключает возможности усвоения белков пищи.
Дальнейший распад белков происходит под действием ферментов пептидаз в тонком кишечнике. Они выделяются стенкой кишечника тоже в неактивной форме. Карбоксипептидазы отщепляют аминокислоты от обрывков белковой молекулы с СООН-конца, аминопептидазы — с того конца, где имеется свободная NH2-группа. Дипептидазы расщепляют дипептиды на свободные аминокислоты.
Таким образом, совместное действие группы ферментов в различных отделах желудочно-кишечного тракта приводит к полному распаду белков пищи до свободных аминокислот.
Пути превращения аминокислот
Аминокислоты, образовавшиеся при гидролизе белка в желудке и кишечнике, всасываются через стенки капилляров и попадают в кровь. Ранее считали, что частично могут всасываться и нерасщепленные белки. Эксперименты опровергли эти предположения. Для проверки в кровь вводили чужеродный белок. На него вырабатывались антитела и шли реакции, направленные на уничтожение такого белка. Всасывание белка в кишечнике возможно при приеме большого количества сырого белка (например, яичного белка). При этом белок появляется даже в моче. Но такой опыт сопровождается явлениями отравления, т. е. всасывание белка — ненормальное физиологическое состояние.
Аминокислоты же не только хорошо всасываются, но их можно прямо вводить в кровь. Этот прием используется, когда больной не в состоянии какое-то время нормально питаться, например при операциях на пищеводе. Часть аминокислот не всасывается в кишечнике, а используется там же в качестве питания микроорганизмами, которые всегда населяют кишечник. Микроорганизмы нижних отделов кишечника участвуют в процессе гниения белков. Среди ядовитых продуктов гниения белков можно назвать фенол, который образуется из аминокислоты фенилаланина:
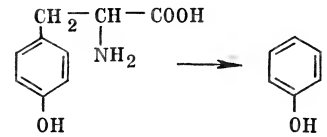
Количество веществ, получающихся из белков при гниении в кишечнике, велико и разнообразно по химическом составу.
Аминокислоты, всосавшиеся в кровь через стенку кишечника, попадают в печень, где они претерпевают различные превращения, а также идут на синтез белка.
Значительная часть аминокислот разносится кровью дальше ко всем органам и тканям. В клетках из них строятся белки, специфические для данной ткани.
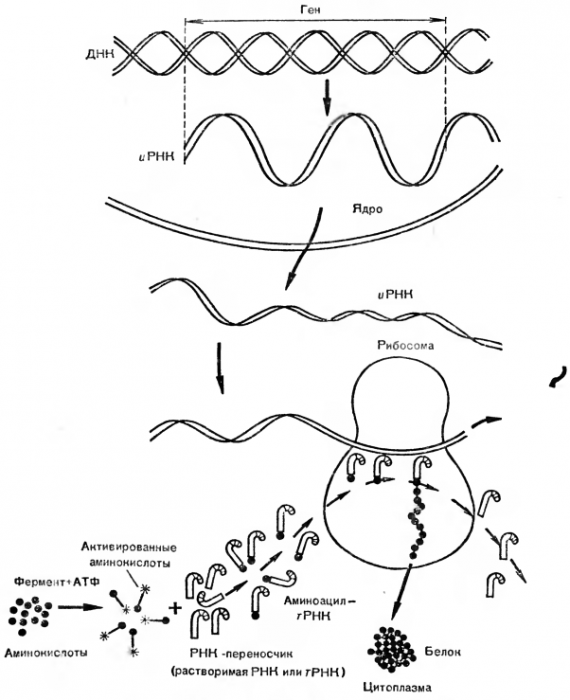
Общая схема путей превращения аминокислот дана на рисунке 1.
Основные реакции, по которым идет распад аминокислот,— декарбоксилирование, дезамирование, переаминирование.
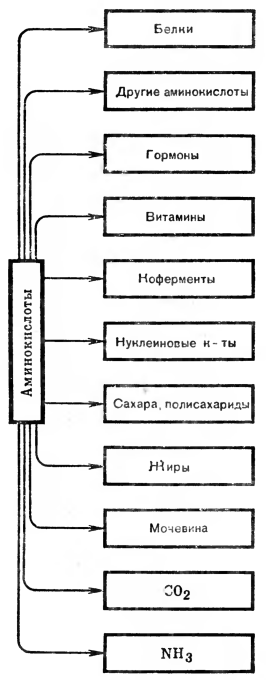
Рис. 1. Пути превращения аминокислот в организме.
Декарбоксилирование, связанное с отщеплением карбоксильной группы от аминокислоты, приводит к образованию аминов:
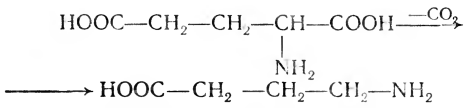
Ферменты, которые катализируют этот процесс, названы декарбоксилазами.
При различных видах дезаминирования получаются кислоты, кетокислоты, гидроксикислоты и отщепляется аммиак.
1. Восстановительное дезаминирование:
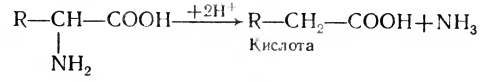
2. Окислительное дезаминирование:
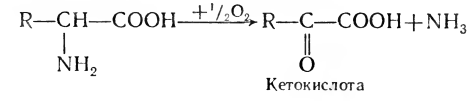
3. Гидролитическое дезаминирование:
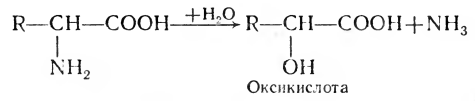
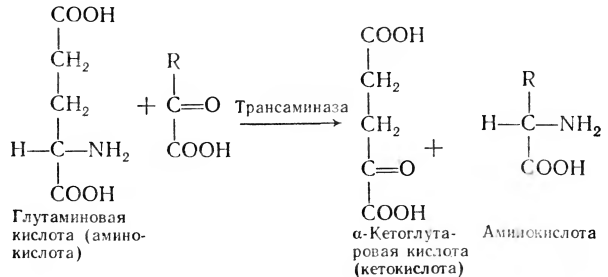
В 1937 г. советские ученые А. Е. Браунштейн и М. Г. Крицман открыли реакцию переаминирования, в результате которой под действием ферментов трансаминаз из одних аминокислот в организме могут быть получены другие аминокислоты путем переноса аминогруппы с аминокислоты на кетокислоту:
В тканях животных есть набор ферментов, расщепляющих белки прямо в клетках. Эти ферменты называют тканевыми протестами. Они наиболее активны в слабокислой среде. По своему действию эти ферменты соответствуют пепсину, трипсину, пептидазам. Многие из них локализованы в лизосомах, субклеточных частицах, которые в клетках отвечают за переваривание белков. Лизосомальные мембраны нестабильны. Под влиянием различных факторов они разрываются, а гидролазы, находящиеся в них, выходят в клетку и аутолизируют ее содержимое.
Та часть аминокислот, которая не была использована организмом для синтеза белка, ферментов, новых аминокислот или гормонов, распадается и выводится из организма. Конечными, продуктами распада аминокислот являются аммиак, оксид углерода (IV), вода, мочевина.
Аммиак образуется из аминсодержащих соединений при дезаминировании. В свободном виде он токсичен, и поэтому организм научился его обезвреживать. Наиболее восприимчивы и чувствительны к аммиаку клетки головного и спинного мозга, а также другие нервные ткани. В нормальных (неповрежденных) клетках за обезвреживание аммиака в какой-то степени отвечают прежде всего глутаминовая и аспарагиновая аминокислоты, имеющие по две карбоксильные группы. Они поглощают аммиак и образуют безвредные амиды. Этот путь обезвреживания NH3 особенно важен для растений:
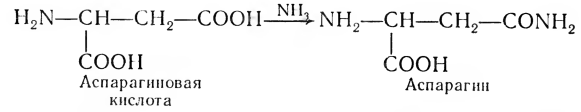
У человека и высших млекопитающих распад аминокислот идет через ряд реакций, и из аммиака и оксида углерода (IV) в несколько стадий с участием АТФ синтезируется мочевина:
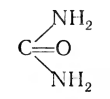
Это конечный продукт, выделяющий аммиак в безвредной форме с мочой.
Беглый обзор путей превращения аминокислот был бы неполным, если, рассказав об основных путях распада, не остановиться на синтезе аминокислот в клетках. Как мы уже говорили, синтезироваться могут не все, а только заменимые аминокислоты. У растений же все аминокислоты могут синтезироваться из аммиака, нитратов и оксида углерода (IV).
Один из путей синтеза новых аминокислот мы уже приводили — это переаминирование. Другой путь — прямое аминирование кетокислот. Углеродный скелет для таких аминокислот чаще всего берется из продуктов неполного распада углеводов или жирных кислот. Например, аминокислота аланин легко получается из продукта углеводного обмена — пировиноградной кислоты:
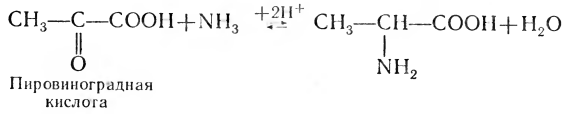
Как видно из этого примера, нельзя проводить резкие границы между обменами аминокислот, жиров и углеводов. Продукты распада одного класса веществ могут служить иcходным материалом для синтеза другой группы соединений.
Еще один путь внутриклеточного синтеза аминокислот у человека и животных — превращение незаменимых аминокислот в заменимые. Например, гликокол может образоваться из треонина и серина. Этот путь подтвержден опытами с использованием меченых атомов.
Строго говоря, незаменимые аминокислоты тоже в какой-то степени могут образовываться. Но это лишь в том случае, если в организме есть соответствующие им кетокислоты. Тогда из них путем прямого аминирования могли бы получиться аминокислоты. Таких соединений в клетке мало, к тому же они чаще всего образуются из незаменимых аминокислот.
Биосинтез белка в клетке
Механизмы внутриклеточного связывания аминокислот в белки были выяснены только после того, как в области синтеза белка применили метод меченых атомов. До этого считалось, что в клетке сначала синтезируются короткие пептиды, которые затем каким-то образом связываются между собой в длинные полипептиды. Современными методами установили, что все белки обновляются с разной скоростью. Белки органов и тканей с высоким уровнем, обмена веществ, например печень, обновляются за несколько дней, белки волос, рогов, ногтей — в несколько месяцев. Ученые выяснили основные этапы синтеза белка и компоненты, необходимые для осуществления этого процесса. Определили, что включение аминокислот в белок и синтез макромолекулы осуществляется в клетке за несколько секунд. На искусственный синтез даже самого простого белка в лаборатории уходят многие месяцы кропотливой работы.
Как же осуществляется синтез? Какие вещества необходимы для проведения всех его стадий? Откуда берется энергия для этого химического процесса?
Исследователи предположили, что высокая скорость синтеза белка может быть обеспечена наличием шаблона или модели (матрицы), с которой считывается информация. Большая точность воспроизводства совершенно одинаковых молекул любого белка тоже подтверждает гипотезу существования матрицы. В настоящее время последовательность основных этапов логической цепи белкового синтеза известна. Четко доказана роль ДНК (дезоксирибонуклеиновой кислоты): если разрушить ДНК в клеточном ядре, то синтез белка прекратится. В других опытах ДНК из одного штамма микроорганизмов, внедренная в клетки другого штамма, вынуждает его синтезировать некоторые белки, характерные только для первого. Значит, в ДНК заложена информация о специфических белках, которые могут синтезироваться в новых клетках по «старой» ДНК. Это только один из многих примеров, подтверждающих роль ДНК в хранении информации для синтеза совершенно определенных белков. Классическим примером является поражение бактериальной клетки вирусом. Вирус прикрепляется к оболочке бактерии и впрыскивает внутрь ее свою ДНК. В клетке бактерии начинается синтез чужих вирусных белков. Считывание информации о синтезе необходимого клетке белка начинается с расплетения на определенном участке двойной спирали ДНК. Напомним, что ДНК представляет собой две цепочки, построенные из нуклеотидов, состоящих из трех компонентов: азотсодержащего основания, дезоксирибозы, фосфорной кислоты. Например, адениловый нуклеотид выглядит так:
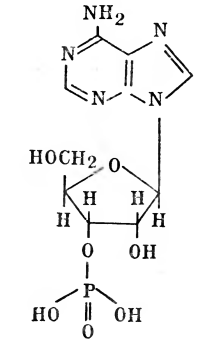
Такие трехкомпонентные нуклеотиды являются мономерами одной нити ДНК. Они упакованы друг над другом в виде столбика из монет. Параллельно первой нити в ДНК имеется другая, отличающаяся азотистыми основаниями. Между двумя такими нитями устанавливаются водородные связи, которые и поддерживают всю молекулу ДНК в двунитчатом спирализованном состоянии.
Важную роль в синтезе белка играют различные типы уже упоминавшихся нами РНК. Например, крупная информационная (матричная) РНК (иРНК) имеет относительную молекулярную массу 1 млн. Предполагается, что каждая иРНК соответствует одному белку. Это значит, что клетка, содержащая 2500 различных белков, должна иметь столько же разновидностей иРНК, а каждая из них — тысячи нуклеотидов, чтобы «записать» информацию о составе белка, который на ’ней должен быть синтезирован.
Другой тип рибонуклеиновых кислот — транспортные (тРНК). Они отличаются от информационных прежде всего низкой молекулярной массой (30 000—35 000). Транспортные нуклеиновые кислоты не связаны с белками. Они находятся в растворимой части клеток в свободном виде и потому нередко называются еще растворимыми. Считают, что видов тРНК не меньше, чем разновидностей аминокислот, т. е. каждая аминокислота имеет свою тРНК. Для прикрепления аминокислоты в тРНК имеется определенный участок (рис. 2). Доказано, что все тРНК построены однотипно, имеют и другие характерные участки и напоминают по форме кленовый лист.
Около 90 % всех РНК содержится в рибосомах. Их так и называют — рибосомальные РНК. Они наиболее высокомолекулярны (около 2 млн.), всегда связаны с белками. Тело рибосомы состоит из комплекса РНК+белок, а сама рибосома по форме представляет собой грибовидное образование, состоящее из двух субъединиц: шляпки и ножки разной массы.
Каким же образом взаимодействуют между собой РНК в системе синтеза белка? Роль их доказана такими же убедительными опытами, как и для ДНК. Если РНК обработать ферментом рибонуклеазой, т. е. разрушить ее, то синтез белка в клетке прекращается. Если рибосомы обработать рибонуклеазой, то синтез белка в таких рибосомах тоже не идет. Это же подтверждается исследованиями, проведенными на вирусах. Многие вирусы содержат не ДНК, а РНК, окруженную белковой оболочкой — капсулой. Известно, что при внедрении такого вируса в клетку идет синтез белка, заданный вирусной РНК. Если извлечь РНК из вируса, обработать ее химическими методами и изменить нуклеотидный состав, а затем измененную РНК ввести в клетку, то изменится и аминокислотный состав белка, синтезируемого в клетке. Этот изящный, но достаточно трудоемкий опыт доказывает неопровержимо, что РНК каким-то образом диктует, какой белок и какого состава должен синтезироваться в данный момент в клетке.
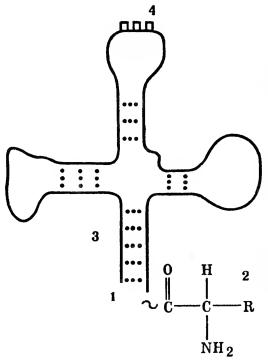
Рис. 2. Структура транспортных РНК: 1 — участок РНК, связывающий аминокислоту; 2 — аминокислота; 3 — участки двойной спирализации РНК; 4 — антикодон (участок РНК, соответствующий определенному участку информационной РНК— кодону).
В настоящее время выяснено, что ДНК в ядре клетки расплетается на значительном участке и получаются две одиночные цепи. На одной из этих расплетенных цепей из нуклеотидов, имеющихся в растворимой части клетки, синтезируется полинуклеотидная цепь. Она полностью считывает информацию с одиночной нити ДНК и образует при участии фермента полимеразы иРНК, т. е. РНК, считавшую информацию с ДНК. После синтеза иРНК освобождается от ДНК и выходит из ядра в цитоплазму — растворимую часть клетки.
В настоящее время механизм синтеза белка представляют следующим образом. Аминокислогы, растворенные в клеточном содержимом, вовлекаются в синтез белка не прямо, а после предварительной активации. Активация заключается в том, что к карбоксильной группе аминокислоты присоединяется АТФ. Теперь аминокислота способна преодолеть энергетический барьер в процессе синтеза белка, т. е. она переходит на более высокий энергетический уровень. Запасенной энергии будет достаточно для образования пептидной связи. Активация идет при обязательном участии активирующих ферментов — синтетаз, индивидуальных для каждой аминокислоты.
Следующий этап синтеза белка — взаимодействие активированной аминокислоты с растворенными в цитоплазме тРНК. В каждой из них есть участки, которые «узнают» свою аминокислоту. Например, тРНК, которая переносит валин, может столкнуться с активированным аланином, или метионином, или еще какой-то аминокислотой, но результативного взаимодействия не получится. Это объясняется не только специфическим отношением РНК именно к валику, но и существованием отдельных ферментов, катализирующих перенос определенной активированной аминокислоты на определенную тРНК. Таким образом, на 20 разновидностей аминокислот необходимо не менее 20 различных транспортных РНК и 20 специфических ферментов.
Далее было установлено, что, несмотря на различные нуклеотиды в составе тРНК, за прикрепление к активированной аминокислоте отвечает один и тот же триплет (три нуклеотида): цитозин — цитозин — аденозин, соединенные через остатки фосфорной кислоты. Этот концевой участок (ЦЦА) обнаружен у всех тРНК. Отщепление его от рибонуклеиновой кислоты делает прикрепление активированной молекулы аминокислоты к тРНК невозможным. Свойство же различать именно свою аминокислоту зависит от других участков молекул РНК.
Следующий этап синтеза белка — перенос тРНК с прикрепленной к ней активной аминокислотой на рибосомы. Рибосомы считаются основным местом синтеза белка в клетке. Эти частицы, состоящие из двух субъединиц, могут диссоциировать в клетке на тяжелую и легкую субъединицы и соединяться вновь вместе. Часто рибосомы образуют агрегаты из двух, трех и более рибосом. Полимеры, образованные многими рибосомами, назвали тяжелыми рибосомами, или полисомами. Если в клетке снизить концентрацию ионов Mg22+, то рибосомы начинают распадаться на субъединицы, а если концентрацию этих ионов увеличить, то рибосомы начинают объединяться в пары. Ученые выделили рибосомы из клеток различных органов и тканей животного и растительного происхождения. Найдены рибосомы и в клетках бактерий. В основном в клетке рибосомы локализованы в цитоплазме, но их находят и в митохондриях, и в ядрах, и в пластидах, и в других субклеточных структурах. Такая универсальная распространенность рибосом подтверждает их жизненно важную биологическую функцию — синтез белка. Процессы синтеза белка идут и в ядре, где необходимы специфические ядерные белки, и в митохондриях, где можно найти много белков-ферментов. Если выделить рибосомы в тот момент, когда в них идет синтез белка, то можно обнаружить, что полипептидная нить синтезируемого белка связана с рибосомой до тех пор, пока к полипептиду не присоединится последняя аминокислота. Тогда вновь образованный белок освобождается от рибосомы, синтез одной нити закончен и рибосома готова начать синтез следующей полипепгидной цепи.
Каков же механизм самого процесса синтеза белка? иРНК, которая была синтезирована в ядре на ДНК как на матрице, несет всю закодированную в нуклеотидной последовательности информацию из ядра в цитоплазму, а точнее к рибосоме (рис. 3). Чтобы начался синтез белка в рибосоме, необходимо несколько условий, главные из которых таковы: рибосома должна присоединиться к иPHK; в окружающей среде должны быть РНК, связанные с активными аминокислотами; в растворе должны быть ионы Mg2+ и некоторые другие ионы (К+, NH4+) и определенные белки-ферменты.
Рис. 3. Схема биологического синтеза белка.
иРНК как лента транспортера или магнитофонная лента протаскивается через рибосому или полисомы. Каждые три нуклеотида на мРНК соответствуют присоединению одной аминокислоты; например триплет, состоящий из трех цитозинов (ЦЦЦ), кодирует включение в белковую цепь аминокислоты пролина. А на тРНК, несущей к месту синтеза белка аминокислоту пролин, есть участок — антикодон, который «узнает» свое место в иРНК, т. е. триплет ЦЦЦ. После отдачи аминокислоты тРНК освобождается из рибосомы, оторвавшись от иРНК, готова опять связаться с пролином, находящимся в цитоплазме, и нести его в рибосому, дожидаясь нового участка иРНК, кодирующего пролин, т. е. ЦЦЦ.
В каждый момент времени в рибосоме, синтезирующей белок, находятся две молекулы тРНК: одна только что вошла в рибосому и прикрепилась своим антикодоном к кодону (иРНК), зашифровавшему очередную аминокислоту, вторая тРНК пришла раньше первой и уже перебросила принесенную ею аминокислоту на растущую полипептидную цепь. При этом какой-то механизм (сравните с зубчатой шестеренкой) протянет иРНК на один триплет через рибосому, что приведет к освобождению предыдущей тРНК и выходу ее из рибосомы, а аминокислота, принесенная второй тРНК, приблизится к недостроенному белку, и установится пептидная связь за счет запасенной ранее от АТФ энергии. В иРНК есть кодоны, которые не кодируют какую-то определенную аминокислоту, а сообщают о конце синтеза белка. Получив такую информацию, рибосома прекращает синтез, и белок готов для выполнения предназначенной ему функции. Следовательно, в основные стадии синтеза белка в клетках на рибосомах входят: а) активирование аминокислот с помощью АТФ и специальных ферментов; б) связывание активных аминокислот с тРНК; в) перенос активных аминокислот на иРНК в рибосому к месту синтеза белка; г) синтез пептидных связей в рибосоме и удлинение полипептидной цепи еще на одну аминокислоту; д) отрыв готовой полипептидной цепи от рибосомы и формирование третичной структуры белка.
Рассказ о синтезе белка занимает гораздо больше времени, чем идет сам процесс. Если проследить за синтезом молекулы гемоглобина, то окажется, что все стадии от активации аминокислот до получения молекулы гемоглобина длятся около полутора минут. А если представить себе, сколько ферментов, гормонов белковой природы, структурных белков и полипептидов необходимо синтезировать в одно и то же время, то не может не удивить быстрота, слаженность и четкость прохождения сложнейших внутриклеточных реакций.
Интересно, что если исследователи вместо природной иРНК давали в систему синтеза белка синтетическую полинуклеотидную нить, то рибосома все равно синтезировала пептидную цепь по такой матрице. Этот факт подтверждает, что основные наши представления о пути синтеза белка в клетке соответствуют действительности.
Рассмотренная схема синтеза белка называется матричной потому, что безошибочное воспроизведение информации о первичной структуре белка происходит в клетке, как копирование текста с заготовленного заранее шаблона — матрицы. А локализация синтеза белка в рибосоме дала процессу другое название — рибосомальный синтез.
Наряду с общепризнанным путем синтеза белка доказано существование другого механизма синтеза, не связанного с нуклеиновыми кислотами,— мультиферментный путь. Принцип этой схемы состоит в следующем. В присутствии АТФ, ионов Mg2+ и набора аминокислот происходит активирование необходимых аминокислот — образование их аминоациладенилатов:
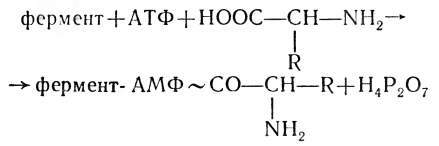
Образование пептидной связи между двумя очередными аминокислотами осуществляется комплексом, состоящим из нескольких ферментов,— мультиферментным комплексом. В переносе аминоацильных групп большую роль играют SH-группы ферментных субъединиц. Так синтезируются, например, антибиотики грамицидин, тироцидин, микобациллин, представляющие собой небольшие полипептиды. Так как мультиферментный путь синтеза белка в бактериях сосуществует с рибосомальным путем, считается, что в эволюции сначала был только мультиферментный механизм сборки полипептидов. Ф. Липман предложил объединить элементы матричного и мультиферментного пути синтеза белка в единую теорию.
Проблема получения пищевого белка
В настоящее время основным источником белка в питании населения земного шара являются зерновые продукты, и прежде всего пшеница, рис, кукуруза, за счет которых получается около 40 млн. т белка в год. 12 млн. т белка поступает за счет бобовых культур и 25 млн. т за счет животных белков. Но данного количества (77 млн. т) недостаточно для удовлетворения потребности населения в белке. Следовательно, проблему белкового питания, как и питания в целом, нельзя считать решенной. Особую остроту она имеет в отсталых и развивающихся странах Африки, Азии и Латинской Америки. Однако дефицит питания, иногда граничащий с голоданием, существует среди необеспеченных слоев населения и в таких экономически развитых странах, как Англия и США.
Основной путь решения данной проблемы — развитие сельского хозяйства на высокой научной и технической основе, использование земель, не вовлеченных в процесс сельскохозяйственного производства, повышение урожайности, интенсификация и рационализация всех отраслей сельского хозяйства. Равным образом необходимо развитие отраслей промышленности, связанных с переработкой пищевых продуктов, их хранением и транспортировкой. Важное значение при этом приобретает реализация научных достижений, полученных в разных областях науки. Некоторые из них, например промышленное производство белка и других питательных веществ, открывают новые перспективы, дающие основания надеяться на радикальное решение извечной задачи человечества — обеспечение достаточным и рациональным питанием.
Хотя основным поставщиком белка в настоящее время являются зерновые, известно, что в качественном отношении белки, содержащиеся в них, значительно уступают белкам животного происхождения. Они довольно далеки по составу незаменимых аминокислот от идеала, т. е. от белка, принятого за эталон. Высокая биологическая ценность животных белков, сочетающаяся с лучшим вкусом, стимулирует развитие животноводческой отрасли сельского хозяйства. Меры к этому принимаются в большинстве стран мира, а доля продуктов этой отрасли в пищевом балансе постепенно повышается. Однако следует учитывать такой экономический фактор, как высокая себестоимость производства большинства продуктов животноводства: мяса, яиц и пр., что создает трудности для быстрого развития этой отрасли сельского хозяйства. Большая питательная ценность белков животного происхождения и их дефицитность диктуют необходимость особо бережного к ним отношения и рационального использования.
Большие потенциальные возможности получения белков высокого качества заключены в промысле рыб и других обитателей морей и океанов. В большинстве стран в годовом рыбном рационе одного человека содержится пока только не более 2 кг белка.
Биологическая неполноценность белков зерновых продуктов выдвинула важную научно-практическую задачу — разработку способов исправления их аминокислотного состава. Улучшение зерновых белков, доведение их качества по аминокислотному составу до уровня белков животного происхождения открыли бы возможности тем же количеством продуктов удовлетворить потребность гораздо большего числа людей. Можно сразу сказать, что решение подобной задачи при современном уровне наших знаний возможно не только в научном аспекте, но и в практическом. Несколько путей ведут к практической реализации этих задач. Так, исследования, проведенные по анализу биологической ценности различных растительных белков, показали высокую ценность белков ржи, риса, овса, гречихи. Использование этих и подобных им растений является одним из способов решения задач улучшения белкового питания.
Другой важный путь, ведущий к этой цели, заключается в селекции и выведении сортов растений с наилучшим аминокислотным составом белков. Эта задача вполне реальна, так как среди имеющихся сортов растений, например пшеницы, есть сорта, белки которых лучше сбалансированы по составу аминокислот по сравнению с другими. К настоящему времени выведены сорта кукурузы, чрезвычайно богатые триптофаном и лизином, а также сорта высоколизиновой пшеницы. Есть все основания полагать, что агрохимики могут вывести и внедрить сорта с лучшим соотношением аминокислот, т. е. с более высококачественным белком, учитывая, что на аминокислотый состав растительных белков влияют условия выращивания: почва, удобрения, количество осадков и т. д.
Улучшение качества белка хлебных изделий возможно за счет добавки при их выпечке отходов молочной промышленности или их обогащения дефицитными аминокислотами.
В настоящее время из отходов нефтяной промышленности производится синтез микробного белка, который используется на корм скоту, что значительно снижает себестоимость продуктов животноводства. Бурный прогресс химической науки позволил осуществить дешевый синтез лизина. В настоящее время химики работают над разработкой дешевого способа производства триптофана. Для производства различных аминокислот, в том числе и незаменимых, широко применяется метод их микробиологического синтеза, для которого выводятся специальные штаммы микроорганизмов, усиленно синтезирующие ту или иную аминокислоту.
Скачать реферат:
Пароль на архив: privetstudent.com