Роль белков в организме
Функции белков в организме разнообразны. Они в значительной мере обусловлены сложностью и разнообразием форм и состава самих белков.
Одной из важнейших функций белковых молекул является пластическая. Белки — незаменимый строительный материал. Все клеточные мембраны и мембраны субклеточных структур содержат белок, роль которого здесь многообразна. Количество белка в мембранах составляет более половины массы. Это различные по составу белки, которые могут быть разделены электрофорезом или другими методами. Белки мембран трудновыделимы потому, что при нейтральных значениях pH они нерастворимы в воде. Их молекулярные массы колеблются в пределах от 23 000 до 60 000. Из большого разнообразия структурных белков, кроме уже упомянутых мембранных, приведем несколько примеров, часть из которых, может быть, уже знакома читателю: а-кератины являются структурными компонентами кожи, перьев, копыт; коллаген входит в состав соединительной ткани и составляет основу сухожилий, хрящей; фиброин — обязательный компонент шелка; эластин входит в структуру эластичной соединительной ткани — связок. Но, пожалуй, самую большую группу структурных белков составляют ферменты с каталитической функцией. Их описанию и роли посвящен отдельный раздел.
Многие белки обладают сократительной функцией. Это прежде всего белки актин и миозин, входящие в мышечные волокна высших организмов (у простейших сократительную функцию выполняет белок динеин). Мышечные волокна — миофибриллы — представляют собой длинные тонкие нити, состоящие из многочисленных параллельных более тонких мышечных нитей, окруженных внутриклеточной жидкостью. В ней растворены аденозинтрифосфорная кислота (АТФ), необходимая для осуществления сокращения, гликоген — питательное вещество, неорганические соли и многие другие вещества, в частности кальций.
Электрический импульс, возникший в двигательном нерве, вызывает резкое увеличение проницаемости мембран, освобождает ионы кальция. Катионы Са2+ активируют распад АТФ, которая служит непосредственным источником энергии для функции сократительных белков. Акт мышечного сокращения заключается в следующем: актин и миозин в мышечных волокнах расположены параллельно и только частично перекрываются в состоянии покоя. При сокращении происходит более глубокое проникновение актина в миозин, т. е. скольжение нитей одного белка вдоль другого, без изменения их собственной длины (рис. 1). Правильность такой схемы мышечного сокращения подтверждена электронно-микроскопическими наблюдениями и экспериментально. Для этого искусственные актомиозиновые нити помещали в чистую воду. Белок приобретал консистенцию рыхлого геля. Если же к этому раствору добавляли раствор соли кальция и АТФ, то белок резко сжимался. Ученые подсчитали, что сила мышечного сокращения составляет 3,5 кг на 1 см2 поперечного сечения мышцы.
Велика роль белков в транспорте веществ в организме. Имея различные функциональные группы и сложное строение макромолекулы, белки связывают и переносят с током крови многие соединения. Это прежде всего гемоглобин, переносящий кислород из легких к клеткам. У некоторых беспозвоночных такую же роль играет сходный по действию белок гемоцианин. В мышцах эту функцию берет на себя еще один транспортный белок — миоглобин. Белки сыворотки крови — альбумины — способствуют переносу жирных кислот, а p-липопротеид переносит липиды. Металлопротеиды содержат железо (глобулин, гемоглобин), медь (церуплазмин). Железо необходимо организму для роста, кровеснабжения. Всего в организме человека около 2,5 г железа, а суточная его потребность составляет 1—2 мг.
Депонируется, т. е. откладывается про запас, железо в селезенке в виде комплекса с белком ферритином. И это свидетельствует еще об одной функции белка — запасной. Интересно, что при постоянном распаде гемоглобина железо не выводится из организма, а сохраняется в виде ферритина. Железа в ферритине может содержаться огромное количество — до 23 %. По мере надобности для синтеза нового гемоглобина железо берется из этого своеобразного депо.
Кроме ферритина, к запасным белкам относят овальбумин — белок яйца, казеин — белок молока, зеин — белок семян кукурузы и некоторые другие растительные белки.
Важная роль принадлежит белкам-гормонам. Значение этой регуляторной функции белков трудно переоценить. Гормоны — это биологически активные вещества, которые оказывают влияние на обмен веществ. Гормоны выделяются в ничтожно малых количествах, но их действия всегда точно направлены и высокоэффективны.
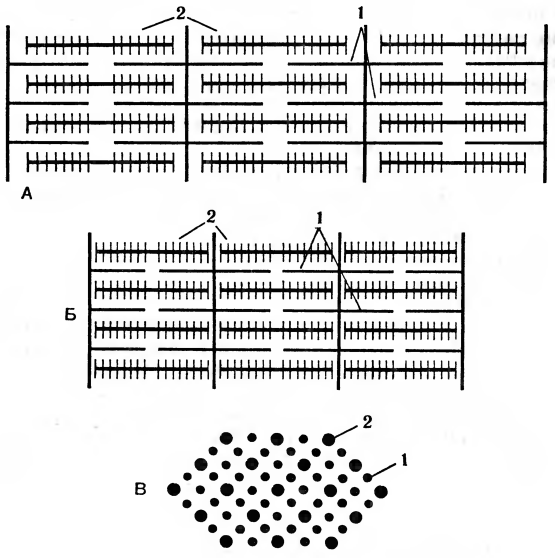
Рис. 1. Схема строения мышцы: А — растяжение (расслабление); Б — сокращение; В—поперечный разрез; 1 — актин, 2 — миозин.
Действие гормонов может осуществляться различными путями: они или влияют на активность ферментов, тем самым ускоряя или замедляя обменные процессы, или изменяют проницаемость мембран для тех или иных веществ, или регулируют скорости синтеза ферментов. Гормоны поддерживают постоянные концентрации веществ в крови и клетках, участвуют в росте, размножении и других жизненно важных процессах.
Многие гормоны являются белками, полипептидами или отдельными аминокислотами. Их выделяют в кровь специальные (эндокринные) железы: гипофиз, щитовидная железа, поджелудочная железа, надпочечники, эпифиз.
Одним из наиболее известных белков-гормонов является инсулин. Этот простой белок состоит только из аминокислот. Его первичная и другие структуры расшифрованы и хорошо изучены. Функциональная роль инсулина многопланова. Он снижает содержание сахара в крови путем повышения проницаемости клеточных мембран для глюкозы, т. е. способствует ее переходу из крови в клетку. В связи с нормальной работой инсулина уровень сахара в крови поддерживается постоянным. При недостатке инсулина содержание сахара в крови увеличивается, сахар выделяется с мочой — развивается сахарный диабет. У инсулина есть и другие функции: он способствует синтезу гликогена в печени и мышцах, увеличивает образование жиров из углеводов, активирует фермент глюкокиназу, влияет на обмен фосфора, обогащает клетки калием.
Кроме инсулина, регуляторной функцией обладают белковые гормоны гипофиза — железы внутренней секреции, связанной с одним из отделов головного мозга. Эта совсем небольшая гороховидная железа выделяет сразу несколько гормонов белковой или полипептидной природы. Некоторые из них оказывают воздействие не на органы и ткани живого организма, а на другие эндокринные железы, заставляя их работать интенсивнее или ограничивая их функцию. Гипофиз выделяет гормон роста, при отсутствии которого развивается карликовость. Введение его опытным животным в больших дозах приводит к значительному увеличению массы. Этот гормон представляет собой белок с молекулярной массой от 27 000 до 46 000 в зависимости от того, из какого животного он выделен. Избыточная секреция этого гормона у людей может привести к увеличению роста до 2,5 м, массы тела — до 150 кг. Наблюдается усиленный рост пальцев, носа, языка, нижней челюсти. Такое заболевание носит название акромегалии, что в переводе с греческого языка означает «большая конечность».
Средняя доля гипофиза выделяет еще один гормон — интермедии, представляющий собой полипептид. Он регулирует пигментацию. У лягушек и некоторых рыб выделение интермедина приводит к изменению пигментных клеток кожи, отвечающих за приспособление окраски тела к окраске окружающей среды. Следовательно, для некоторых организмов достаточное или недостаточное количество этого гормона — вопрос жизни или смерти.
Одним из важных и интересных в химическом отношении гормонов является вазопрессин. Он подавляет мочеобразование и повышает кровяное давление. Это октапептид циклического строения с боковой цепью:
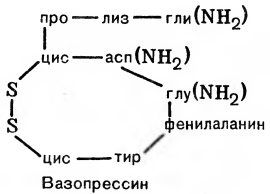
В зависимости от вида животного в структуре молекулы может быть заменена одна аминокислота на другую.
Гипофиз выделяет и другие гормоны, представляющие собой простые или сложные белки, а также пептиды.
Регуляторную функцию выполняют и белки, содержащиеся в щитовидной железе — тиреоглобулины, молекулярная масса которых около 600 000. Эти белки содержат в своем составе иод. При недоразвитии железы нарушается обмен веществ. В некоторых местностях, где пища и вода бедны иодом, возникала болезнь — эндемический зоб: щитовидная железа разрасталась, ее ткань пыталась вылавливать из поступающих продуктов иод. В настоящее время в таких местностях к питьевой воде добавляют иод, а к поваренной соли — иодид калия.
Перечисление гормонов белковой или пептидной природы можно было бы продолжить. Они играют большую роль в регуляции углеводного, жирового и других видов обмена. Без них невозможны сбалансированные химические процессы организма, да и сама жизнь.
Описание функций белков и их роли в живом организме было бы далеко не полным, если не остановиться: на защитной функции белка. Давно известно, что жизненно важные органы и ткани покрыты плотным жировым слоем. Жир обладает свойством теплоизолятора, защитника от механических повреждений органа, питательного вещества, аккумулировавшего большую энергию. Оказалось, что в ряде случаев на уровне клетки сходными функциями наделен белок. Известно, что нуклеиновая кислота вирусной частицы окружена плотной белковой оболочкой. Функции этого белка многообразны, но защита генетического материала вирусной частицы от повреждений, мутаций, действия ферментов — одна из самых главных. Белок окружает вирусную нуклеиновую кислоту до тех пор, пока она не проникнет в клетку. После этого в защитной роли белка уже нет необходимости.
Интересна роль белков и в других нуклеопротеидах — комплексах нуклеиновых кислот с белками. С ДНК в хромосомах связаны гистоны — сильноосновные белки, имеющие молекулярные массы от 10 000 до 21 000 и положительный заряд. Это делает комплекс ДНК с белком особенно прочным.
В последнее время наши представления о защитной роли белков существенно расширились, и отрасль знаний, изучающая защитную реакцию организма от всего чужеродного, названа иммунологией.
Человек, перенесший оспу, приобретает иммунитет, т. е. он не заболевает оспой до конца своей жизни. Это происходит потому, что в организме на вирус оспы выработались специальные белки — антитела, способные защитить организм именно от этого заболевания. Антитела представляют собой белки с защитными функциями, относящиеся к фракции у-глобулинов сыворотки крови.
А чужеродные белки, вирусы или полисахариды, вызывающие при попадании в организм образование антител, называют антигенами. Люди научились стимулировать образование антител для защиты организма от возможных инфекций. Для этого в кровь вводят ослабленные или мертвые культуры болезнетворного начала, т. е. делают прививки. Иммунологическая защита, видимо, возникла в эволюции относительно недавно, так как она имеется только у позвоночных.
Наличие иммунитета, защищающего организм от чужеродных молекул, иногда является препятствием для медицины. Врачи не могут вводить целый ряд препаратов потому, что в желудочно-кишечном тракте они переварятся и потеряют свои лечебные свойства, а вводить их прямо в кровь нельзя, так как на эти лекарственные вещества вырабатываются антитела, т. е. они являются антигенами. Нежелательно образование антител и при пересадке органов. Ведь пересаженный орган состоит из чужеродных молекул, на которые начинают вырабатываться белки — антитела, что приводит к отторжению этого органа. Для борьбы с этим явлением разрабатываются специальные вещества, подавляющие Иммунитет,— иммунодепрессанты.
Антитела имеют молекулярную массу около 150 000 и состоят из четырех субъединиц, т. е. четырех полипептидных цепей. В них есть особые специфические участки, способные к связыванию с антигеном, с какими-то структурными его группировками. Антитела высокоспецифичны в отношении чужеродных веществ. Они не образуют комплекс антиген — антитело с другими белками. Даже одинаковые в функциональном отношении и очень близкие по молекулярной массе и особенностям структуры белки, например гемоглобины разных животных, не идентичны в иммунологическом отношении. Например, антитела, выработанные на введение гемоглобина лошади, не образуют или образуют в значительно меньшей степени комплексы с гемоглобинами других позвоночных. При этом степень связывания антигена с антителом выше у родственных видов, в нашем примере — с гемоглобинами зебры, коровы, но не с гемоглобинами птиц или грызунов.
Сегодня уровень образования антител определяется у больных для уточнения диагноза заболевания и назначения целенаправленного лечения.
Для некоторых белков характерна токсинная функция. Токсические белки обнаружены в яде змей, насекомых, в растениях, у микроорганизмов. Наиболее изучены белковые токсины ядов азиатской, лесной, африканской, индийской, египетской и других змей. Они, как правило, состоят из 60 аминокислотных остатков и имеют массу около 7000.
Токсины скорпиона похожи на них по аминокислотному составу и массе. Они, как и токсины змей, являются нейротоксинами, т. е. препятствуют передаче нервного импульса, взаимодействуя со специфическими белками нервной ткани.
При сравнительном рассмотрении разных токсических белков выяснилось их общее свойство — наличие многих дисульфидных мостиков в третичной структуре молекулы. Но есть и токсины, молекулярные массы, аминокислотный состав и третичная структура которых существенно отличаются от перечисленных. Это дифтерийный, столбнячный, холерный и другие белковые токсины. Например, токсин ботулизма имеет массу около 150 000. Было установлено, что, несмотря на большую молекулярную массу этих белков, токсическими свойствами обладают сравнительно небольшие фрагменты их молекул.
В последнее время в особую группу выделены белки с рецепторной функцией. Какова же их роль в организме? Есть доказательства, что многие гормоны, активно влияющие на обмен веществ, не проникают в клетку, а связываются со специфическими белками, находящимися на поверхности клеточных мембран. Это способствует передаче гормонального влияния внутрь клетки. Такие белковые рецепторы обнаружены для ряда гормонов: инсулина, глюкагона, адреналина и др. Считается, что белок-рецептор, находящийся на наружной мембране, одним концом контактирует (связывается) с гормоном, а другим — с ферментом на внутренней мембране. После связывания с гормоном конформация рецепторного белка изменяется. Это изменение снаружи является сигналом для включения фермента внутри клетки, переводя его из неактивного в активное состояние. Не исключено, что гормон может проникать в клетку в виде гормон-белкового комплекса, связавшись предварительно с белком-рецептором. Количество рецепторных белков на поверхности клеток велико. Например, на жировой клетке содержится около 160 000 рецепторных участков для инсулина. Это соответствует 21 рецептору на 1 мкм2 поверхности клетки.
Рецепторные белки обнаружены и у растений, и у низших организмов.
Особый интерес представляют рецепторы, которые поглощают энергию (например, звуковую или световую), преобразовывают ее особыми белковыми молекулами и передают в центральную нервную систему. Фоторецепторным белком, преобразующим световую энергию, является опсин. При взаимодействии с альдегидом ретиналем белок опсин превращается в родопсин. При поглощении света родопсин меняет свою конформацию и возбуждает нервный импульс. Таков упрощенный механизм зрительного акта.
Из вкусовых рецепторных белков наиболее изучен сладкочувствительный белок. Он имеет молекулярную массу около 150 000 и содержит большой процент дикарбоновых аминокислот. Этот белок способен связывать моно-и дисахариды, передавая информацию о них в центральную нервную систему.
Следует упомянуть и о существовании белковых веществ, тормозящих действие ферментов. Такие белки обладают ингибиторными функциями. При взаимодействии с этими белками фермент образует комплекс и теряет свою активность полностью или частично. Многие белки — ингибиторы ферментов — выделены в чистом виде и хорошо изучены. Их молекулярные массы колеблются в широких пределах; часто они относятся к сложным белкам — гликопротеидам, вторым компонентом которых является углевод.
Если белки классифицировать только по их функциям, то такую систематизацию нельзя было бы считать завершенной, так как новые исследования дают много фактов, позволяющих выделять новые группы белков с новыми функциями. Среди них уникальные, недавно обнаруженные вещества — нейропептиды. Они регулируют важнейшие жизненные процессы: памяти, сна, боли, чувства страха, тревоги. Некоторые из нейропептидов уже выделены, их строение установлено, они даже получены синтетическим путем.
Функции отдельных белков до настоящего времени не выяснены, хотя есть веские основания говорить об их важнейшей роли в жизнедеятельности организмов. а-Фетопротеин является эмбриональным белком, т. е. он присутствует в крови плода человека и животных. Причем на ранних стадиях эмбриогенеза он является преобладающим белком по количеству, что дало основание предположить, что а-фетопротеин выполняет функцию эмбрионального альбумина. Молекулярная масса этого белка около 70 000. Его синтез резко угнетается после рождения, и у взрослого человека а-фетопротеина содержится всего 5 мкг на 1 л крови. При раке печени синтез этого белка резко увеличивается. Это явление было открыто советскими учеными Г. И. Абелевым и Ю. С. Татариновым и легло в основу ранней диагностики данного заболевания. Результаты открытия используются сейчас во всем мире для проведения массовых анализов с целью раннего выявления болезни.
Разбирая те или иные функции белков, мы приводим примеры какого-либо одного белка одной определенной функции. В органе, ткани или отдельной клетке функции белков взаимосвязаны. Одни и те же белки могут выполнять несколько функций, что дает основание говорить о функциях целой ткани или о роли белков в такой, например, биологической жидкости, как плазма крови. Рассмотрим ее функции более подробно.
Плазма — жидкая часть крови, в состав которой входят химические соединения разных классов, но 85 % ее сухой массы составляют белки. Их количество зависит в основном от вида и возраста живых организмов, режима питания и физиологического состояния.
Химический состав белков плазмы крови начали изучать в 30-х годах прошлого столетия, но исследование их физико-химических свойств, структуры и физиологических функций стало возможно только в начале XX в. С развитием аналитических и препаративных методов белковой химии углублялись знания в области химии белков крови. Удалось показать, что в плазме содержится около ста индивидуальных белков, различающихся между собой.
Белки плазмы крови, которые обладают одинаковой подвижностью в электрическом поле и потому не разделяются путем электрофореза, могут отличаться по иным физико-химическим свойствам: молекулярной массе, скорости осаждения или диффузии, изоэлектрическим точкам, хроматографическим характеристикам и другим показателям.
Поэтому для разделения и аналитического определения белков крови используют комплекс различных методов.
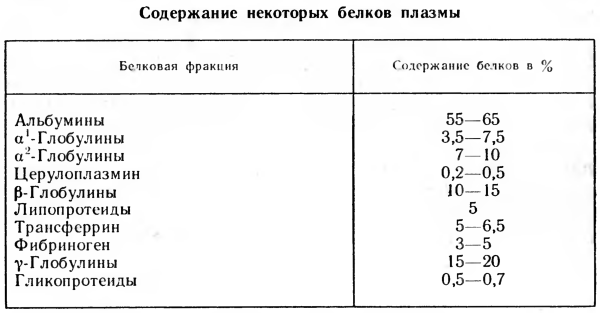
Кроме белков, постоянно присутствующих в плазме, в крови находят белки, появление которых объясняется повреждением тканей и выходом тканевых белков в кровяное русло или изменением клеточной проницаемости белков. Такое явление наблюдается при некоторых заболеваниях: поражении печени, инфаркте миокарда и др. В этих случаях состав плазмы крови — показатель состояния органа, ткани или организма, необходимый для диагностики болезни и контроля за эффективностью проводимого лечения.
Одна из основных функций белков плазмы крови — перенос продуктов обмена веществ, попадающих в кровеносное русло. Наиболее важную роль в транспортных процессах играет альбумин, который вступает в соединение с различными веществами. В его молекуле большое количество SH-групп, аминогрупп лизина и других реакционноспособных участков. Поэтому он легко присоединяет многочисленные продукты обмена, а также ионы меди, цинка, марганца, хлора, иода. Альбумин соединяется с гормонами, токсинами, различными лекарственными веществами. Эти соединения непрочные, что особенно необходимо для выполнения альбумином транспортной функции. Они легко диссоциируют, и освобожденный альбумин переходит обратно из органа или ткани в кровеносное русло.
Транспортными белками плазмы крови являются глобулины, избирательно взаимодействующие с тироксином, стероидными гормонами, ионами железа. Важную группу белков плазмы крови составляют углеводно-полипептидные комплексы — мукоиды, содержащие от 40 до 70 % сахаров. К этой группе относятся вещества, определяющие принадлежность крови к определенной группе. Наличие углеводного компонента стабилизирует белок. Некоторые гликопротеиды сохраняют стабильность и оказываются активными после нагревания плазмы до 100 °С.
Большая группа белков плазмы крови представлена липопротеидами, функцией которых является связывание и транспорт жиров, перенос жирорастворимых веществ, некоторых витаминов. Потенциальная способность белков крови к связыванию веществ настолько велика, что практически в нормальных условиях используется только небольшая часть их реакционных групп. Остальные группы — необходимый резерв для компенсации изменений в обмене веществ или на случай болезни.
Количественный и качественный состав плазменных белков определяет перераспределение воды между кровеносным руслом и тканями, активно влияет на кровяное давление и проницаемость сосудов. От содержания и состава плазменных белков зависит вязкость крови. Наибольшее влияние на вязкость оказывают фибриноген и макроглобулин — высокомолекулярные белки.
Регуляторные функции белков плазмы крови на этом не исчерпываются. Особо следует остановиться на вопросе о роли ферментов крови. Их делят на две группы. Одну группу представляют ферменты, присутствующие в крови постоянно. Это ферменты свертывающей и противосвертывающей систем крови, липаза, каталаза и т. д. Другую группу составляют ферменты, поступающие в кровяное русло из органов и тканей при распаде клеток или при нарушении проницаемости клеточных мембран.
Ферменты первой группы выполняют строго определенные функции, регулируя обмен жиров, процессы окисления, свертывания и другие жизненно важные реакции. Ферменты второй группы в большинстве случаев не принимают непосредственного участия в реакциях крови. Они в норме не должны содержаться в крови, или их концентрации незначительны. Но их обнаружение в плазме представляет огромный интерес, так как свидетельствует о поражении того или иного органа или ткани. Появление в кровотоке некоторых ферментов помогает установить диагноз заболевания, рассказать о глубине поражения органа или ткани, т. е. о стадии болезни. Для этой цели в клиниках в настоящее время определяют более 40 различных ферментов. Наибольшее значение имеет исследование активности трансаминаз, фосфатаз, дегидрогеназ, а также их изоферментов. Такие аналйзы позволяют более четко выявить, откуда в кровь поступил фермент, и, следовательно, установить локализацию поражения.
Количество белков плазмы крови значительно превышает тот уровень, который нужен для выполнения транспортных, регуляторных и защитных функций. Этот «избыток» белков крови не случаен. Он создает резервный фонд белков, который всегда может быть использован при нарушении обмена веществ. Эти белки также расходуются при синтезе тканевых белков, гормонов, ферментов, в случаях голодания, когда азотистые вещества с пищевыми продуктами не поступают. Отсутствие в пище незаменимых аминокислот также могут компенсировать белки плазмы крови. Именно из них берутся для организма эти дефицитные строительные блоки. Таким образом, белковый резерв плазмы крови дает возможность длительно поддерживать обменные процессы в органах и тканях в экстремальных состояниях.
О защитной функции белков плазмы крови мы уже упоминали. Рассмотрим теперь некоторые аспекты этого вопроса более подробно. Удивительным свойством белков плазмы крови — иммуноглобулинов — является способность избирательно взаимодействовать только с определенными антигенами (бактериями, вирусами, токсинами, чужеродными белками). Чем же обусловлена такая избирательность иммуноглобулинов к антигенам? Было установлено, что в реакции между антигеном и антителом принимает участие не вся молекула иммуноглобулина, а небольшой участок (менее 1 % по массе), активный центр. Защитные белки — иммуноглобулины — синтезируются особыми иммунокомпетентными клетками. Снижение их синтеза ведет к резкому понижению сопротивляемости организма инфекциям. Чрезмерный неконтролируемый синтез иммунологически неактивных иммуноглобулинов также ведет к тяжелым последствиям. Такие явления наблюдаются, например, при ревматизме, когда в плазме появляются высокие концентрации определенного белка.
Кроме антител, в плазме содержатся некоторые вещества белковой природы, не относящиеся к иммуноглобулинам, но обладающие свойствами защиты организма от инфекций.
Большую роль играют белки плазмы крови в функционировании свертывающей и противосвертывающей систем. Без них невозможно было бы поддерживать постоянный объем циркулирующей крови и нормальное кровоснабжение ею органов и тканей.
При свертывании крови фибриноген плазмы превращается в нерастворимый белок — фибрин. И образующееся при этом переплетение нитей фибрина закрывает поврежденный сосуд, предотвращая кровопотерю. Процесс свертывания крови достаточно сложен. В нем участвует много компонентов. Все они, кроме ионов кальция, являются белками.
В нормальных условиях — внутри сосудистого русла — кровь не свертывается из-за неактивного состояния свертывающей системы и наличия антисвертывающей системы. В предотвращении свертывания главную роль играют гепарин, фибринолизин и другие антикоагуляционные вещества. Роль белка фибринолизина состоит в том, чтобы растворить сгустки фибрина в кровеносном русле и предотвратить закупорку сосудов — тромбообразование.
Несмотря на то что белки крови достаточно хорошо изучены, в этом разделе белковой химии еще много проблем. Не выяснена связь между структурой и функцией некоторых белков плазмы, а также физиологическая роль ряда протеинов. Разрабатываются новые пути выделения белковых препаратов, используемых в качестве лечебных средств. Внедряются новые методы диагностики и лечения заболеваний на основе изучения химии белков плазмы крови.
Скачать реферат:
Пароль на архив: privetstudent.com