Аминокислоты - составная часть белков
Способы выделения аминокислот из белков
В состав белков входят аминокислоты, которые можно выделить при гидролизе (кислотном или щелочном) или при действии протеолитических ферментов.
Кислотный гидролиз проводят кипячением белка с крепкими растворами соляной или серной кислоты в течение 10—20 ч. Этот способ получения из белка смеси аминокислот относительно прост, но имеет существенный недостаток. При таком гидролизе природного белка, содержащего всегда примеси других органических соединений, в частности углеводов, образуется смесь побочных продуктов коричневого цвета, связывающих часть освободившихся из белка аминокислот. Кроме того, при кислотном гидролизе не удается полностью выделить аминокислоту триптофан, так как она разрушается.
При щелочном разложении белков часть L-аминокислот переходит в D-аминокислоты (о стереоизомерии аминокислот см. с. 16), а некоторые из них разрушаются. Чаще всего этот способ гидролиза применяют для получения из белка триптофана, который не может быть получен кислотным гидролизом.
Можно гидролизовать белки при оптимальной температуре с помощью ферментов — пептидаз. Аминокислоты при этом не разрушаются, но осуществить полный гидролиз и отщепить все аминокислоты в свободном виде не удается.
Если для гидролиза брать белки из живых организмов как животного, так и растительного происхождения, а также белки из различных органов и тканей, то все равно получается смесь одинаковых аминокислот. Оказывается, в гидролизатах любых белков содержится
только двадцать аминокислот, но каждая из них может встречаться в одном белке несколько раз в различных участках макромолекулы.
Свойства аминокислот
Кроме аминокислот, входящих в структуру белков, известно еще более ста аминокислот, которые встречаются в отдельных пептидах, гормонах, антибиотиках или просто находятся в свободном состоянии. Например, а-аминопропионовая кислота (а-аланин) — это одна из двадцати «белковых аминокислот», в-аминопропионовая кислота (в-аланин) в белках отсутствует, но встречается в растениях и клетках животных в свободном виде:


Эти аминокислоты отличаются местом расположения аминогруппы: в одном она находится в a-положении по отношению к карбоксильной группе, в другом — в в-положении.
Замечено, что в состав белков входят только а-аминокислоты. Основными функциональными группами их являются

способные к диссоциации. При растворении белков или отдельных аминокислот в воде образуются растворы кислого или основного характера. Этот факт объясняется еще и тем, что в белках могут содержаться такие аминокислоты, как аспарагиновая и глютаминовая, имеющие две СООН-группы. Тогда белок приобретает кислотные свойства. В других белках преобладают аргинин, лизин или гистидин, имеющие две NH2-группы, что сообщает белкам основные свойства.
В широком интервале pH аминокислоты существуют преимущественно в виде биполярных ионов как молекулы с диссоциированнои карбоксильной группой и протонированной аминогруппой:

Для а-аминокислот, входящих в состав белков, характерна оптическая изомерия. Оптическая активность органических веществ обусловлена отсутствием центра симметрии в молекуле. Выявить такие соединения можно, если определить, есть ли в молекуле асимметричный атом углерода, т. е. атом, все четыре валентности которого насыщены различными радикалами:

Если в указанном примере вместо радикала поставить атом водорода, то получится аминокислота глицин:

В молекуле этой аминокислоты у углерода уже две валентности заняты одинаковыми атомами — водородом, а значит, углеродный атом теперь не будет считаться асимметричным. Действительно, глицин — единственная из природных аминокислот, не обладающая оптической активностью. Обнаружить оптическую активность можно, если направить поляризованный луч света на раствор какой-либо аминокислоты: если луч отклоняется вправо, аминокислоту обозначают знаком ( + ), если влево — знаком ( — ). Остальные физические и химические свойства оптических изомеров одинаковы.
Стереохимические изомеры аминокислот в отличие от разобранных выше оптических изомеров обозначают буквами L или D.
Если при асимметричном атоме углерода аминогруппа расположена справа, это D-аминокислота, если слева — L-аминокислота:

В белках животных встречаются только a-L-аминокислоты. Их и называют природными. Незначительные количества D-аминокислот обнаружены только у микроорганизмов. D-Аминокислоты не усваиваются животными и растениями, у которых нет ферментов, способных катализировать превращения веществ D-ряда.
Состав аминокислот
Аминокислоты можно сгруппировать в зависимости от особенностей их строения. Перечислим основные аминокислоты.
Моноамшомонокарбоновые имеют одну амино- и одну каобоксильную группы в молекуле:

Глицин не имеет асимметричного углерода, оптически неактивен, является аминопроизводным уксусной кислоты.
Сходное строение у аминокислоты аланина:

Наличие у серина ОН-группы увеличивает его реакционную способность. Свободная ОН-группа серина в составе белка позволяет увеличить реакционную способность белковой молекулы:

Присутствие SH-группы у цистеина сообщает ему особые свойства:

Из двух молекул цистеина может образоваться новая аминокислота — цистин. Сульфгидрильные группы цистеина при этом превратятся в дисульфидный мостик цистина:

Сера содержится еще в одной важной для обмена веществ аминокислоте:

У аминокислоты треонина следующее строение молекулы:

Производным изовалериановой кислоты является валин:

Производными капроновой кислоты являются лейцин и изолейцин:


Моноаминодикарбоновые кислоты имеют кислый характер, а в составе белковой молекулы придают кислый характер белку за счет диссоциации свободных карбоксильных групп:


Диаминомонокарбоновые аминокислоты содержат на одну карбоксильную группу две аминогруппы:

В некоторых белках обнаружено гидроксильное производное этой аминокислоты:

Важной диаминомонокарбоновои кислотои является аргинин:

Включение в состав белка лизина, аргинина или окси-лизина придает ему щелочные свойства.
Среди аминокислот, входящих в белки, есть такие, в радикал которых входят циклические структуры. Например, если один водород в аланине заменить фенильным радикалом, то получится аминокислота фенилаланин:

И в структурном, и в функциональном отношении к фенилаланину близка другая аминокислота — тирозин:

Иной циклический радикал имеет аминокислота триптофан:

Следующая аминокислота — гистидин — имеет щелочную реакцию, так как содержит две основные группы, т. е. —NH2 и =NH:

Еще две аминокислоты были обнаружены в белках, хотя их не совсем правомерно называть аминокислотами. Они содержат не аминогруппу —NH2, а иминогруппу =NH:

Оксипролин и оксилизин чаще встречаются в белках, выделенных из соединительной ткани, например в коллагене.
В последнее время появились сообщения об обнаружении в белках новой — двадцать первой — аминокислоты — аминолимонной:
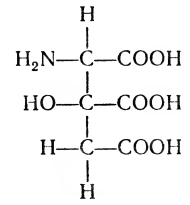
От всех других аминокислот, встречающихся в белках, ее отличает наличие трех карбоксильных групп, высокий отрицательный заряд. Она обнаружена в различных тканях человека, животных и некоторых бактерий. О функции этой аминокислоты пока ничего не известно.
Так же мало известно и еще об одной — двадцать второй, недавно открытой в рибосомах аминокислоте — карбоксиаспарагиновой:

Ее молекулы тоже обладают необычно большим отрицательным зарядом.
Скачать реферат:
Пароль на архив: privetstudent.com