Скачать:
«Использование радиоизотопных методов применительно к микроорганизмам»
Содержание
Введение
Радиоизотопные методы
1.1 Получение изотопомеченых соединений
1.2 Радионуклид 3Н (тритий)
1.3 Радионуклид 14C
1.4 Радионуклид 35S
Заключение
Список используемой литературы
Введение
Эксперименты по измерению активности микроорганизмов в их природных местообитаниях или в свежих образцах с применением радиоизотопов являются наиболее чувствительными методами из всех существующих. Кроме того, они могут пролить свет на судьбу того или иного субстрата в микробных сообществах определенной экониши.
1. Радиоизотопные методы
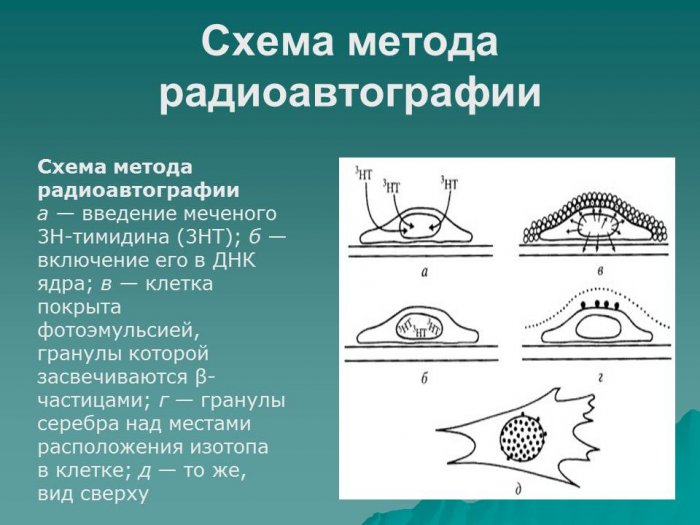
Радиоизотопные методы — важный метод, позволяющий изучать распределение в клетках и тканях веществ, в состав которых искусственно введены радиоактивные изотопы (3Н, НС, 32Р и др.). Введенный в организм животного (или в среду культивирования клеток) изотоп включается в соответствующие структуры (например, меченый тимидин — в ядра клеток, синтезирующих ДНК). Метод основан на способности включенных в клетки изотопов восстанавливать бромистое серебро фотоэмульсии, которой покрывают срезы ткани или клетки. Образующиеся после проявления фотоэмульсии зерна серебра (треки) служат своего рода автографами, по локализации которых судят о включении в клетку примененных веществ. Применение меченных тритием предшественников нуклеиновых кислот (тимидина, аденина, цитидина, уридина) позволило выяснить многие важные аспекты синтеза ДНК, РНК и клеточных белков.
Для обнаружения и измерения скорости сульфатредукции применяют изотоп серы. Скорость метаногенеза можно проследить по превращению углекислого газа в аммиак в присутствии значительного количества водорода.
Во всех случаях, определяя скорости процессов потребления изотопа или его выделения, необходимо учитывать соотношение меченого и немеченого субстрата, внесенного в пробу для расчета специфической активности потребления субстрата или образования продукта.
В экологии микроорганизмов наибольшее распространение получили исследования, с трансформацией изотопов углерода и сера. Большинство углерода встречается в виде изотопа, но есть небольшое количество стабильного тяжелого, а также радиоактивного. Подобно этому соединения серы встречаются в виде изотопа, стабильного изотопа и радиоактивного изотопа.
Живые клетки в своих процессах вырабатывают соединения с более легкими изотопами, а более тяжелые изотопы остаются не прореагировавшими и их доля в субстрате увеличивается, а в продукте уменьшается. Этот феномен получил название «фракционирование изотопов».
Лабораторные эксперименты с чистыми культурами микроорганизмов показали, что продукты метаболизма заметно обогащаются легкими стабильными изотопами, а в остаточном субстрате происходит накопление тяжелых стабильных изотопов.
ФРАКЦИОНИРОВАНИЕ ИЗОТОПОВ МИКРООРГАНИЗМАМИ— изменение изотопного состава конечных продуктов обмена веществ микроорганизмов сравнительно с использованными веществами среды. Так, сульфатредуцирующие бактерии с большей скоростью восстанавливают сульфаты с изотопом серы S32, благодаря чему в образуемом бактериями сероводороде избирательно концентрируется легкая сера, а в остаточных сульфатах накапливается тяжелая сера S34. Этот процесс приводит к тому, что все молекулы серы, при образовании которых проходил процесс микробиологической редукции сульфатов, отличаются «облегченным» изотопным составом. Разделение изотопов происходит при некоторых др. микробиологических процессах (гниение, образование метана) и в процессе фотосинтеза.
При изучение проб различного происхождения оказалось, что наиболее «тяжелые» по углероду морские карбонаты ( химического происхождения с соотношением ∆¹³С=±5‰). Недавние (геологические) морские осадки имеют ∆¹³С= - 10-35‰. Что явно указывает на участие микроорганизмов в их формировании. Интересно отметить, что скальные породы возраста около 3,5 млрд. лет обеднены по ¹³С на 12-22‰, что свидетельствует об очень раннем возникновении автотрофии на планете.
Подобные измерения проведенные в отношении изотопов серы, показали, что метеоритный сульфид имеет ∆³5S от −3 до +3‰, тогда как залежи элементной серы от-18 до +18‰, а сульфит морских остатков до −30‰, что говорит о значительном вкладе сульфатредукторов в процесс глобального цикла серы.
1.1 Получение изотопомеченых соединений
Получении изотопномеченых соединений используют несколько подходов, один из которых заключается в униформном обогащении стабильными изотопами клеточных биологически активных соединений по всему углеродному скелету молекул. Это достигается за счёт выращивания микроорганизмов на средах, содержащих меченые субстраты высокого уровня изотопной чистоты и с последующим фракционированием компонентов биомассы на различные классы природных соединений. Так, аминокислоты с униформным характером включения изотопной метки 13С по скелету молекулы получают, в основном, при выращивании автотрофных микроорганизмов на ростовых средах, содержащих вместо обычных углеродных субстратов исключительно их низкомолекулярные [13С] аналоги, например 13СО2. Таким способом были получены многие [13C]белки, синтезируемые микроводорослями: ферридоксин из Anabaena , цитохром C-553 , цитохром C2 из Rhodospirillum , и флаводоксин из Anabaena 7120 и использованы для дальнейших исследований. Для структурных исследований белков методом спектроскопии, для которого необходимо, чтобы как можно больше атомов в молекуле были замещены на их стабильные изотопы, биосинтетические подходы по получению униформно меченых [13C]аминокислот могут обеспечить сравнительно недорогое получение нужного количества меченых [13C]продуктов. [15N]аминокислоты получают аналогичным путём за счёт выращивания микроорганизмов на водных средах, содержащих К15NO3 или другие 15N-содержащие соли, в то время как высокообогащённые дейтерием аминокислоты можно получать с использованием ростовых сред, содержащих вместо обычной воды 99,9% 2H2O. Однако при этом необходимо учитывать эффекты, связанные с клеточной адаптацией к 2Н2O. Известно, что 2Н2О действует токсически на клетки, ингибируя жизненно-важные функции роста и развития многих микроорганизмов.
Селективного включения стабильных изотопов в определённые положения молекул аминокислот и белков можно достичь за счёт применения комбинации меченых и немеченых субстратов в ростовых средах, меченых предшественников аминокислот, или при использовании ауксотрофных по определённым аминокислотам штаммов микроорганизмов. Для этих целей очень хорошо подходит такая распространённая бактерия как E. coli, биосинтез аминокислот в которой к настоящему времени изучен наиболее детально и для которой получен многочисленный набор мутантных форм.
Очень часто, разветвлённые пути метаболизма меченых аминокислот в клетке приводят к специфическому мечению других биосинтетически родственных аминокислот за счёт использования клеткой многочисленных минорных путей биосинтеза и сопряжённых реакций метаболизма. В некоторых случаях этот фактор может существенно облегчить процесс получения селективно меченых белков и аминокислот. Таким способом был получен [15N]Т4-лизоцим, с селективным характером включения метки 15N лишь по остаткам глутамата, глутамина и аргинина.
1.2 Радионуклид 3Н (тритий)
Тритий — радиоактивный изотоп водорода, «чистый» β-излучатель, который легко нарабатывается в реакторе в значительном количестве.
Можно добавить биосинтез — выращивание микроорганизмов на среде, содержащей 3Н-предшественник (например, [метил-3H] тимидин, для получения меченой ДНК), с последующим выделением целевого соединения. Однако этот способ достаточно специфический и обычно применяется только в лабораторной практике для получения биополимеров.
Принцип этого метода очень прост, он повторяет метод Беккереля, открывшего радиоактивный распад. При радиоавтографическом исследовании в среду с находящимися там клетками вводится предшественник одного из макромолекулярных соединений (например, аминокислота или нуклеотид), один из атомов которого замещен радиоактивным изотопом. Например, вместо 12С введен атом 14С, вместо водорода — тритий (3Н) и др. В процессе синтеза в биополимер включится и меченая молекула предшественника. Регистрировать ее место в клетке можно с помощью фотоэмульсии. Если клетки в пласте или на срезе покрыть фотоэмульсией, то через некоторое время в результате распада изотопа β-частицы, разлетающиеся хаотично в разных направлениях, попадут в зону чувствительного фотослоя и активируют в нем зерна бромистого серебра. Чем больше будет время экспозиции, т.е. контакта такой меченой клетки с фотоэмульсией, тем больше зерен AgBr будет засвечено. После экспозиции надо проявить препарат, при этом происходит восстановление серебра только в засвеченных гранулах, при фиксации препарата незасвеченные гранулы AgBr растворяются. В результате из массы гранул, которые покрывали объект, останутся только те, которые были активированы β-излучением. Просматривая в микроскоп такие препараты, поверх которых нанесен слой фотоэмульсии, исследователь находит места локализации зерен серебра, которые располагаются напротив мест, где содержится меченое вещество.
Этот метод имеет ограничения: точность его будет зависеть от величины зерна AgBr и от энергии частицы. Чем больше величина зерна, тем с меньшей точностью можно узнать место расположения изотопа. И чем выше энергия частицы и длиннее ее пробег, тем дальше от места распада будет происходить активация зерен AgBr. Поэтому для метода радиоамтографии используют особые мелкозернистые фотоэмульсии
1.3 Радионуклид 14C
Радионуклид 14C получают облучением нитрида алюминия по реакции:
14N + 0n —> 14C + 1p
В виде 14C-карбида. Из него 14C выделяют в виде 14CО2, который обычно поглощают Ba(OH)2, и полученный 14C-карбонат является основным радиоактивным сырьем для всех синтезов 14C-соединений.
Биосинтез. В питательную среду к микроорганизмам (обычно это водоросли типа хлореллы) добавляют 14CО2 в качестве единственного источника углерода. После выращивания из биомассы выделяют равномерно меченые 14C-соединения. Таким путем получают аминокислоты, нуклеозиды, сахара, липидные компоненты и другие природные соединения. Иногда 14C-биомассу водорослей используют как источник углерода (своего рода меченый пептон) для выращивания штамма-продуцента какого-нибудь важного соединений.
Скорость фотосинтеза измеряют обычно в водных образцах в светлых и темных склянках с введенной порцией 14СО2. Образцы инкубируют в течение нескольких часов или всего светового периода in situ и определяют скорость включения меченой углекислоты (обычно в течение первых
1.4 Радионуклид 35S
Наработка радионуклида серы-35 проводится в ректоре облучением KCl или NaCl по реакции 35Cl + 0n —> 35S + 1p в виде 35S-сульфата. Некоторые специфические методики приготовления образцов KCl для облучения позволяют получать 35S в виде элементарной серы. Схема распада серы-35: 35S —> 35Cl + e . Удобный период полураспада и вполне приемлемая энергия β-излучения делают серу-35 очень популярным радионуклидом в своей «нише», вызывая досаду малой распространённостью соединений серы в живых организмах.
Сера-35 используется, в основном, для введения «метки» в белок за счет 35S-метионина или (реже) 35S-цистеина. Аминокислоты, меченные серой-35, получают биосинтезом, выращивая бактериальную биомассу на среде, содержащей 35S-сульфат. После кислотного гидролиза 35S-биомассы из белкового гидролизата выделяют аминокислоты. Иногда фирмы-производители вместо индивидуальных 35S-аминокислот предлагают просто 35S-белковый гидролизат, который может быть использован для выращивания культуры клеток в 35S питательной среде.
Заключение
Эксперименты с радиоактивными изотопами широко применяются в экологии микроорганизмов, однако, поскольку в гетерогенных природных местообитаниях всегда могут проходит и химические превращения субстратов, необходимо проводить опыты с соответствующими контрольными образцами: ключевые из них — пробы с убитыми клетками. Этот метод один из основных методов, позволяющих изучать динамику синтетических процессов, сравнивать их интенсивность в разных клетках на одном и том же препарате. Так, с помощью этого метода при использовании меченых предшественников РНК было показано, что вся РНК синтезируется только в интерфазном ядре, а наличие цитоплазматической РНК является результатом миграции синтезированных молекул из ядра.
Скачать: