Неспособность большинства патогенов заражать данное растение свидетельствует о том, что растения обычно могут защищаться от потенциальных возбудителей инфекции. Считается, что растения защищаются от таких патогенов с помощью уже существующих барьеров или путем динамического образования в тканях антимикробных веществ в ответ на внедрение возбудителей. Тем не менее некоторые возбудители способны беспрепятственно заражать данные растения. Такие патогены уже приобрели или способность внедряться в своего хозяина, не индуцируя эффективных защитных реакций, или средства для преодоления конститутивных или индуцируемых барьеров против заражения, эффективных в отношении других патогенов. Реакция сверхчувствительности растительных тканей в ответ на внедрение агентов включает быструю гибель клеток, побурение тканей и накопление антимикробных компонентов и обычно характерна скорее для устойчивых, чем для восприимчивых тканей. Более того, устойчивость, по-видимому, часто зависит от наличия реакции сверхчувствительности.
Мы исследовали механизмы специфичности в системе хозяин — паразит и расосортовой специфичности, используя следующие рабочие гипотезы. В устойчивых растениях, где внедряющиеся патогены локализуются в результате реакции сверхчувствительности растительных тканей, распознавание инфекционных агентов растительными клетками может включать последовательные процессы устойчивости, свойственные растению.
В процессе распознавания, ведущем к несовместимости, некоторый компонент внедряющегося патогена может реагировать с компонентами соответствующей системы распознавания хозяина на ранней стадии заражения.
Если распознавание необходимо для установления несовместимого взаимодействия, совместимость хозяина и паразита можно рассматривать как результат нескольких возможных ситуаций:
— внедряющийся патоген может не иметь компонентов, необходимых для распознавания его клеткой хозяина;
— восприимчивые клетки хозяина могут не обладать способностью распознавать эти компоненты внедряющегося патогена;
— внедряющийся патоген может нести некий фактор, ингибирующий систему распознавания у хозяина;
— даже если распознавание внедряющегося патогена произошло, некоторые этапы последующей реакции устойчивости могут быть подавлены фактором, образуемым патогеном;
— даже если все процессы реакции устойчивости хозяина активированы, внедряющийся патоген может быть устойчив к ним.
В настоящей статье мы хотим описать новые аспекты индукции и супрессии сверхчувствительной реакции клеток хозяина в системе картофель—Phytophthora in-festans и обсудить роль запуска и погашения реакций распознавания в определении расосортовой специфичности.
Сверхчувствительная гибель клеток и устойчивость
Доказано, что несовместимые расы P. infestans ин-дуцируют быструю гибель клеток ткани картофеля и что это ранняя реакция инфицированных клеток, связанная с устойчивостью хозяина. Поверхностные клетки тканей свежеразрезанного клубня или черешка картофеля не способны быстро погибать после заражения несовместимой расой, но приобретают эту способность после выдерживания при оптимальных температурах. Такой переход клеток из низкореактивного состояния в высокореактивное зависит от синтеза белка de novo. Однако, достигнув такого реактивного состояния, клетки могут сверх чувствительно реагировать в условиях, при которых резко ингибируется синтез белка.
В противоположность раневым тканям интактные эпидермальные клетки листьев и черешков быстро реагируют на внедрение несовместимого патогена. Однако прединфекционная обработка интактных черешков ингибитором синтеза белка подавляет сверхчувствительную гибель клеток, вызванную грибом. Эти наблюдения позволяют предполагать, что способность реагировать сверхчувствительно на внедрение несовместимого патогена может быть индуцирована каким-то стимулом (фактором, активирующим сверхчувствительность), который связан с поранением или инфекцией. В то же время процесс гибели клеток, развивших эту способность, не зависит от синтеза белка de novo.
Подавление индукции реактивного состояния сопровождается превращением устойчивых тканей хозяина в восприимчивые. В тканях, достигших реактивного состояния, некоторые ингибиторы метаболизма (NaN3, 2, 4-динитрофенол, или 2, 4-ДНФ, SH-реактивы) подавляют сверхчувствительную гибель клеток, вызванную заражением несовместимыми грибами, приводя к восприимчивому взаимодействию. Однако ингибитор синтеза белка делает устойчивую ткань восприимчивой, не влияя на сверхчувствительную гибель клеток. Таким образом, сверхчувствительная гибель клеток, индуцируемая инфекцией несовместимыми грибами, является существенным процессом, ведущим к реакции устойчивости в тканях хозяина, но не играет прямой роли в подавлении роста грибов.
Мы хотели бы привести дальнейшее экспериментальное доказательство того, что быстрая гибель клеток при внедрении несовместимых патогенов — это важный процесс, ведущий к устойчивости растительных тканей.
Для сравнительного определения интенсивности устойчивости, которая выражается относительным числом пораженных и побуревших клеток на поздних стадиях инфекции, и скорости, с которой гибнут инфицированные клетки, использовали свежие и выдержанные диски из клубней картофеля 12 сортов, имеющих различные R -гены устойчивости к P. infestans
Процент первично инфицированных клеток, погибших в течение 7 ч после инокуляции, был очень низким у каждого сорта при использовании свежих дисков и возрастал после их выдерживания в течение суток (рис. 1).
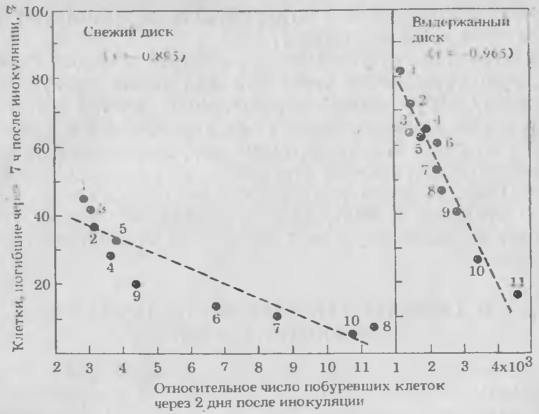
Рис. 1. Корреляция между процентом погибших клеток в первично инфицированных клетках свежих и выдержанных дисков из клубней различных сортов картофеля через 7 ч после инокуляции несовместимой расой P. infestans и относительным числом побуревших клеток в дисках клубней через два дня после инокуляции:
1 — Rishlri (R1 ): 2— Hokkai-53 (R1R2): 3 — Shimakei-518 (R3); 4— Hokkai-59 (R3):5 —Yukijiro (R1); 6 — Shimakei-520 (R3); 7— Hokkai-34 (R4); 8 — Hok-kai-43 (R1 R3); 9—Pentiand Ace (R3); 10—Shiretoko (R1R2); 11 — 1512-C (16) (R2).
В обоих случаях сорта различались по скорости, с которой гибли клетки. В то же время число пораженных и некротизированных клеток на поздних стадиях инфекции у каждого сорта было выше в свежих дисках, чем в выдержанных, и также варьировало по сортам. Как для выдержанных, так и для свежих дисков всех сортов показана тесная отрицательная корреляция между процентом клеток, погибших за 7 ч, и числом клеток, побуревших за 2 дня (r = 0, 965 и 0, 895 соответственно). Это означает, что в тканях сортов с более высокой скоростью сверхчувствительной гибели клеток патоген мог внедриться в меньшее число клеток. Различие в устойчивости между сортами или выдержанными и свежими дисками в значительной мере определяется скоростью сверхчувствительной гибели клеток. В тканях каждого сорта, по-видимому, есть клетки, которые или реагируют, или не реагируют на нападение несовместимых грибов.
Интенсивность устойчивости листьев каждого сорта, которую определяли через три дня после инокуляции по числу побуревших эпидермальных клеток в пятне, вызванном одной спорой, также варьировала в зависимости от сорта и положительно коррелировала с устойчивостью выдержанных (r= 0, 639), но не свежих дисков (r = 0, 063). Реакция устойчивости в листьях была сходна с реакцией в выдержанных дисках, что также указывает на возможную ее зависимость от быстрой гибели клеток.
Сверхчувствительная гибель клеток и фитоалексины
Получено множество данных о важной роли индуцируемых инфекцией фитоалексинов в ограничении внедряющихся патогенов. В системе картофель — P. infestans о положительной роли фитоалексинов в устойчивости говорит тот факт, что подавление роста инфицирующих гиф проявляется именно в период, когда концентрация фитоалексинов в ткани достигает ингибирующего уровня. В этом разделе рассматривается вопрос, почему и как фитоалексин связан с индукцией сверхчувствительной гибели клеток л устойчивости.
Для выяснения роли сверхчувствительной гибели клеток в ограничении внедряющегося патогена исследовали связи между сверхчувствительной гибелью клеток, интенсивностью устойчивости, временем накопления фитоалексина и его количеством. С этой целью использовали вышеуказанную систему тканей картофеля, в которой у устойчивых сортов показали более высокую скорость сверхчувствительной гибели клеток. В выдержанных дисках клубней картофеля несовместимая раса P. infestans проникает в поверхностные клетки после образования аппрессориев так же, как и совместимая раса. Большинство способных к инфекции спор завершает внедрение в клетки хозяина в течение 3 ч после инокуляции, образуя глобулярную структуру типа гаустории и инфекционные гифы. Микроскопические наблюдения совместимых взаимодействий показывают, что инфекционные гифы идут из первично инфицированных клеток в следующие клетки или в межклетники примерно в течение 12 ч после инокуляции. При несовместимых взаимодействиях инфекционные гифы, встречающие сверхчувствительно реактивные клетки, не проникают в окружающие зоны ткани. В высокоустойчивом сорте, например Rishiri, около 80% инфицированных клеток погибало в течение 7 ч после инокуляции и около 80% внедрившихся гиф было локализовано в первично инфицированных клетках. Аналогично процент первично инфицированных клеток, погибших в течение 7 ч после инокуляции, у каждого сорта прямо коррелировал с процентом внедрившихся гиф, локализованных в этих клетках (рис. 2).
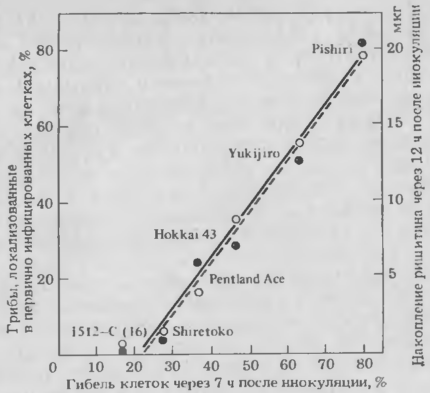
Рис. 2. Корреляция между процентом погибших клеток через 7 ч после инокуляции, процентом внедрившихся грибов, локализованных в первично инфицированных клетках (О), и накоплением ришитина через 12 ч после инокуляции (мкг/г сырого материала) (●)в старых дисках клубней различных сортов, инокулированных несовместимой расой (раса 0) Р infestans.
Между процентом погибших клеток через 7 ч после инокуляции и временем начала накопления фитоалексина обнаружена тесная корреляция (r=0, 929). Количество ришитина, основного фитоалексина картофеля, накопившееся за 12 ч после инокуляции, тесно коррелировало с процентом погибших клеток через 7 ч после инокуляции и было постоянным в пересчете на процент погибших клеток для каждого сорта, за исключением имевших очень малое число погибших клеток и необнаруживаемые концентрации фитоалекси-на (см. рис. 2). Синтез фитоалексинов картофеля может активно происходить в живых клетках, прилегающих к сверхчувствительно погибшим, поэтому количество ришитина, накопленного в погибших клетках или вокруг них, по-видимому, достаточно для подавления роста инфекционных гиф. Гибель клеток в течение 7 ч после инокуляции может привести к накоплению фитоалексинов до ингибирующего уровня, прежде чем пройдет 12 ч после инокуляции, когда инфекционные гифы способны покинуть инфицированные клетки.
И наоборот, встречая медленно реагирующие или нереактивные клетки, грибы могут продолжать рост в направлении других клеток или межклетников до тех пор, пока кончики их гиф не натолкнутся на сверхчувствительно реактивную клетку. Поскольку ткани сортов с низкой устойчивостью имеют небольшое число таких клеток, возможность контакта внедряющихся грибов с ними невелика. В этих случаях погибшие клетки были случайно распределены в более глубоких тканях, но на поздней стадии инфекции появлялось большое число побуревших клеток. Между накопленным количеством фитоалексина и числом побуревших клеток обнаружена тесная корреляция (r=0, 85 в течение первого дня после инокуляции). Следовательно, на поздней стадии инфекции в тканях более устойчивых сортов с небольшим числом побуревших клеток накапливается меньше фитоалексина, чем в тканях сортов с пониженной устойчивостью. Однако на второй и третий день после инокуляции корреляция между числом побуревших клеток и количеством фитоалексина исчезает. Эти результаты позволяют предполагать, что индукция количества фитоалексина, достаточного для локализации патогена, может зависеть от времени несовместимой реакции клеток хозяина, т. е. сверхчувствительной гибели клеток.
Распознавание и сверхчувствительная гибель клеток
Процесс гибели клеток характеризуется агрегацией цитоплазмы вокруг внедряющихся гиф (которая начинается непосредственно перед или после контакта инфекционных гиф с клеточной мембраной хозяина), прекращением движения цитоплазмы, потерей мембранами проницаемости и наличием реакций с затратой энергии. Можно предполагать также, что взаимодействие между поверхностью инфекционных гиф и цитоплазматической мембраной клеток хозяина — это ключевая реакция, приводящая к гибели клеток. В то же время компоненты стенки гиф (КСГ) P. infestans были выделены Кучем и Лискером как возможные индукторы образования фитоалексинов в тканях картофеля. По способности индуцировать фи-тоатексины эти компоненты не являются ни расо-, ни сортоспецифичными.
Недавно мы показали, что протопласты, изолированные из тканей клубней или черешков картофеля, реагируют сверхчувствительно на КСГ P. infestans, причем агрегация цитоплазмы сходна с наблюдаемой во время сверхчувствительной гибели клеток при заражении несовместимыми расами. Кроме того, одиночные клетки, полученные при ферментативной обработке тканей клубня или каллуса, выращенного из тканей клубня, сверхчувствительно реагировали на КСГ. Процент поврежденных протопластов линейно коррелировал с логарифмом концентрации КСГ, выраженной в мкг. Процент реактивных протопластов варьирует в зависимости от сорта. Каждый сорт имеет определенную пропорцию нереактивных и реактивных протопластов при максимальной концентрации КСГ. Способность КСГ P. infestans индуцировать реакцию протопластов картофеля не является расоспецифичной. Сорт Irish Cobbler (без R-генов), совместимый со всеми известными расами гриба, также давал протопласты с активной реакцией на КСГ любой расы. В системе протопластов реакция сверхчувствительности на КСГ не приводит к образованию фитоалексина.
В дальнейшем природу реакции протопластов на КСГ P. infestans исследовали с позиций сверхчувствительной гибели клеток, вызванной заражением грибом или обработкой КСГ. При этом обнаружили следующее: 1) существует тесная корреляция между численностью сверхчувствительно реактивных клеток, индуцируемых инфекцией в тканях каждого сорта, и численностью протопластов, реагирующих на КСГ (r = = 0, 942), причем сорт с более высоким процентом сверхчувствительно реактивных клеток в тканях дает и более реактивные к КСГ протопласты; 2) протопласты активно реагируют на КСГ других непатогенных грибов, которые имеют глюканы и целлюлозу как основные компоненты клеточной стенки и способны вызывать побурение тканей или накопление фитоалексинов; 3) некоторые ингибиторы метаболизма — NaN3, 2, 4-ДНФ, многие SH-связывающие реагенты, которые подавляют сверхчувствительную гибель клеток, вызванную заражением ткани, также сильно ингибируют реакцию протопластов на КСГ. Это действие ингибиторов системы, генерирующей АТФ, свидетельствует о том, что реакция протопластов на КСГ может быть активной, энергопотребляющей ответной реакцией, подобно гибели клеток в ткани. Подавление реакции протопластов путем непродолжительной обработки высокомолекулярным SH-связывающим реактивом — р-хлормеркурбензонной кислотой, связанной с декстраном, показывает, что некоторые компоненты цитоплазматической мембраны, имеющие SH-гpyп-пы, могут участвовать в реакции на КСГ; доля реактивных протопластов у каждого сорта, как уже отмечалось, тесно коррелирует с интенсивностью устойчивости (r = 0, 919).
Таким образом, реакция изолированных протопластов на КСГ, по-видимому, идентична сверхчувствительной гибели клеток, индуцируемой заражением несовместимой расой. Поэтому можно предполагать, что сверхчувствительная гибель клеток — это результат реакции распознавания клетками хозяина компонентов стенки внедряющихся патогенов. Толчок распознаванию может дать реакция между компонентом клеточной мембраны хозяина типа рецептора и компонентами на поверхности инфекционных гиф.
Phytophthora infestans часто ведет себя в растениях, не являющихся хозяевами (например, в сладком перце, в фасоли, сое, вигне, душистом горошке и др. ), так же, как и в устойчивых растениях-хозяевах (Доке и Сузуки, неопубл. данные). Во многих случаях гриб внедрялся в ткани нехозяина и вызывал реакцию сверхчувствительности, сходную с наблюдающейся у устойчивых хозяев. Более того, КСГ P. infestans индуцировали сверхчувствительную реакцию в тканях этих растений-нехо-зяев и в изолированных из них протопластах (Доке, неопубл. данные). Эти предварительные данные показывают, что многие растения способны реагировать сверхчувствительно на конкретный КСГ патогенных грибов.
Совместимость и подавление сверхчувствительной реакции
При совместимых взаимодействиях P. infestans, не встречая динамических ответных реакций устойчивости, внедряется в клетки картофеля, способные отвечать сверхчувствительно на заражение несовместимыми расами или обработку КСГ. Клетки картофеля, зараженные совместимой расой, обычно выживают в течение нескольких дней. Таким образом, совместимые расы P. infestans, по-видимому, обладают системой, позволяющей им «сосуществовать» с тканями хозяина, которые способны распознавать компоненты грибной стенки как совместимых, так и несовместимых рас, реагировать сверхчувствительно и накапливать фитоалексины. Ранние наблюдения, что при заражении совместимыми расами происходит подавление реакции сверхчувствительности, а после последующей инокуляции несовместимыми расами — накопление фитоалексинов, натолкнули нас на мысль о том, что некое вещество может подавлять реакцию сверхчувствительности в восприимчивых тканях хозяина.
Далее мы показали, что высокомолекулярные компоненты из гомогенатов зооспор или жидкости, в которой они прорастали, подавляют сверхчувствительную реакцию клеток, зараженных несовместимыми расами, и не оказывают токсического действия на ткани. Хотя компоненты из совместимых рас более активны, чем из несовместимых рас, примеси в грибных препаратах не позволяют определить, зависит ли специфичность от количественных или от качественных различий.
Частично очищенные активные компоненты, полученные из зооспор, мицелия и жидкости, в которой прорастали споры, охарактеризованы как не-анионные и анионные глюканы, содержащие 17—23 глюкозных единицы с β(1—3)- и β( 1—6)-связями; анионный глюкан содержит один или два фосфатных остатка, этерифицированных в фосфорилмоноэфире
. Эти компоненты, изолированные из совместимых рас, более активно подавляли сверхчувствительную гибель клеток и накопление фитоалексинов, чем компоненты из несовместимых рас. Данные о высвобождении глюканов также в процессе прорастания цистоспор показывают, что эти соединения играют активную роль в подавлении сверхчувствительной реакции клеток хозяина в процессе инфекции.
В дальнейших экспериментах с использованием системы протопластов обнаружено, что глюканы из различных рас P. infestans эффективно ингибируют реакцию сверхчувствительности только у протопластов из соответствующих совместимых сортов картофеля. Протопласты, изолированные из r-сорта, восприимчивого ко всем испытанным расам, значительно слабее реагировали на КСГ после предварительной обработки глюканами из этих рас. Глюканы из рас 1, 2, 3, 4, к которым восприимчивы все сорта, эффективно подавляли реакцию сверхчувствительности протопластов каждого сорта. Эффект подавления зависит от концентрации глюканов при наличии линейной связи между логарифмом концентрации и степенью подавления. Каких-либо видимых изменений в протопластах глюканы не вызывали.
Таким образом, глюканы, ингибирующие распознавание грибных КСГ клетками хозяина, могут действовать как детерминанты расосортовой специфичности при фитофторозе картофеля. Подавление образования фитоалексинов в тканях, обработанных глюканами, скорее связано с отсутствием гибели клеток, чем с ка-ким-либо прямым ингибированием путей синтеза фито-алексинов. Действие глюканов на протопласты можно наблюдать лишь в течение 15 мин при применении до индукции реакции сверхчувствительности КСГ. Следовательно, сайт реагирования как для глюканов, так и для КСГ должен находиться на поверхности протопластов.
Возможный механизм совместимого и несовместимого распознавания
Запуск или погашение реакции сверхчувствительности может, вероятно, определять, как реагируют ткани картофеля на инфекцию — совместимо или несовместимо. Сверхчувствительная гибель клеток вызывается не-специфически не только КСГ из любой расы; физиологические и биохимические системы, необходимые для ее проявления, и синтез фитоалексина, по-видимому, присущи каждому сорту картофеля, независимо от наличия R-генов устойчивости к P. infestans. Поэтому эксперименты по определению основ расосортовой специфичности должны фокусироваться на выявлении сайтов распознавания для КСГ (фактор, индуцирующий сверхчувствительность, пли ФИС) и глюканов (фактор, ингибирующий сверхчувствительность, или ФСС), а также механизма взаимодействия между ними.
Клетки тканей картофеля способны к сверхчувствительной гибели в выдержанных дисках, где резко ингибирован синтез белка, следовательно, рецепторы КСГ в таких клетках мoгут быть конститутивными. Если КСГ из P. infestans смешивали с мембранной фракцией, изолированной из выдержанных дисков, активность, индуцирующая сверхчувствительность, сильно снижалась или исчезала, а вещества в смеси агглютинировали. Однако, если мембранную фракцию предварительно смешивали с глюканами из совместимых рас (но не из несовместимых), индуцирующая активность КСГ не изменялась. Эти результаты показывают, что глюканы из совместимых рас взаимодействуют с рецептором на мембране хозяина, вызывая ингибирование его реакции с КСГ.
В предварительных экспериментах по выделению из мембранной фракции тканей картофеля таких рецептороподобных компонентов обнаружено, что компоненты, осажденные ацетоном из обработанной детергентом мембранной фракции, содержат факторы, агглютинирующие КСГ без расосортовой специфичности. Добавление супрессивных глюканов даже из совместимых рас не ингибировало агглютинацию. Более того, глюканы также агглютинировали некоторые компоненты в супернатанте смеси, содержащей ацетоновые экстракты и насыщающие количество КСГ (Доке, неопубл. данные). Эти эксперименты позволяют предполагать, что существуют индивидуальные рецептороподобные компоненты для КСГ и глюканов. Следовательно, глюканы скорее могут связываться соответствующим рецептором на цитоплазматической мембране хозяина и вызывать изменения структуры или локализации рецептора КСГ, чем занимать сайт реагирования на КСГ.
Недавно установлено, что лектин картофеля агглютинирует КСГ из P. infestans так же, как и прорастающие цистоспоры, но без расосортовой специфичности . Агглютинацию ингибирует хитобиоза, специфический гаптен лектина картофеля. Прилипание инфекционных гиф P. infestans к цитоплазматической мембране хозяина, по-видимому, также происходит при помощи картофельного лектина, поскольку и этот процесс ингибируется хитобиозой. Подавление хито-биозой сверхчувствительной гибели клеток, обычно происходящей при заражении несовместимыми расами, очевидно, вызывается нарушением связывания поверхности инфекционной гифы цитоплазматической мембраной хозяина. Это связывание, вероятно, необходимо для того, чтобы произошла сверхчувствительная гибель клеток. Из приведенных экспериментов следует, что лектин картофеля может участвовать в распознавании ФИС в КСГ. Однако пока не ясно, играет ли молекула лектина непосредственную ключевую роль в инициации сверхчувствительной гибели клеток, поскольку природа компонентов КСГ, индуцирующих гибель клеток, также неизвестна.
Недавно установлено, что жирные кислоты КСГ, например эйкозатетраеновая и эйкозапентаеновая, являются активными индукторами фитоалексинов. Эти компоненты едва ли выделяются в процессе инфекции, так как жидкость, в которой прорастали споры гриба, не вызывает сверхчувствительной гибели клеток. Более того, ингибирование прикрепления инфекционных гиф к цитоплазматической мембране хозяина подавляет и гибель клеток. Все это позволяет предположить, что связывание углеводных остатков КСГ молекулой лектина на цитоплазматической мембране хозяина может индуцировать сверхчувствительную гибель клеток такими эффективными компонентами, как указанные жирные кислоты. Необходимы дальнейшие исследования механизма индукции или подавления сверхчувствительной гибели клеток.
Используемая литература: Инфекционные болезни растений: физиологические и биохимические основы/Пер. с англ. Л. Л. Великанова, Л. М. Левкиной, В. П. Прохорова, И. И. Сидоровой; Под ред. и с предисл.
Ю. Т. Дьякова. — М.: ВО Агропромиздат, 1985. — 367 с.
Скачать реферат:
Пароль на архив: privetstudent.com