Первая фаза взаимодействия между хозяином и патогеном происходит либо в растении, либо на его поверхности. Следует еще раз подчеркнуть, что иногда оно проявляется еще до установления физического контакта между двумя партнерами. Например, вещества, выделяемые хозяином, могут оказывать влияние на патоген. Оку предполагает, что при заболеваниях с выраженной специфичностью взаимоотношений в системе хозяин—патоген наиболее важной задачей патогенных организмов является подавление защитной реакции у их хозяина. Оку и его коллеги обнаружили супрессоры и элиситоры пизатина в жидкости прорастающих спор Mycosphaerella pinoides — патогена гороха, а также в прорастающих конидиях Erysiphe pisi. Образуемый М. pinoides супрессор F5 в концентрации 50 мкг/мл полностью подавлял образование пизатина. Более того, в этой же концентрации он обусловливал заражение листьев гороха непатогенными для него грибами, такими как Cochliobolus miyabeanus и Mycosphaerella melonis. На основании этих экспериментов авторы выдвинули предположение, что супрессоры, образуемые патогенами гороха, могут функционировать как детерминанты патогенности, блокируя общие защитные механизмы у некоторых растений. Все приведенные исследования показывают важность ранних стадий инфекционного процесса в развитии заболевания.
Процесс первичной инфекции мучнисторосяными грибами интенсивно изучался с начала этого столетия. Однако в большинстве исследований были использованы химически фиксированные образцы, не позволяющие получить ясного представления о явлениях, происходящих в живых системах хозяин—паразит. Проблему в значительной степени удалось решить путем использования клеток хозяина, например частично изолированного, однослойного эпидермиса колеоптилей ячменя, что позволило наблюдать за поведением гриба и связанными с ним реакциями хозяина непосредственно под световым микроскопом. Эта методика значительно расширила нашу осведомленность о явлениях, происходящих во время заражения ячменя и пшеницы грибом Erysiphe graminis. Основное внимание уделялось ранним стадиям заражения живых хозяев: образованию цитоплазматических агрегатов и папилл под влиянием аппрессориев Е. graminis. Однако в большей части этих исследовании были затронуты только процессы, протекающие в период от проникания аппрессориев до образования гаусторий. В данном обзоре рассмотрены в основном процессы, происходящие с момента прорастания конидий до проникания аппрессориев, причем особое внимание уделяется коротким ростковым гифам Е. graminis, не образующим аппрессориев.
Особенности прорастания конидий Е. GRAMINIS
Бесполые споры обычно способны к немедленному прорастанию, что приводит при благоприятных условиях к быстрому накоплению и распространению организма. Одноклеточные споры образуют одну или более ростковых трубок, которые удлиняются и развиваются в гифы. Перед прямым прониканием через кутикулу хозяина апексы ростковых гиф обычно вздуваются и образуют аппрессории, которые формируют отростки, проникающие в эпидермальные клетки.
Многие исследователи, изучавшие прорастание конидий Е. graminis, отмечали, что каждая конидия образует несколько ростковых гиф, и считали, что только одна из них интенсивно растет и образует типичный аппрессорий. Кроме того, аппрес-сорий рассматривали как единственную функциональную структуру гриба в инфекционном процессе; не развивающимся в аппрессорий ростковым гифам (неап-прессорнальные) как нефункциональным уделялось мало внимания.
Предполагалось, что оба типа ростковых гиф выходят из конидий одновременно. Однако Куно и др., изучая прорастание конидий на живых клетках колеоп-тиля ячменя, обнаружили, что появление неаппрессориальных ростковых гиф всегда опережает образование аппрессориальных приблизительно на 2 ч и оба типа гиф легко различаются уже при их появлении по следующим признакам: 1) первые остаются короткими и более тонкими, а вторые интенсивно удлиняются и утолщаются; 2) первые остаются несептированными, а вторые септированы у основания.
На листьях ячменя и пшеницы около 85% конидий Е. graminis f. sp. hordei и E. graminis f. sp. tritici через 24 ч после инокуляции образуют одну неаппрессориаль-ную ростковую гифу, а 13—16% конидий — более одной в дополнение к аппрессорию. Куно и др. с помощью сканирующего электронного микроскопа обнаружили, что одна из неаппрессориальных ростковых гиф прорывает стенку эпидермальной клетки хозяина и индуцирует в ней образование папиллы на 4—5 ч раньше, чем аппрессорий. При удалении ростковых гиф мик-ронглой в местах проникания были обнаружены поры. Неаппрессориальные ростковые гифы на основании выполняемых ими функций были названы первичными ростковыми гифами. Существуют два типа неаппрессориальных ростковых гиф: функциональные, или первичные, и, очевидно, нефункциональные. Первые способны к прочному прикреплению к поверхности хозяина в результате растворения восковых чешуек на кутикуле, индуцированию локальных реакций у нижележащих клеток хозянна и прободению стенок эпидермальных клеток хозяина. Вторые, наоборот, часто отделяются от поверхности хозяина и не имеют отмеченных выше способностей.
Терминология, применяемая к ростковым гифам из конидий Е. graminis, не установилась. Некоторые исследователи обозначают аппрессориальные ростковые гифы как первичные ростковые гифы, а неаппрессориальные — как вторичные, в то время как Куно и др. называют неаппрессориальные ростковые гифы первичными ростковыми гифами, исходя из их вышеуказанных особенностей.
Во избежание недоразумений для ростковых гиф предлагается (и используется в настоящем обзоре) следующая терминология: функциональные неаппрессо-рнальные ростковые гифы — первичные ростковые гифы; вероятно, нефункциональные — вспомогательные ростковые гифы; ростковые гифы, развивающиеся в аппрессорий, — аппрессориальные ростковые гифы. Когда аппрессориальные ростковые гифы отделяются от родительской конидии септой и образуют на своих вершинах крючки, то их часть от септы до кончика следует называть аппрессорием.
Появление цитоплазматического агрегата — это обычно первая видимая реакция клетки хозяина на присутствие первичной ростковой гифы. Недавно мы обнаружили, что округлые зоны клеточной стенки хозяина, образующиеся под первичной ростковой ги-фой, перед появлением цитоплазматических агрегатов аутолюминесцируют. Через 1—2 мин после появления аутолюминесценции начинают образовываться цитоплазматические агрегаты (неопубл. данные). Они видны только под первичными ростковыми гифами даже при наличии вспомогательных ростковых гиф. Продолжительность существования цитоплазматических агрегатов варьирует от 10 до 200 мин. Иногда под первичными ростковыми гифами видны папиллы, но настолько мелкие, что время их появления определить трудно. Бушнелл и Зейен отмечали случайное появление мелких цитоплазматических агрегатов в клетках хозяина под кончиками маленьких вторичных (согласно настоящей терминологии — первичных) ростковых гиф, которые часто формировались на конце конидии против аппрессориальной ростковой гифы. Кроме того, при наблюдении под электронным микроскопом такие же агрегаты были видны непосредственно под конидией. На основании этих данных авторы пришли к заключению, что для стимуляции появления небольших количеств цитоплазматических агрегатов присутствие ап-прессориев гриба не обязательно. В то же время первичные ростковые гифы, вырастающие с нижней стороны конидий, можно было увидеть, только сдвинув сначала их в сторону с помощью микроманипулятора. Таким образом, цитоплазматические агрегаты под конидиями, обнаруженные Бушнеллом и Зейеном, вероятно, связаны с появлением первичных ростковых гиф непосредственно из-под конидий. Хотя первичные ростковые гифы и прободают стенки эпидермальных клеток, они никогда не образуют гаусторий. До сих пор неизвестно, насколько глубоко проникают отростки первичных ростковых гиф в клетки хозяина, но имеющиеся сведения позволяют предположить, что клетки поражаются первичными ростковыми гифами на несколько часов раньше, чем аппрессориями.
Аппрессориальные ростковые гифы появляются из большинства конидий на колеоптилях ячменя в интервале между 3 и 3, 5 ч после инокуляции. Они удлиняются, их толщина увеличивается, и обычно через 10— 11 ч после инокуляции на разбухшей вершине образуется крючок. Снизу крючка выходит тонкий проникающий отросток, прорастающий через клеточную стенку хозяина. Один отростки задерживаются у папилл, другие продвигаются вглубь и образуют гаустории.
Передвижение веществ между клетками хозяина и конидиями перед образованием гаусторий
Большинство физиологических исследований Е. graminis было направлено на выяснение транспорта веществ из клетки хозяина к грибу через гаустории, накопления некоторых веществ в местах заражения и изменений метаболизма в клетке хозяина в связи с заражением. Основное внимание уделялось физиологическим аспектам более поздних, а не ранних стадий первичной инфекции. Исключение представляют проведенные недавно обширные исследования переноса вещества на ранних стадиях первичной инфекции от клетки хозяина к грибу и наоборот — перед образованием гаусторий.
При помещении инокулированных колеоптилей ячменя в воду, содержащую 5—10 мМ LiCl, появление аппрессориев из конидий было резко подавлено, но на образование первичных ростковых гиф обработка влияла в меньшей степени. Видимо, процессы прорастания, происходящие после выхода первичных ростковых гиф, более чувствительны к литию.
Рентгеновский микроанализ инокулированных листьев ячменя показал увеличение остаточных количеств Са и Si в конидиях во время или вскоре после индуцирования первичными ростковыми гифами локальной реакции (цитоплазматические агрегаты или папиллы) в эпидермальных клетках хозяина. Непосредственно перед индуцированием сходных реакций аппрессориями они достигают максимума. Как только аппрессории индуцировали образование папилл, уровень Са в конидиях снижался. Содержание Si изменялось аналогичным образом, но было выше, чем в непроросших конидиях. В период между 36 и 48 ч после инокуляции в ореоле вокруг места проникания можно обнаружить остаточные количества Si, но в конидиях или аппрессориях его нет (неопубл. данные). Эти наблюдения позволяют предположить возможный перенос Si из клетки хозяина в проросшую конидию и затем назад, в клетку хозяина.
Этим микроаналитическим рентгеновским исследованиям присущи недостатки, связанные с методикой используемой химической фиксации, при которой возможна утечка и (или) перераспределение элементов во время подготовки препаратов. Тем не менее они позволяют выяснить некоторые физиологические аспекты поведения Са и Si при прорастании и развитии конидий. Ватанабе, используя 45Са, обнаружил сходные изменения концентрации Са во время инфекционного процесса, вызванного Е. graminis. Дальнейший рентгеновский анализ воздушно-сухих, химически нефиксированных конидий показал, что в непроросших конидиях, еще прикрепленных к конидиеносцам, химические элементы распределяются почти равномерно. Следовательно, изменения уровней их содержания в прорастающей конидии могут отражать метаболические изменения, связанные с развитием конидий. Возможно, Са связан с нерастворимыми компонентами конидии или же сами компоненты могут изменяться во время ее развития. Аналогичный перенос веществ из клетки хозяина к грибу на одной из ранних стадий развития отмечен и в других системах хозяин — паразит. Эндрюс с помощью авторадиографии наблюдал, что ростковые гифы и аппрессорий Bremia lactucae перед прониканием накапливают метку 3Н-глюкозы, введенной в семядоли салата перед инокуляцией.
По последним данным Куно и Исидзакн, в период первичного заражения люминесцентный краситель передвигается от живых клеток хозяина к конидиям и наоборот. Конидии сначала инкубировали на колеопти-лях, плавающих в растворе СаСl2 с акридином оранжевым. Вскоре после образования аппрессориальной гифы отдельные конидии с первичной ростковой и аппрес-сориальной ростковой гифами микроманипуляционной иглой переносили на колеоптили, плавающие в растворе СаСl2 без красителя, инкубировали и затем с разными промежутками времени наблюдали под люминесцентным микроскопом. Акридин оранжевый, абсорбированный конидиями до переноса, впоследствии перемещался в аппрессории, выщелачивался из аппрессори-альных апексов и, наконец, проникал в папиллы и ореолы на клеточной стенке хозяина. Подобные перемещения красителя в живой системе хозяин — паразит совпадают с вышеописанными изменениями уровня содержания Са и Si в химически фиксированных конидиях на ранних стадиях первичной инфекции. Кроме того, этот эксперимент непосредственно доказывает возможность выделения вещества (или веществ) из апексов аппрессориев в стенки клеток хозяина в месте внедрения, хотя вывод, что это вещество может быть ферментом, разрушающим клеточные стенки хозяина, был бы преждевременным. Кроме того, возникло предположение, что по крайней мере некоторые компоненты папилл могут быть грибного происхождения, хотя многие исследователи склонны считать, что компоненты папилл имеют исключительно растительное происхождение.
Приведенные результаты позволяют считать, что конидии, прорастающие на поверхности растений, могут поглощать и высвобождать вещества на самых ранних стадиях инфекции. Пока еще нельзя утверждать, что перенос осуществляется с помощью первичной ростковой гифы. По-видимому, конидии абсорбируют вещества непосредственно через свои стенки. Первичные и аппрессориальные ростковые гифы образуются при прорастании конидий на стеклянных пластинах, и это дает основание предполагать, что первичные ростковые гифы играют важную роль в физиологии инфекционного процесса. Они могут выполнять исключительную роль в закреплении на поверхности растения. Тем не менее полученные результаты должны послужить основанием для будущих исследований первичной инфекции, вызываемой Е. graminis.
Необходимы ли первичные ростковые гифы для последующего развития е. graminis?
Первичные ростковые гифы выбранных конидий отделяли с помощью микроиглы от поверхности колеоп-тилей через 2, 4, 9 и 24 ч после инокуляции. Через 24 и 48 ч после инокуляции определяли частоту образования гаусторий и удлиняющихся вторичных гиф. Конидии сразу же лопались, если первичные ростковые гифы через 2—2, 5 ч после инокуляции механически отделяли от клеток хозяина, в которых формировались цитоплазматические агрегаты. Однако они не разрушались, если отделение проводили после окончания процесса образования цитоплазматических агрегатов. Экспериментальное отделение первичных ростковых гиф от поверхности хозяина на разных стадиях формирования инфекционных структур (через 4 ч после инокуляции и позднее) показало, что гифы мало влияют на дальнейшее развитие гриба (табл. 1).
Таблица 1 Влияние отделения первичной ростковой гифы от поверхности хозяина на дальнейший ход инфекционного процесса

Эти результаты подтверждены и другим экспериментом. Конидии, прораставшие на слюде и образовавшие первичные ростковые гифы и зачаток аппрессори-альной ростковой гифы, перенесли на колеоптили. Около 28% перемещенных конидий через 24 ч после инокуляции образовывали гаустории. Таким образом, контакт первичной ростковой гифы с поверхностью хозяина не обязателен для последующего образования гаусторий. Этот факт ставит нас в затруднительное положение, поскольку мы не знаем, как это связано с взаимным перемещением веществ между клетками хозяина и гриба на ранней стадии инфекционного процесса.
Восприимчивость клеток колеоптиля, пораженных первичной ростковой гифой
Как уже отмечалось, первичные ростковые гифы индуцируют образование цитоплазматических агрегатов и папилл в нижележащих клетках хозяина. Как связано это явление с восприимчивостью клеток хозяина?
Наш предварительный эксперимент (неопубл. данные) показал, что синтез коричной кислоты в первичных листьях ячменя усиливается только в интервале между 3 и 5 ч после инокуляции конидиями Е. graminis. По времени это совпадает с появлением цитоплазматических агрегатов под первичными ростковыми гифами.
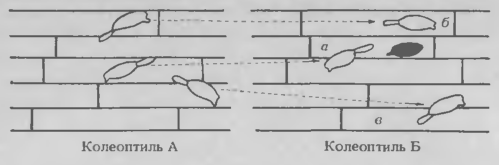
Рис. 1. Конидии с аппрессориальной ростковой гифой, проросшие на колеоптиле А, перенесены на клетку, поврежденную первичной ростковой гифой (а), соседнюю клетку (б) и неповрежденную клетку (в) колеоптиля Б, так чтобы аппрессории перенесенных конидий | могли внедриться в клетки а, б и в соответственно.
Пока еще не доказано, что такое изменение в метаболизме происходит в клетках колеоптиля, но наш эксперимент позволяет предположить зависимость между восприимчивостью клеток хозяина к грибу и прониканием первичных ростковых гиф. В подтверждение этой возможности был проведен следующий эксперимент (неопубл. данные) с использованием микромани-пуляционных методов (рис.1).
Колеоптиль А инокулировали конидиями на 3 ч раньше, чем колеоптиль Б. В интервале между 5 и 5, 75 ч после инкубации колеоптиля А отдельные кони-дии с первичной ростковой гифой и зачатком аппрессо-риальной перенесли на клетки колеоптиля Б, атакованные первичными ростковыми гифами, так чтобы ап-прессории перенесенных конидий могли внедриться в клетки хозяина, пораженные первичной ростковой гифой неперенесенных конидий. Таким же образом отдельные конидии были перенесены на клетки, расположенные рядом с поврежденными первичной ростковой гифой, и на неповрежденные клетки, расположенные на несколько клеток дальше. Через 18 ч отмечали процент образования гаусторий на колеоптиле-рецепторе. Аналогичные переносы провели с использованием других групп колеоптилей. Колеоптиль В инокулировали конидиями на час раньше, чем колеоптиль Г. В интервале между 5 и 5, 75 ч после инокуляции колеоптиля В отдельные конидии перенесли на поврежденные первичной ростковой гифой клетки, не поврежденные соседние и расположенные на некотором расстоянии клетки колеоптиля Г.

Рис 2. Влияние переноса проросшей конидии на поврежденную первичной ростковой гифой (ПРГ), соседнюю или неповрежденную ПРГ клетку на эффективность внедрения
Как видно из данных таблицы 2, образование гаусторий было незначительным в поврежденных первичными ростковыми гифами и соседних клетках, тогда как в неповрежденных оно составляло 46 %, если кони-дин переносили в интервале между 2 и 2, 75 ч после инокуляции колеоптиля-рецептора. Однако при переносе через 4—4, 75 ч после инокуляции колеоптиля-рецептора их доля составляла 37, 32 и 49% соответственно в пораженных первичной ростковой гифой, соседних и неповрежденных клетках. Первичные ростковые гифы, судя по наличию соответствующих цитоплазматических агрегатов, поражали клетки хозяина в среднем через 2, 5—3 ч после инокуляции, аппрессории перенесенных конидий проникали через 5—6 ч после переноса. Эти результаты показывают, что: 1) восприимчивость остается высокой до тех пор, пока первичная ростковая гифа не индуцирует устойчивость; 2) первичная ростковая гифа быстро вызывает появление устойчивости; 3) индуцированная устойчивость позднее исчезает, блокируется или подавляется. Подобные изменения восприимчивости на клеточном уровне перед внедрением аппрессориев представляют интерес для исследований.
Используемая литература: Инфекционные болезни растений: физиологические и биохимиче-
ские основы/Пер. с англ. Л. Л. Великанова, Л. М. Левкиной,
В. П. Прохорова, И. И. Сидоровой; Под ред. и с предисл.
Ю. Т. Дьякова. — М.: ВО Агропромиздат, 1985. — 367 с.
Скачать реферат:
Пароль на архив: privetstudent.com