Скачать:
ДОКЛАД
По дисциплине «Экология микроорганизмов»
«Метод микроскопических наблюдений. Особенности микроскопии микроорганизмов. Некультивируемые формы бактерий. Люминисцентно-микроскопические методы. Использование различных красителей. Иммунофлуоресцентные методы»
Содержание
1. Введение
2. Метод микроскопических наблюдений
3. Особенности микроскопии микроорганизмов
4. Некультивируемые формы бактерий
5. Люминисцентно-микроскопические методы. Иммунофлуоресцентные методы
6. Использование различных красителей
Введение
Экология микроорганизмов — это раздел общей экологии, изучающий место обитания микробов и их экологические связи. Основным положением является концепция о доминировании микробов в создании биосферы Земли и последующем поддержании ее экологического баланса. Указанная концепция базируется на представлении о микробах как о единственных живых обитателях Земли в период между 4×109 −0,5×109 лет назад, на повсеместном распространении микробов в биосфере, преобладании биомассы микробов над совокупной биомассой растений и животных, способности микробов трансформировать любые органические и неорганические вещества и включать химические элементы и энергию во все новые и новые циклы круговорота веществ и энергии, а также самостоятельно накапливать новую биомассу и осуществлять хотя и резко ограниченный, но полный цикл круговорота азота, углерода и некоторых др. элементов, поддерживать радиационный (тепловой) баланс Земли. Такая важная роль микробов обеспечивается массовостью популяций, высокими темпами их роста и размножения, способностью переходить и длительное время находиться в состоянии покоя, относительно высокой устойчивостью к повреждающим факторам внешней среды, чрезвычайным разнообразием в физиологических потребностях, небольшими размерами и массой, определяющими возможность их широкой миграции с воздушными, водными и биогенными потоками. Прикладная экология микроорганизмов решает задачи:
1)Защиты микробных популяций и биоценозов, принимающих участие в поддержании экологического баланса (азотфиксирующих, аммонифицирующих, нитрифицирующих и др.), от неблагоприятного воздействия хозяйственной деятельности человека;
2) Предупреждения микробной деградации живой и неживой природы и различных антропогенных материалов (например, профилактика болезней людей, животных, растений, сохранение продовольственных товаров, промышленных материалов и др.);
3) Микробного синтеза необходимых человеческому обществу материалов и веществ (напр., синтез микробного белка);
4) Защиты биосферы Земли от искусственных мутантов и заноса жизни из космоса и выноса жизни с Земли в космос;
5) Важный раздел экологии микроорганизмов — исследование экологических связей.
Метод микроскопических наблюдений
Микроскопические наблюдения — способы изучения очень мелких, неразличимых невооруженным глазом объектов с помощью микроскопов. Широко применяются в бактериологических, гистологических, цитологических, гематологических и других исследованиях.
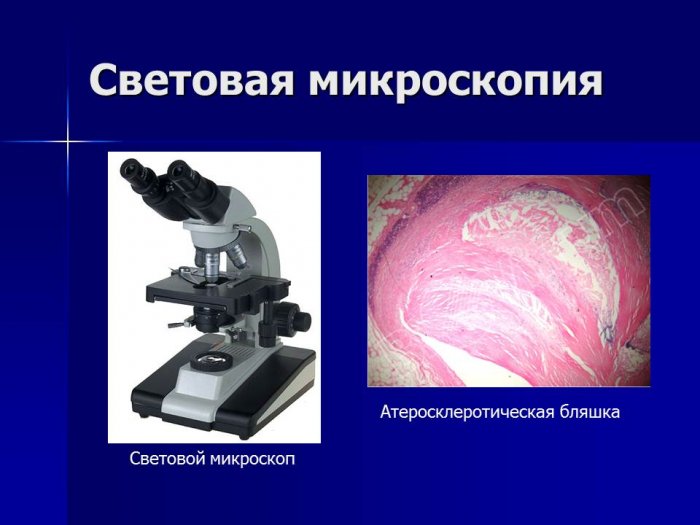
Обычная световая микроскопия предназначена для изучения окрашенных препаратов на предметных стеклах. С помощью световой микроскопии можно исследовать подвижность микроорганизмов. Для этого применяют метод висячей капли. Небольшую каплю микробной взвеси наносят на середину покровного стекла. Предметное стекло с углублением («лункой»), края которого смазаны вазелином, осторожно накладывают на покровное стекло так, чтобы капля исследуемой жидкости оказалась в центре углубления, плотно прижимают к стеклу и быстро переворачивают кверху. Для исследования препарата используют иммерсионный объектив, который погружают в иммерсионное масло на покровном стекле.
Помимо световой существуют фазово-контрастная, темнопольная (ультрамикроскопия), люминесцентная, поляризационная, ультрафиолетовая и электронная микроскопия.
Фазово-контрастная микроскопия основана на интерференции света: прозрачные объекты, отличающиеся по показателю преломления от окружающей среды, выглядят либо как темные на светлом фоне (позитивный контраст), либо как светлые на темном фоне (негативный контраст). Фазово-контрастная микроскопия применяется для изучения живых микроорганизмов и клеток в культуре ткани.
Темнопольная микроскопия (ультрамикроскопия) основана на рассеянии света микроскопическими объектами (в т. ч. теми, размеры которых меньше предела разрешения светового микроскопа). При темнопольной микроскопии в объектив попадают только лучи света, рассеянного объектами при боковом освещении (аналогично эффекту Тиндаля, примером которого является обнаружение пылинок в воздухе при освещении узким лучом солнечного света). Прямые лучи от осветителя в объектив не попадают. Объекты при темнопольной микроскопии выглядят ярко светящимися на темном фоне. Применяется темнопольная микроскопия преимущественно для изучения спирохет и обнаружения (но не изучения морфологии) крупных вирусов.
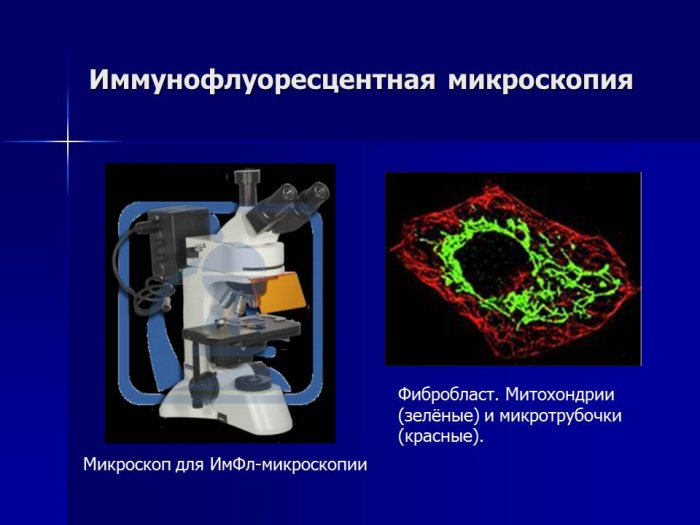
В основе люминесцентной микроскопии лежит явление люминесценции, т. е. способности некоторых веществ светиться при облучении их коротковолновой (сине-фиолетовой) частью видимого света либо ультрафиолетовыми лучами с длиной волны, близкой к видимому свету. Люминесцентная микроскопия используется в диагностических целях для наблюдения живых или фиксированных микроорганизмов, окрашенных люминесцирующими красителями (флюорохромами) в очень больших разведениях, а также при выявлении различных антигенов и антител с помощью иммунофлюоресцентного метода.
Поляризационная микроскопия основана на явлении поляризации света и предназначена для выявления объектов, вращающих плоскость поляризации. Применяется в основном для изучения митоза.
В основе ультрафиолетовой микроскопии лежит способность некоторых веществ (ДНК, РНК) поглощать ультрафиолетовые лучи. Она дает возможность наблюдать и количественно устанавливать распределение этих веществ в клетке без специальных методов окраски. В ультрафиолетовых микроскопах используется кварцевая оптика, пропускающая ультрафиолетовые лучи.
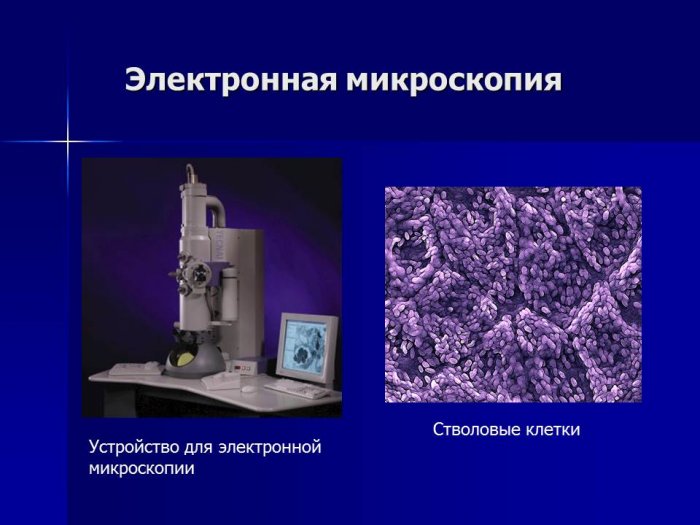
Электронная микроскопия принципиально отличается от световой как устройством электронного микроскопа, так и его возможностями. В электронном микроскопе вместо световых лучей для построения изображения используется поток электронов в глубоком вакууме. В качестве линз, фокусирующих электроны, служит магнитное поле, создаваемое электромагнитными катушками. Изображение в электронном микроскопе наблюдают на флюоресцирующем экране и фотографируют. В качестве объектов используют ультратонкие срезы микроорганизмов или тканей толщиной 20- 50 нм, что значительно меньше толщины вирусных частиц. Высокая разрешающая способность современных электронных микроскопов позволяет получить полезное увеличение в миллионы раз. С помощью электронного микроскопа изучают ультратонкое строение микроорганизмов и тканей, а также проводят иммунную электронную микроскопию.
Особенности микроскопии микроорганизмов
Особенность микроскопирования микробов — применение исключительно иммерсионной системы, состоящей из исследуемого объекта, иммерсионных масла и объектива. Преимущество этой системы заключается в том, что между объектом на предметном стекле и фронтальной линзой объектива находится среда с одинаковым показателем преломления (кедровое, вазелиновое масло и др.). Благодаря этому достигается наилучшее освещение объекта, так как лучи не преломляются и попадают в объектив. При обычной световой микроскопии наблюдаемый объект (в том числе и микробы) рассматриваются в проходящем свете. Поскольку микробы, как и другие биологические объекты, малоконтрастны, то для лучшей видимости их окрашивают. С целью расширения границы видимости применяют другие виды световой микроскопии. Темнопольная микроскопия — метод микроскопического исследования объектов, не поглощающих свет, плохо видимых при методе светлого поля. При темнопольной микроскопии объекты освещаются косыми лучами или боковым пучком света, что достигается при помощи специального конденсора — так называемого конденсора темного поля. При этом в объектив микроскопа попадают только лучи, рассеянные объектами, находящимися в поле зрения. Поэтому наблюдатель видит эти объекты ярко светящимися на темном фоне. Темнопольную микроскопию применяют для прижизненного изучения трепонем, лептоспир, боррелий, жгутикового аппарата бактерий. Фазово-контрастная микроскопия — метод микроскопического наблюдения прозрачных, неокрашенных, не поглощающих света объектов, основанный на усилении контраста изображения. Прозрачные неокрашенные объекты (в том числе живые микроорганизмы) отличаются от окружающей среды по показателю преломления, не поглощают свет, но изменяют его фазу. Эти изменения не улавливаются глазом. При фазово-контрастной микроскопии свет, не поглощенный объектом, проходит через так называемое фазовое кольцо, нанесенное на одну из линз объектива. Фазовое кольцо смещает фазу этого проходящего света на четверть длины волны и снижает его интенсивность. Прохождение прямого, не поглощенного объектом света через фазовое кольцо обеспечивается кольцевой диафрагмой конденсора. Лучи, даже немного отклоненные (рассеянные) в препарате, не попадают в фазовое кольцо и не претерпевают сдвига фазы. В результате разность фаз между отклоненными и неотклоненными лучами усиливается, давая контрастное изображение структуры препарата. Фазово-контрастную микроскопию используют для прижизненного изучения бактерий, грибов, простейших, клеток растений и животных.
Некультивируемые формы бактерий
У многих видов грамотрицательных бактерий, в том числе у патогенных (шигеллы, сальмонеллы, холерный вибрион и др.) существует особое приспособительное, генетически регулируемое состояние, физиологически эквивалентное цистам, в которое они могут переходить под влиянием неблагоприятных условий и сохранять жизнеспособность до нескольких лет. Симбиоз нескольких видов бактерий, используемых в медикаментах, хорошо помогает при лечении ВСД (вегетососудистой дистонии) и других заболеваний.
Главная особенность этого состояния заключается в том, что такие бактерии не размножаются и поэтому не образуют колоний на плотной питательной среде. Такие не размножающиеся, но жизнеспособные клетки получили название некультивируемых форм бактерий (НФБ). Клетки НФБ, находящиеся в некультивируемом состоянии (НС), обладают активными метаболическими системами, в том числе системами переноса электронов, биосинтеза белка и нуклеиновых кислот, и сохраняют вирулентность. Их клеточная мембрана более вязкая, клетки обычно приобретают форму кокков, имеют значительно уменьшенные размеры. НФБ обладают более высокой устойчивостью во внешней среде и поэтому могут переживать в ней длительное время (например, холерный вибрион в грязном водоеме), поддерживая эндемическое состояние данного региона (водоема).
Для обнаружения НФБ используют молекулярно-генетические методы (ДНК—ДНК-гибридизация, ЦПР), а также более простой метод прямого подсчета жизнеспособных клеток. С этой целью к исследуемому материалу добавляют в небольшом количестве питательные вещества (дрожжевой экстракт) и налидиксовую кислоту (для подавления синтеза ДНК) на несколько часов.
Клетки усваивают питательные вещества и увеличиваются в размерах, но не делятся, поэтому такие увеличенные клетки четко видны в микроскоп и их легко подсчитать. Для этих целей можно использовать также методы цитохимические (образование формазана) или микроауторадиографии. Генетические механизмы, обусловливающие переход бактерий в НС и их реверсию из него, не ясны.
Люминисцентно-микроскопические методы.
Иммунофлуоресцентные методы.
Люминесцентная микроскопия основана на свойстве некоторых веществ давать свечение — люминесценцию в УФ-лучах или в сине-фиолетовой части спектра. Многие биологические вещества, такие как простые белки, коферменты, некоторые витамины и лекарственные средства, обладают собственной (первичной) люминесценцией. Другие вещества начинают светиться только при добавлении к ним специальных красителей — флюорохромов (вторичная люминесценция). Флюорохромы могут распределяться в клетке диффузно либо избирательно окрашивают отдельные клеточные структуры или определенные химические соединения биологического объекта. На этом основано использование люминесцентной микроскопии при цитологических и гистохимических исследованиях. С помощью иммуно-флюоресценции в люминесцентном микроскопе выявляют вирусные антигены и их концентрацию в клетках, идентифицируют вирусы, определяют антигены и антитела, гормоны, различные продукты метаболизма и т. д. В связи с этим люминесцентную микроскопию применяют в лабораторной диагностике таких инфекций, как герпес, эпидемический паротит, вирусный гепатит, грипп и др., используют в экспресс-диагностике респираторных вирусных инфекций, исследуя отпечатки со слизистой оболочки носа больных, и при дифференциальной диагностике различных инфекций. В патоморфологии с помощью люминесцентной микроскопии распознают злокачественные опухоли в гистологических и цитологических препаратах, определяют участки ишемии мышцы сердца при ранних сроках инфаркта миокарда, выявляют амилоид в биоптатах тканей и т. д.
В лабораторной практике применяют также иммунофлуоресцентный метод Кунса, когда с помощью флуоресцирующего красителя, присоединенного к молекуле антитела, реакция антиген — антитело становится видимой в люминесцентный микроскоп.
В отличие от других серологических реакций, когда о соединении антигена с антителом судят по вызываемому им вторичному эффекту (агглютинации, преципитации и др.), иммунофлуоресцентный метод позволяет непосредственно наблюдать происходящую реакцию и, следовательно, судить о наличии и локализации антигена.
В настоящее время большое распространение приобретает иммуноферментный метод, обладающий высокой чувствительностью и универсальностью. Этот метод основан на определении антигенов при помощи иммуносорбента, связанного с ферментом. Такая реакция между антигеном и антителом получила название ELISA (enzyme-linked immunosorbent assay).
Например, если надо обнаружить антиген в клетке при наличии соответствующего гомологичного антитела, можно соединить фермент ковалентно с антителом и затем этим антителом, меченным ферментом, прореагировать с антигеном.
Самый чувствительный, позволяющий обнаружить малое содержание антигенов (0,5 нг/мл),— радиоиммунный метод, однако он требует специального оборудования.
Перечисленные методы имеют ряд преимуществ перед бактериологическим. Это методы экспресс-диагностики, позволяющие определить антигены возбудителей в течение нескольких минут или часов.
Использование различных красителей
Окраска микроорганизмов — наиболее распространенный в микробиологии комплекс методов и приемов, применяемый для обнаружения и идентификации микроорганизмов с помощью микроскопа. В нативном (естественном) состоянии бактерии имеют такой же коэффициент преломления, как и стекло, поэтому они невидимы при микроскопическом исследовании. Окраска микроорганизмов позволяет изучить морфологические особенности микробов, а иногда точно определить их вид, например некоторые микробы — одинаковые по морфологии — различно окрашиваются с помощью одних и тех же сложных методов окраски.
Окраска микроорганизмов представляет собой физико-химический процесс соединения химических компонентов клетки с краской. В ряде случаев различные части микробной клетки (ядро, цитоплазма) избирательно окрашиваются различными красителями. Наиболее пригодными для окраски микроорганизмов являются анилиновые краски, главным образом основные и нейтральные, кислые краски менее пригодны.
Приготовление окрашенного препарата включает ряд этапов:
1) приготовление мазка;
2) высушивание мазка;
3) фиксацию мазка;
4) окраску;
5) высушивание.
Мазок готовят на чистых предметных стеклах, на середину которых наносят небольшую каплю воды и в нее с помощью бактериологической петли помещают исследуемый материал. Материал распределяют на стекле равномерным тонким слоем, размер мазка —1—2 см2.
Препарат обычно высушивают при комнатной температуре на воздухе. Для ускорения высушивания допускается подогревание мазка в струе теплого воздуха высоко над пламенем горелки.
Высушенный мазок подвергается фиксации, при которой мазок прикрепляется к стеклу (фиксируется), а микробы становятся более восприимчивыми к окраске. Способов фиксации много. Наиболее простой и распространенный — фиксация жаром — нагревание на пламени горелки (препарат проводят несколько раз через наиболее горячую часть пламени горелки). В ряде случаев прибегают к фиксации жидкостями (этиловый или метиловый спирт, ацетон, смесь равных объемов спирта и эфира — по Никифорову). После фиксации мазок окрашивают. Количество краски, наносимое на препарат, должно быть таким, чтобы покрыть всю поверхность мазка. По истечении срока окрашивания
Существуют простые, сложные и дифференциальные способы окрашивания микробов. При простой окраске обычно употребляют одну краску, чаще всего красную — фуксин, или синюю — метиленовый синий. Фуксин красит быстрее
Сложные способы окраски, при которых применяются два или более красителя, являются ценными методами, используемыми в микробиологической диагностике инфекционных болезней.
Наибольшее практическое значение имеет окраска по Граму и окраска по Цилю.
Метод окраски по Цилю является основным для окраски кислотоустойчивых бактерий. Здесь применяются два красителя: карболовый фуксин Циля и метиленовый синий. Кислотоустойчивые бактерии окрашиваются в красный цвет, все некислотоустойчивые формы — в синий.
Метод Грама — метод окраски микроорганизмов для исследования, позволяющий дифференцировать бактерии по биохимическим свойствам их клеточной стенки. Окраска по Граму имеет большое значение в систематике бактерий, а также для микробиологической диагностики инфекционных заболеваний.
Грамположительны кокковые (кроме представителей рода Neisseria) и спороносные формы бактерий, а также дрожжей, они окрашиваются в иссиня-чёрный (тёмно-синий) цвет.
Грамотрицательны многие неспороносные бактерии, они окрашиваются в красный цвет, ядра клеток приобретают ярко-красный цвет, цитоплазма — розовый или малиновый.
Окраска по Граму относится к сложному способу окраски, когда на мазок воздействуют двумя красителями, из которых один является основны́м, а другой — дополнительным. Кроме красящих веществ при сложных способах окраски применяют обесцвечивающие вещества: спирт, кислоты и др.
Для окраски по Граму чаще используют анилиновые красители трифенилметановой группы: генциановый, метиловый фиолетовый или кристаллвиолет. Грамположительные Грам (+) микроорганизмы дают прочное соединение с указанными красителями и йодом. При этом они не обесцвечиваются при воздействии на них спиртом, вследствие чего при дополнительной окраске фуксином Грам (+) микроорганизмы не изменяют первоначально принятый фиолетовый цвет.
Грамотрицательные Грам (−) микроорганизмы образуют с основными красителями и йодом легко разрушающееся под действием спирта соединение. В результате микробы обесцвечиваются, а затем окрашиваются фуксином, приобретая красный цвет.
Скачать: