Как изучают белки
Для изучения любого процесса, происходящего в клетках, субклеточных структурах (например, в митохондриях) или тканях, необходимо выделить компоненты, которые обеспечивают протекание химических реакций. Для этого следует разрушить клетки или клеточные органеллы физическими методами. Животные клетки разрушаются довольно легко, а бактериальные и растительные клетки — с трудом, так как они имеют прочную стенку.
Весь процесс выделения белков и изучения их современными методами можно представить следующей упрощенной схемой:
а) разрушение клеток или внутриклеточных структур;
б) выделение из клеток нужных органелл или частиц;
в) разделение компонентов органелл и их выделение, например белков;
г) изучение химических и физических свойств различными способами (хроматография, электрофорез, спектральные, радиоизотопные и другие методы).
Рассмотрим эти этапы.
Разрушение клеток
Сначала клетки разрушали, растирая их с песком в ступке. Однако в наше время применяют более эффективные методы, хотя и традиционным еще пользуются при работе с растительными и бактериальными клетками. Разновидностью этого метода является продавливание клеток, смешанных с кристалликами льда или другими острыми частичками, через пресс. Очень часто разрушение
клеток производят при вращении острых лопастей в цилиндре аппарата, похожего на миксер (гомогенизатор), или при движении плотно прилегающего вращающегося поршня вверх и вниз в сосуде с суспензией клеток. Суспензию клеток можно обработать ультразвуком, что тоже приводит к разрушению клеток. Но этот метод имеет существенный недостаток: в процессе обработки ультразвуком выделяется теплота, которая может повредить структуры, особенно белковые.
К другим методам разрушения тканей и клеток относятся последовательное замораживание и оттаивание, обработка ферментами, переваривающими клеточную стенку. Например, при обработке клеток бактерий лизсцимом ускоряется гидролиз клеточной стенки, освобождается внутриклеточная жидкость, содержащая необходимые белки. А метод «азотной бомбы» основан на интересном принципе. Клетки при высоком давлении насыщают газообразным азотом. Давление азота внутри клетки и давление вне ее становятся близкими по значению. После этого внешнее давление сбрасывают, а азот, находящийся внутри клетки, разрушает клеточную оболочку, «взрывает» ее.
Для выделения той или иной фракции выбирают определенную ткань. Например, печень животных — идеальный объект для выделения фракции митохондрий, где их особенно много, а тимус (зобная или вилочковая железа) — ядер и ядерных белков.
Из ткани, выбранной для получения белка или другого компонента, готовят однородную массу — гомогенат, от которого отделяют внутриклеточную жидкость. Для устранения местного нагревания, возникающего в процессе гомогенизации, все процедуры разрушения клеток и выделения белка проводят при пониженных температурах. Сосуды с гомогенатом помещают в холодильные камеры. Исследования проводят в комнатах-холодильниках, подготовку материала осуществляют на льду. Это необходимо потому, что белки при действии теплоты подвергаются денатурации, а ферменты могут потерять свою активность в процессе выделения — инактивироваться. Так как для выделения белков берут ткани, различные по плотности, количеству в них сосудов и соединительнотканных включений, воды, жира и т. д., необходимо тщательно контролировать условия разрушения клеток: продолжительность гомогенизации, температуру, скорость разрушения. Этот тонкий процесс, как считают специалисты, не только наука, но и искусство.
Разделение частиц путем центрифугирования
Следующий этап выделения биологических структур после разрушения клеток — центрифугирование. Этот метод уже встречался нам, когда говорилось о размерах и массе биологических макромолекул. Таким способом можно также выделять определенный биологический материал из гомогената для последующих исследований. Это препаративное центрифугирование, т. е. направленное на выделение какого-то препарата из гомогенной массы, например препарата митохондрий или микросом. Гомогенат центрифугируют в пробирках при определенном числе оборотов. В результате нескольких циклов можно получить сначала самые тяжелые частицы (например, ядра). После их отделения гомогенат центрифугируют при большем числе оборотов и получают новый осадок из частиц, которые легче первого осадка, но тяжелее тех, которые остались в суспензии над ним. Затем из более легких фракций выделяют макромолекулы, специфические для этого осадка, например митохондриальные белки. Принцип дифференциального центрифугирования показан на рисунке 1.
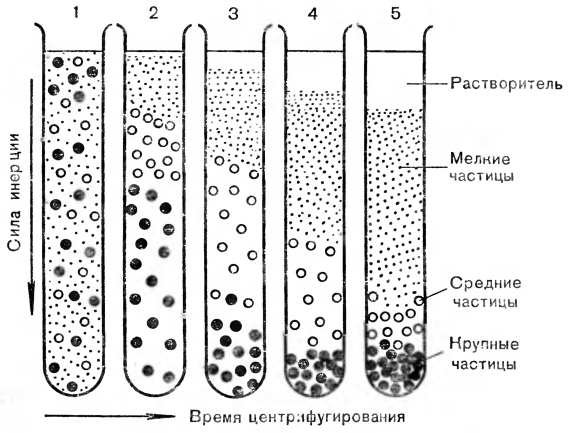
Рис. 1. Разделительное центрифугирование: 1 — хаотическое распределение в пробирке разделяемых частиц; 2—4 — промежуточные стадии центрифугирования; 5 — осаждение в конце центрифугирования в зависимости от размеров и форм частиц.
Поэтому, когда говорят о ядерных белках или о ферментах лизосом, всегда предполагается, что сначала были выведены сами препараты ядер и лизосом методом дифференциального (разделительного) центрифугирования, а уже затем проводилась работа с белками этих фракций.
Препаративное центрифугирование имеет несколько модификаций, одной из которых является равновесное центрифугирование. Его принцип заключается в том, что белок, ДНК или липопротеид смешивают в пробирке с концентрированным раствором сахарозы или другого вещества, обладающего большой плотностью. В процессе центрифугирования молекулы исследуемого вещества окажутся в той зоне пробирки, где будет одинаковая с ними по плотности зона сахарозы. Этим методом были разделены и затем изучены различные фракции липопротеид ов плазмы крови человека (рис. 2).
Извлечение отдельных фракций из пробирок проводят разными приемами, в частности используют полиэтиленовые пробирки, которые после окончания центрифугирования прокалывают в основании иглой и отбирают по каплям каждую фракцию в отдельные стаканы.
Центрифугирование применяется очень широко. Оно используется (кроме уже перечисленных примеров) для оценки чистоты белков, вирусов, препаратов ДНК. О чистоте препарата судят по характеру границы между фракциями при центрифугировании: чистый препарат дает одну резко очерченную границу.
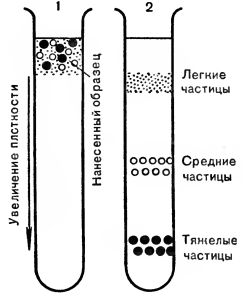
Рис. 2. Центрифугирование веществ согласно их плотности (пробирка наполнялась жидкостью так, что внизу плотность жидкости значительно больше, чем вверху): 1—начало центрифугирования; 2 — посте центрифугирования.
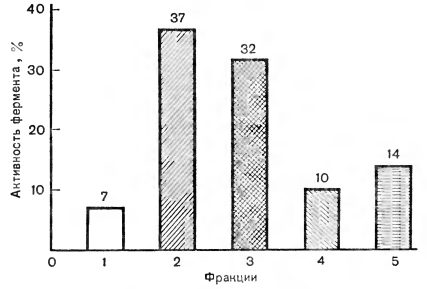
Рис. 3. Зависимость активности фермента глицерофосфатазы от его местонахождения в клетках печени: 1 — в ядре; 2 - в митохондриях; 3— в лизосоме; 4— в эидоплазматической сети; 5— в цитоплазме (за 100 % принята активность фермента в целой клетке)
Центрифугирование помогает следить за изменением конформации белков, распадом белков на субъединицы, образованием комплекса фермента с субстратом, приведшим к изменению формы и размера белка.
На рисунке 3 показано, как меняется активность фермента глицерофосфатазы от его местонахождения. Такой график дает возможность визуально оценить, в какой фракции было большее количество белка-фермента.
Несколько слов следует сказать о центрифугах. Различают центрифуги общего назначения, скоростные центрифуги и ультрацентрифуги. Центрифуги общего назначения дают максимальную скорость 6000 об/мин, их роторы крепятся жестко на моторе, емкость центрифужных пробирок или стаканов достаточно велика.
Скоростные центрифуги отличаются тем, что дают предельную скорость до 25 000 об/мин и снабжены системой охлаждения, которая предотвращает нагревание ротора и биологического материала в нем при вращении. Ультрацентрифуги дают предельную скорость до 75 000 об/мин. Такие центрифуги снабжены не только системой охлаждения, но и вакуумной установкой, чтобы предотвратить перегрев ротора за счет трения его о воздух.
Хроматографические методы
Одним из наиболее удобных методов разделения биологических соединений является хроматография. Разнообразие ее видов и модификаций позволяет сделать выбор, который зависит от природы выделяемого материала.
С помощью хроматографических методов можно разделить как большие, так и малые количества биологического материала (несколько пикограммов).
Хроматографическая система состоит из двух фаз: неподвижной и подвижной, которая течет по неподвижной или пропускается через нее. Разделение веществ между фазами может происходить за счет адсорбции (адсорбционная или распределительная хроматография), равновесного распределения (хроматография на бумаге), ионообменного равновесия и других модификаций хроматографического метода. Рассмотрим принципы некоторых из этих модификаций.
Адсорбционная (распределительная) хроматография была применена М. Цветом в 1903 г. для разделения окрашенных веществ. Колонка для хроматографии представляет собой стеклянную трубку, заполненную адсорбентом. В нее вносят смесь, которую требуется разделить, после чего начинают пропускать растворитель. Вещества, входящие в смесь, продвигаются по колонке с разными скоростями. В случае окрашенных компонентов разделение легко обнаружить по отдельным цветным зонам. Зоны — участки адсорбента — извлекают из колонки, отделяют подвижную фазу от неподвижной и анализируют вещество.
Связавшиеся с адсорбентом вещества можно отделить от него, пропуская через колонку растворители разной полярности: гексан, бензол, эфир, хлороформ, бутанол, ацетон или их определенную смесь.
Очень интересная и важная разновидность распределительной хроматографии — хроматография на бумаге (рис. 4). Пористая бумага способна поглощать воду и удерживать ее между волокнами целлюлозы. Это неподвижная фаза. Если по такой бумаге движется неводный растворитель, он увлекает за собой молекулы вещества, нанесенные на бумагу. Разделение зависит от сродства компонентов нанесенной смеси к тому или иному растворителю: чем выше растворимость вещества в подвижной фазе, тем быстрее и дальше оно продвинется от места нанесения образца вместе с растворителем. Таким образом разделяют, например, смесь аминокислот и определяют, какие из них и в каком количестве входят в образец.
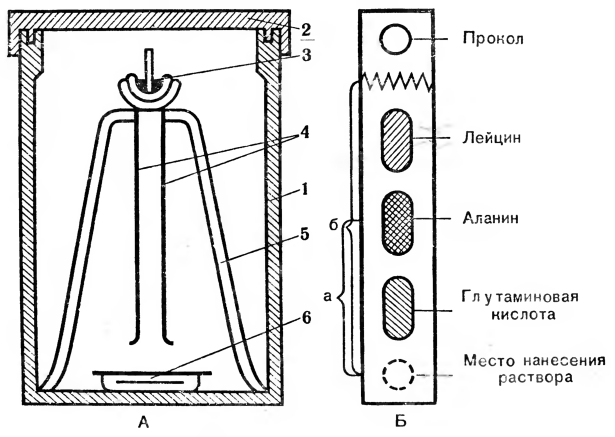
Рис. 4. Распределительная хроматография: А — прибор для хроматографии: 1 — камера: 2 — крышка; 3 — лодочка с растворителями; 4 — полоски хроматограммы; 5 — подставка для лодочки; 6 — кювета с растворителями для насыщения камеры; Б — бумажная полоска хроматограмма с окрашенными веществами: а—путь, пройденный веществом; б — путь, пройденный растворителем.
В зависимости от строения отдельных аминокислот, от их способности лучше растворяться в подвижной или неподвижной фазе можно вычислить отношение для каждой аминокислоты — Rf:
Rf=a/b
где а — расстояние, пройденное аминокислотой; b — расстояние, пройденное растворителем от точки нанесения образца.
Rf — постоянен для каждой аминокислоты и является характерным показателем при стандартных условиях опыта. Чтобы растворитель не испарялся, хроматографию проводят в закрытых камерах специального назначения. На рисунке 5 показан прибор для получения нисходящей хроматограммы. Несколько более усложненным вариантом хроматографического метода является проведение двумерной хроматографии. После разделения смеси на хроматографической бумаге в паре растворителей, например фенол — аммиак (рис. 6), хроматограмму поворачивают на 90° и продолжают разделение смеси уже в другом направлении и в других растворителях, например в бутанол-муравьиной кислоте. Такая модификация метода позволяет разделить даже те вещества, которые обладают сходными хроматографическими характеристиками и потому движутся на хроматограмме совсем рядом.
На рисунке 7 представлена радиальная хроматограмма на бумаге, где в смеси были только три аминокислоты. Чтобы разделить смесь на отдельные аминокислоты, определить, выделить в чистом виде и выявить их количество, поступают следующим образом. Из хроматографической бумаги вырезают круг, делят его на четыре сектора, на один из которых близко к центру наносят смесь, подлежащую разделению, на остальные три сектора наносят в таких же местах у центра эталонные растворы чистых индивидуальных аминокислот. В центре круга вырезают отверстие. В него вставляют небольшую бумажную ножку и опускают ее нижний конец в растворитель. Растворитель поднимается по ножке, достигает центра круга и по радиусам распространяется к периферии круга, увлекая аминокислоты. Через определенное время хроматограмму снимают и помещают в шкаф при температуре около 100 °С для фиксации аминокислот и испарения растворителя.
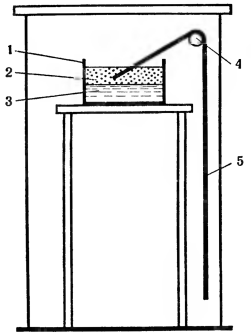
Рис. 5 Прибор для хроматографии на бумаге: 1 — лодочка с растворителями; 2 — органический растворитель; 3 — вода, 4 - стеклянный кронштейн; 5 - хроматографическая бумага.
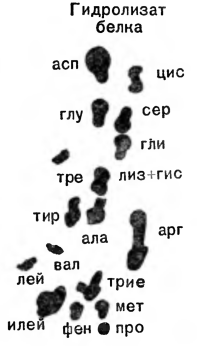
Рис. 6. Двумерная хроматография аминокислот.
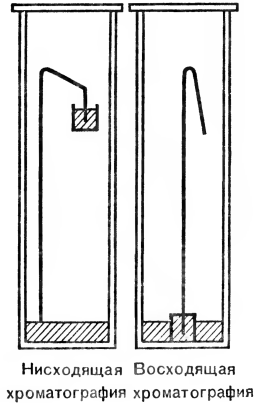
После этого хроматограмму проявляют специальным раствором, окрашивающим и выявляющим аминокислоты, и пятна аминокислот вырезают. Чтобы снять аминокислоту, бумагу опускают в стаканчик с растворителем. Чем выше будет интенсивность окраски раствора, тем больше в нем аминокислоты. На специальных приборах можно точно установить количество аминокислот по оптической плотности их растворов. Аминокислоты затем выделяют из растворов и используют в дальнейшей работе.
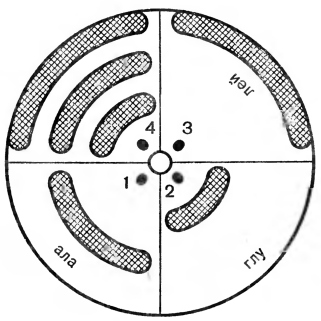
Рис. 7. Радиальная хроматограмма. Цифрами обозначены точки нанесения эталонных аминокислот (1, 2, 3) и определяемой смеси (4).
О том, какое пятно из сектора, где наносилась смесь, соответствует той или иной аминокислоте, судят по величине Rf, которую сравнивают с эталонными образцами, расположенными в соседних секторах. Таким простым методом или незначительно отличающимся по технике исполнения легко разделить аминокислоты, полученные при гидролизе белка, содержащиеся в сыворотке крови или моче больных.
Определение количества свободных аминокислот в крови очень важно для суждения об обмене белков. Например, в норме в сутки выделяется около 0,5 г аминокислот. При усиленном распаде белков, а также при некоторых заболеваниях печени, почек, при нарушении процессов дезаминирования или переамикирования в сыворотке крови и моче отмечаются изменения в количестве и составе аминокислот. Эти знания помогают своевременно и правильно назначить необходимое лечение.
Важнейшим и широко применяемым видом хроматографического метода является проникающая хроматография. Она отличается принципиально от других видов хроматографического анализа. Метод основан на свойствах многих пористых материалов пропускать небольшие молекулы и не пропускать крупные, т. е. действует принцип молекулярного сита. Такими пористыми материалами являются полисахаридные гели (декстраны), полистиролы, пористые стеклянные шарики со строго определенным размером пор.
Рассмотрим конкретный пример с применением проникающей хроматографии, которую еще называют гель-фильтрацией. Представим, что необходимо отделить белковые молекулы от аминокислот, солей и других низкомолекулярных соединений, находящихся в общей смеси. Для этого стеклянную хроматографическую колонку наполняют пористым гелем — сефадексом, закрепляют ее вертикально в штативе и наносят сверху смесь, подлежащую разделению. Опускаясь вниз, частички этой смеси проникают в пористые гранулы, которыми наполнена колонка, задерживаются там или переходят в следующие нижние слои. Так происходит с мелкими частицами смеси, размеры которых позволяют им проникать через поры внутрь гранул. Поэтому путь мелких частиц к выходу из колонки довольно длинный.
Крупные же частицы вместе с током растворителя быстро продвигаются к выходу из колонки между гранул.
Таким образом гель-фильтрацию можно назвать фильтрованием наоборот; крупные частицы проскакивают через молекулярное сито, а мелкие задерживаются, их путь длиннее (рис. 8).
При обычном фильтровании, как известно, через фильтр проходят мелкие частицы, а более крупные задерживаются. Такая разновидность хроматографии, как гель-фильтрация, позволяет очистить белки от низкомолекулярных соединений, дает возможность разделить и очистить вирусы, ферменты, гормоны, антитела, нуклеиновые кислоты.
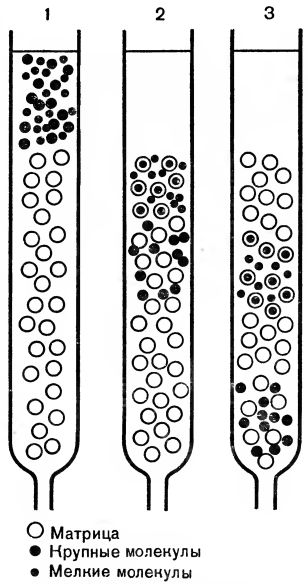
Рис. 8. Разделение веществ методом гель-фильтрации: 1, 2, 3 — последовательные стадии разделения. Крупные частицы не проникают в поры гранул матрицы и выходят раньше мелких из колонки.
Электрофорез
Как уже рассматривалось, аминокислоты, пептиды, белки и другие молекулы, выделенные из живых организмов, содержат заряженные группы, поэтому в растворе они могут быть катионами или анионами. Частицы в зависимости от своего заряда перемещаются в электрическом поле. На этом основан принцип широко применяемого в белковой химии метода — электрофореза. Скорость движения заряженных молекул зависит от многих причин: а) движущей силы электрического поля; б) значения заряда частиц; в) размеров заряженных молекул; г) формы перемещающихся в электрическом поле частиц и некоторых других факторов. Так как у различных молекул эти параметры отличаются, можно разделить их смесь на фракции путем электрофореза.
Разделение заряженных частиц проводят в каком-нибудь однородном носителе. Это хроматографическая бумага, тонкие слои оксидов кремния (IV) или алюминия, крахмальные или другие гели. На всех носителях вещества распределяются в электрическом поле в виде зон, которые можно обнаружить и выделить, поэтому метод получил название зонального электрофореза. Общие закономерности электрофореза следующие:
1) подвижность частиц возрастает с увеличением суммарного заряда;
2) чем больше размеры молекул, тем меньше их подвижность;
3) глобулярные и фибриллярные белки обладают разной подвижностью, обусловленной силой трения при перемещении;
4) скорость перемещения веществ прямо пропорциональна силе тока, а длина пройденного частицами пути прямо пропорциональна времени пропускания тока;
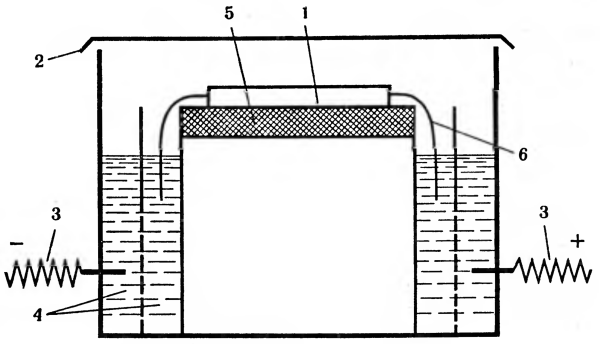
Рис. 9. Прибор для электрофореза: 1 — носитель; 2 — крышка; 3 — электроды; 4 — буферный раствор; 5 — изолятор; 6 — фитиль.
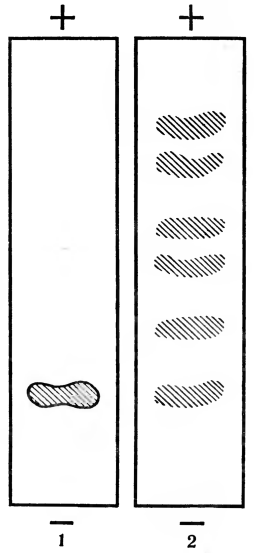
Рис. 10. Электрофорез на бумаге: 1 — полоска бумаги для электрофореза с нанесенным образцом для разделения; 2—та же полоска бумаги, окрашенная после электрофореза.
5) чем больше сопротивление, тем меньше скорость продвижения частиц в электрическом поле;
6) на подвижность частиц влияет состав растворителя, его концентрация и pH;
7) скорость перемещения зависит от химического состава носителя и его отношения к разделяемым частицам.
Для проведения электрофореза применяется несложное оборудование, состоящее из источника питания и электрофоретической камеры, в которой смонтированы электроды, опоры для носителя и камеры для раствора (рис. 9). Смесь, подлежащую разделению, наносят примерно посередине или ближе к одному из электродов в зависимости от предполагаемого направления движения. Часто в состав разделяемой смеси включают какой-нибудь инертный краситель, чтобы можно было следить за ходом электрофореза (движением полос).
Так как большинство биологических соединений не окрашено, после окончания электрофореза электрофореграмму окрашивают так же, как и хроматограмму. Это делает видимыми различные компоненты разделяемого образца (рис. 10, 11). Окрашенные полосы можно или вырезать и исследовать, или поместить в специальный прибор — денситометр и по интенсивности окраски определить количество того или иного белка, пептида или другого компонента смеси (рис. 12).
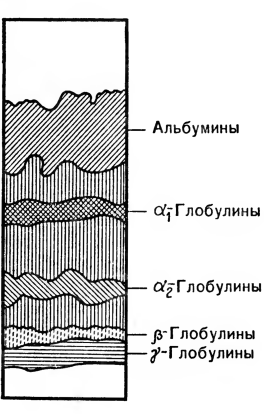
Рис. 11. Электрофореграмма сыворотки крови.
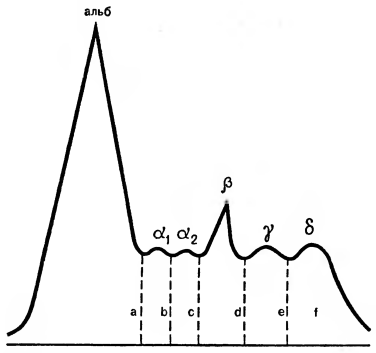
Рис. 12. Денситограмма плазмы крови человека: альб — альбумины; а1. а2 — глобулины; в — глобулины; у — глобулины; б — солевой рубец. Общая концентрация белка соответствует площади:
S=a+b+c+d+e+f
Рисунок получен на денситометре — приборе, определяющем оптическую плотность полученных после электрофореза фракций.
Метод электрофореза применяется очень широко. Электрофорез на бумаге используется для разделения аминокислот, пептидов, белков, нуклеиновых кислот и заряженных производных углеводов. Низковольтный электрофорез на бумаге сопровождается значительной диффузией частиц, что приводит к нечеткому их разделению, к «размытости» границ. При высоковольтном электрофоретическом разделении время процесса сводится до минимума, и поэтому диффузия значительно уменьшается. Вместо бумаги при электрофорезе часто применяют в качестве носителя ацетат целлюлозы. Преимущество этого соединения в том, что оно имеет высокую чистоту, дает меньшую адсорбцию образца, способствует лучшему разделению компонентов, обладает низким фоном окрашивания. Поэтому электрифорез на ацетате целлюлозы широко применяется в клинике дли разделения белков сыворотки крови и гемоглобинов, а также сложных белков глико и липопротеидов.
Концентрация аминокислот в плазме крови и моче при некоторых заболеваниях существенно отличается от нормы и может служить важным показателем при диагностике заболевания и контроле за эффективностью проводимого лечения. Приведем несколько примеров, имеющих большое клиническое значение.
При ревматизме в хронической стадии значительно увеличено количество а- и в-глобулинов в сыворотке крови. При инфекционных заболеваниях наблюдается увеличение у больных у-глобулиновой фракции белков. При циррозе печени значительно снижено содержание в крови а- и в-глобулинов. Этот эффект становится понятным, если вспомнить, что синтез названных белков происходит именно в печени. Снижение уровня альбуминов и рост количества всех глобулиновых фракций отмечается при злокачественных опухолях. Существенно отличается от электрофореграммы здорового человека соотношение белковых фракций в крови почечного больного (рис. 13).
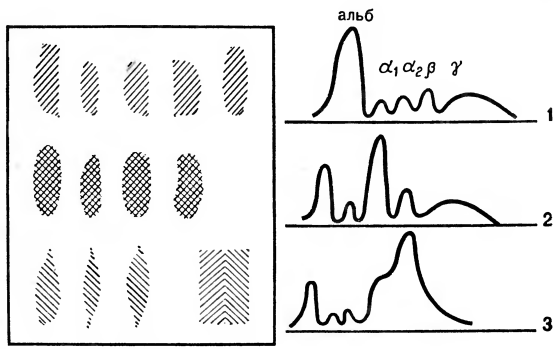
Рис. 13. Электрофореграмма сыворотки крови при патологических состояниях: 1 — нормальная сыворотка крови; 2 — нефроз — заболевание почек; 3 — цирроз печени.
Метод меченых атомов
В 30-х годах нашего столетия для исследования процессов обмена веществ предложили использовать меченые атомы. Для этого применяют радиоизотопы. При распаде они испускают частицы или излучение, которые можно зарегистрировать с помощью специальных приборов. Иногда о распределении радиоизотопов в объекте судят, используя метод радиоавтографии. Принцип его заключается в том, что при контакте фотопластинки с тканью, срезом, листом растений и т. д. в определенных местах пластинки происходит ее засвечивание, которое после проявления обнаруживается в виде затемнений. Метод позволяет следить за процессами, происходящими в исследуемом объекте.
Введение изотопных меток для исследования обмена веществ сыграло большую роль в развитии науки. Считалось, что белки и липиды клеточных мембран остаются в течение всей жизни клетки стабильными и неизменными и синтезируются только один раз. Именно метод меченых атомов помог разрушить эти представления, что привело к открытию факта постоянного и непрерывного обновления всех клеточных структур. Например, меченые аминокислоты включаются в белки печени с большой скоростью. Создается впечатление, что печень, синтезируя белок, должна расти, увеличиваться по массе, накапливать белки. Однако общее количество белка в печени не увеличивается. Это может быть только в том случае, если белки печени находятся в состоянии динамического равновесия, а высокая скорость синтеза компенсируется высокой скоростью распада белковых структур или синтезом белка «на экспорт» для других органов и тканей.
Основное преимущество применения радиоактивных меток перед другими химическими и физическими методами — высокая чувствительность. Это позволяет обнаружить в организме вещества, содержащиеся в очень малых количествах, когда другие способы оказываются неприменимыми. Другим преимуществом является то, что радиоактивную метку можно вводить в живой организм и следить за ней, не влияя на обмен веществ исследуемого объекта. Чтобы не вдаваться в детали и анализ многочисленных особенностей применения радиоактивных изотопов в медико-биологических исследованиях, и в частности в химии белка, рассмотрим упрощенную схему.
Сначала в организм, орган, ткань или модельную систему вводят меченое соединение, а затем в разные периоды времени отбирают пробы, извлекают из них продукты, которые направляют на хроматографический анализ.
После хроматографирования определяют радиоактивность каждой фракции и получают информацию о том, куда включилась радиоактивная метка.
Так можно проверить (подтвердить или опровергнуть) гипотезу о пути синтеза или распада любого соединения или о других путях превращения веществ. Например, было обнаружено, что часть атомов нуклеиновых кислот находилась раньше в составе аминокислот. Это неопровержимо свидетельствует, что при распаде белков часть аминокислот идет на синтез нуклеиновых кислот.
С помощью радиоизотопов можно определять скорости обмена соединений. Например, крысам вводили меченые аминокислоты, а затем через определенные промежутки времени определяли радиоактивность разных органов и тканей. Оказалось, что белки печени обновляются через 7—14 суток, кожи и мышц — через 8—12 недель, а коллаген за год обновляется менее чем на 10%.
Очень широко в настоящее время используются изотопы не только в научных исследованиях, но и в практической медицине.
Функцию щитовидной железы исследуют при помощи меченого иода I. В клинике радиоизотопы используют для измерения времени жизни клеток крови, при диагностике заболеваний почек, легких, определении объема крови. Все это объясняется легкостью обнаружения радиоактивных изотопов и возможностью их количественного определения.
Стабильные изотопы тоже можно использовать в качестве метки или своеобразного индикатора, но обнаружить их можно только с помощью специального прибора — масс-спектрометра. Этот прибор позволяет измерять различия в массах отдельных атомов или групп атомов и «находить» таким образом отличающиеся по массе изотопы в смеси с другими атомами. Использование стабильных изотопов требует применения довольно сложного оборудования. Но так как масс-спектрометры позволяют различать отдельные химические-группы, эти приборы сыграли и играют важную роль в установлении структуры соединений, в изучении обмена аминокислот и в других исследованиях.
Цветные реакции на белки и аминокислоты
Белки можно определять по цветным реакциям, которые дают отдельные аминокислоты или белки с различными реактивами.
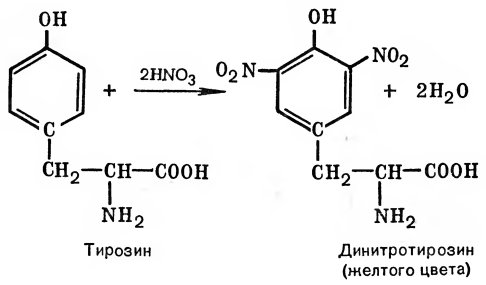
При взаимодействии концентрированной азотной кислоты с белками появляется желтое окрашивание. Эту реакцию называют ксантопротеиновой («ксантос» — желтый). Желтый цвет объясняется тем, что циклические аминокислоты, входящие в белок, образуют с азотной кислотой нитропроизводные желтого цвета. Именно поэтому при случайном попадании азотной кислоты на кожу, ногти, перья, шерсть ткани желтеют:
Тирозин (и только его) помогает открыть в белках также реактив Миллона, представляющий собой смесь солей ртути. В результате реакции образуется белый осадок, который при нагревании краснеет.
Биуретовая реакция выявляет не какую-то пределенную аминокислоту, а пептидную связь. Это значит что ее дают белки и пептиды, так как отдельные аминокислоты не содержат - CO - NH-группы. При добавлении сульфата меди (II) к щелочному раствору белка образуется комплексное соединение, окрашенное в сине-фиолетовый цвет. Если в растворе содежаться не белок, а пептиды или продукты гидролиза белка, то появляется розовая или красная окраска.
Химический реактив нингидрин дает синее окрашивание с аминогруппами аминокислот, находящимися в a-положении. При этом аминокислоты и пептиды окисляются нингидрином, подвергаются дезаминированию с образованием аммиака. Восстановленный нингидрин конденсируется с другой молекулой нингидрина при участии аммиака. Окисленная форма нингидрина бесцветна, продукты конденсации окрашены.
Присутствие в белках серосодержащих аминокислот цистина и цистеина можно открыть реакцией Фоля. Суть реакции состоит в том, что при кипячении белка со щелочью эти аминокислоты легко отщепляют серу. Образовавшийся сульфид натрия взаимодействует с плюмбитом натрия, и выпадает черный осадок сульфида свинца:
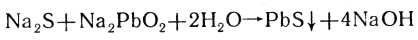
Метионин тоже содержит серу, но эта аминокислота не дает окрашивания с реактивом Фоля, потому что сера с ней связана довольно прочно. Степень окраски исследуемого раствора при этой реакции зависит, с одной стороны, от количества белка в пробе, с другой — от частоты встречаемости в белковой молекуле аминокислот цистина и цистеина.
Значение рассмотренных цветных реакций заключается в том, что они помогают установить, содержатся ли в исследуемых жидкостях, кусочках органа или ткани белковые вещества. На основании цветных реакций разработаны методы точного определения количества белка. Некоторые цветные реакции дают возможность выявить индивидуально ту или иную аминокислоту в пробах.
Другие методы исследования
Для количественных и качественных исследований широко применяются спектральные методы. Главное их преимущество заключается в том, что вещество в процессе изучения не разрушается и его необходимо ничтожно малое количество. Спектр характеризует зависимость количества поглощенной или излученной веществом энергии от длины волны. Используется инфракрасный, видимый и ультрафиолетовый свет с длинами волн от 10-10 до 10-6 см.
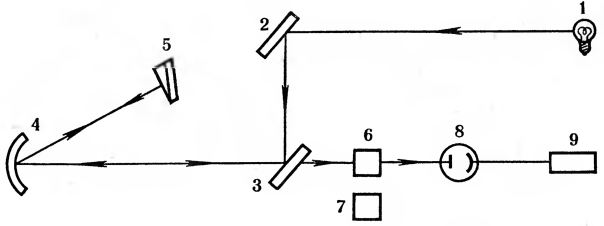
Рис. 14. Схема устройства спектрофотометра: 1 — лампа; 2,3 — плоские зеркала; 4 — фокусирующее зеркало; 5 — отражающая призма; 6 — кювета с образцом; 7 — кювета сравнения (контрольная, без образца); 8—фотоэлемент; 9—устройство, записывающее результат.
При пропускании света через раствор вещества на некоторых длинах волн поглощается или ослабляется его интенсивность. В результате этого процесса получается спектр поглощения с одной или несколькими темными полосами, которые индивидуальны для каждого вещества.
Зная характерные зоны поглощения, можно определить вещество, а интенсивность поглощения свидетельствует о количестве его в растворе. Например, пероксид водорода Н2О2 поглощает ультрафиолетовый свет определенной длины волны. Если к раствору пероксида водорода добавить фермент каталазу, то поглощение ультрафиолетовых лучей будет быстро уменьшаться. Это значит, что каталаза разрушает пероксид водорода. По изменению поглощения (разрушению Н2О2) можно судить об активности каталазы: чем быстрее распался пероксид водорода, тем выше была активность фермента. Такие исследования проводят в специальных приборах — спектрофотометрах (рис. 14).
В биологических жидкостях, например в сыворотке крови, количество белков можно быстро и достаточно точно определить рефрактометрически по преломлению луча света при прохождении его через раствор белка.
Коэффициент преломления — это отношение синуса угла падения луча света к синусу угла его преломления:
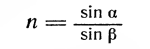
Степень рефракции находят с помощью специальных приборов — рефрактометров, в которых исследуемые растворы белка помещают между двумя призмами. Определив показатель преломления, вычисляют процент содержания белка в испытуемой пробе по таблицам или графикам.
Снижение концентрации белка сыворотки крови — важный показатель при ряде заболеваний желудочно-кишечного тракта, циррозе печени, при хронической недостаточности белка в питании. Значительные количества белка синтезируются в печени, поэтому при хронических заболеваниях печени синтез белка снижен и его концентрация в сыворотке крови тоже ниже нормы.
Рис. 15. Преломление луча света: а — угол падения; в — угол преломления.
Скачать реферат:
Пароль на архив: privetstudent.com