Какие бывают белки
Принципы классификации белков
В настоящее время из органов и тканей человека, животных, растений и микроорганизмов выделено много разнообразных белковых препаратов. Выделены также препараты белков из отдельных частей клетки (например, из ядер, рибосом и т. д.), из неклеточного вещества (сыворотки крови, белка куриного яйца). Полученные препараты имеют различные названия. Однако для систематического изучения белки необходимо распределить по группам т. е. классифицировать. Но это встречает определенные трудности. Если в органической химии вещества классифицируют на основании их химического строения, то в биологической химии строение большинства белков во всех деталях еще не изучено. Кроме того, классифицировать белки на основании только их химического строения очень сложно. Также невозможно дать достаточно обоснованную классификацию белков по их функциям в организме. Очень часто белки, близкие по строению, обладают совершенно различными биологическими функциями (например, гемоглобин и такие ферменты, как каталаза, пероксидаза и цитохромы).
Несколько большие возможности для классификации белков предоставляются при изучении физико-химических свойств белковых веществ. Неодинаковая растворимость белков в воде и других растворителях, различные концентрации солей, необходимые для высаливания белков,— вот обычно те признаки, которые позволяют классифицировать ряд белков. Одновременно принимаются к сведению и некоторые уже известные особенности в химическом строении белков и, наконец, их происхождение и роль в организме.
Весь обширный класс белковых веществ принято разделять на две большие группы: простые белки, или протеины, и сложные белки, или протеиды. Простые белки при гидролизе распадаются только на аминокислоты, а сложные наряду с аминокислотами дают соединения другого типа, например: углеводы, липиды, гем и т. д. Таким образом, сложные белки, или протеиды, состоят из собственно белкового вещества (белковой части или простого белка) в сочетании с другими небелковыми веществами.
К простым белкам, или протеинам, относят протамины, гистоны, альбумины, глобулины, проламины, глютелины, протеиноиды и другие белки, не принадлежащие ни к одной из перечисленных групп, например многие белки-ферменты, мышечный белок — миозин и др. Группу сложных белков, или протеидов, обычно также подразделяют на несколько подгрупп в зависимости от характера содержащихся в них небелковых компонентов.
Однако подобная классификация имеет весьма относительную ценность. Новейшими исследованиями установлено, что многие простые белки в действительности связаны с небольшим количеством тех или иных небелковых соединений. Так, некоторые протеины можно было бы отнести к группе сложных белков, поскольку они, как оказалось, связаны с небольшим количеством углеводов, иногда липидов, пигментов и т. д. В то же время довольно трудно точно охарактеризовать с химической точки зрения и некоторые сложные белки. Так, например, липопротеиды в некоторых случаях представляют настолько непрочные комплексы, что их можно было бы рассматривать скорее как адсорбционные соединения простых белков с липидами, чем как индивидуальные химические вещества.
Простые белки
Наиболее простыми белками являются протамины и гистоны. Они имеют слабоосновной характер, в то время как абсолютное большинство других — кислый. Основной характер протаминов и гистонов обусловлен тем, что в состав их молекул входит большое количество диаминомонокарбоновых аминокислот, таких, как лизин и аргинин. У этих кислот одна а-аминогруппа связана пептидной связью с карбоксилом, а другая остается свободной. Она и обусловливает слабощелочную среду растворов белков. В соответствии со своим основным характером гистоны и протамины обнаруживают ряд особых, не встречающихся у других белков свойств. Так, эти белки находятся в изоэлектрической точке при щелочной реакции среды. Вот почему протамины и гистоны «свертываются» при кипячении лишь при добавлении щелочи.
Протамины, впервые выделенные Ф. Мишером, содержатся в большом количестве в сперматозоидах рыб. Они характеризуются очень высоким содержанием основных аминокислот (до 80%), особенно аргинина. Кроме того, в протаминах отсутствуют такие аминокислоты, как триптофан, метионин, цистеин, а в большинстве протаминов также и тирозин, и фенилаланин. Протамины — относительно небольшие белки. Они имеют молекулярную массу от 2000 до 12 000. Из ядер мышечных клеток их выделить не удалось.
Гистоны обладают менее основными свойствами, чем протамины. В них содержится лишь 20—30 % диаминомонокарбоновых кислот. Аминокислотный состав гистонов значительно более разнообразен, чем протаминов, однако в них также отсутствует триптофан или его имеется очень небольшое количество. В состав гистонов входят также модифицированные, измененные аминокислотные остатки, например: О-фосфосерин, метилированные производные аргинина и лизина, ацетилированные по свободной аминогруппе производные лизина.
Много гистонов содержится в зобной железе, ядрах клеток железистых тканей. Гистоны не являются однородными белками и могут быть разделены на ряд фракций, отличающихся по химическому составу и биологическим свойствам друг от друга. Классификация гистонов основана на относительных количествах лизина и аргинина. Гистон Н1 очень богат лизином. Для гистона Н2 характерно умеренное содержание этой аминокислоты, причем существует два типа этого гистона — Н2А и Н2В. Гистон НЗ умеренно богат аргинином и содержит цистеин. Гистон Н4 богат аргинином и глицином.
Гистоны одного и того же типа, полученные из различных животных и растений, имеют очень сходные аминокислотные последовательности. Такой консерватизм в эволюции, по-видимому, служит сохранению последовательности, обеспечивающей существенные и специфические функции. Это лучше всего подтверждается тем фактом, что аминокислотные последовательности гистона Н4 из проростков гороха и тимуса быка отличаются только двумя из 102 аминокислотных остатков, присутствующих в молекуле.
Благодаря наличию большого количества свободных аминогрупп протамины и гистоны образуют ионные связи с остатками фосфорной кислоты, входящей в состав ДНК, и способствуют компактной укладке двойной спирали ДНК в образованном комплексе ДНК с данными белками. Комплекс ДНК с гистонами — хроматин содержит ДНК и гистоны в примерно равном количественном отношении.
Кроме взаимодействия с ДНК, гистоны также реагируют друг с другом. Экстракцией хлоридом натрия из хроматина был выделен тетрамер, состоящий из двух молекул гистона НЗ и двух молекул гистона Н4. В этих же условиях гистоны Н2А и Н2В могут быть выделены вместе в виде димера. Современная модель структуры хроматина предполагает, что один тетрамер и два димера взаимодействуют с 200 парами оснований ДНК, что составляет примерно участок длиной около 70 нм. При этом образуется сферическая структура диаметром 11 нм. Считается, что хроматин представляет собой подвижную цепь, составленную из таких единиц. Эта предположительная модель подтверждается различными методами исследования.
Альбумины и глобулины являются хорошо изученными белками, входящими в состав всех животных тканей. Основная масса белков, находящихся в плазме крови, в сыворотке молока, в яичном белке и др., состоит из альбуминов и глобулинов. Их соотношение в различных тканях удерживается в определенных границах.
Альбумины и глобулины отличаются друг от друга по физико-химическим свойствам. Одним из распространенных методов разделения альбуминов и глобулинов является их высаливание с помощью сульфата аммония. Если к раствору белка добавить такое количество сульфата аммония, которое содержится в том же объеме разведенного пополам насыщенного раствора этой соли, из раствора выделяются глобулины. Если их отфильтровать и к фильтрату продолжать добавлять кристаллический сульфат аммония до полного насыщения, в осадок выпадает альбумин. Таким образом, глобулины осаждаются в полунасыщенном растворе сульфата аммония, в то время как альбумины — в насыщенном растворе.
Изучение альбуминов и глобулинов обнаружило и другие различия в их физико-химических свойствах. Оказалось, что альбумины способны растворяться в дистиллированной воде, в то время как для растворения глобулинов к воде нужно добавить небольшое количество соли. На основании этого возможно отделение глобулинов от альбуминов путем диализа белкового раствора. Для этого раствор белка, помещенный в мешочек из полупроницаемого материала, например целлофана, опускают в дистиллированную воду. Раствор белка постепенно обессоливается, а глобулины выпадают в осадок. Их отделяют от оставшихся в растворе альбуминов. Глобулины можно осадить и насыщенным раствором сульфата натрия, в то время как альбумины растворяются в нем.
В больших количествах альбумины и глобулины выделяются с лечебными целями из крови доноров. Препараты альбумина крови человека используются для введения больным, потерявшим много крови, как кровезаменители. Препараты у-глобулина используется как для профилактики, так и для лечения некоторых инфекционных заболеваний. В настоящее время для выделения препаратов альбуминов и глобулинов из крови доноров разработаны методы раздельного осаждения этих белков, основанные на их различной растворимости в растворах, содержащих этиловый спирт в различных концентрациях, на холоде. Таким методом получают высокоочищенные препараты альбумина и разных фракций глобулинов, в дальнейшем используемых в лечебных целях.
Среди простых белков растительного происхождения вызывают интерес глютелины и проламины. Они содержатся в семенах злаков, образуя основную массу клейковины. Клейковина может быть выделена в виде клейкой массы путем растирания муки с водой и постепенного отмывания крахмала медленным током воды. Клеящие свойства крахмального клейстера зависят от наличия в нем клейковины. Чем больше клейковины содержится в зерне злаков, тем более ценным считается это зерно. К глютелинам относятся, например, оризенин, получаемый из риса, и глютенин, получаемый из пшеницы.
Одним из важнейших проламинов и наиболее характерным белком эндоспермы пшеничного зерна является глиадин. Глиадин нерастворим в воде и солевых растворах, но в отличие от других белков растворяется в растворе спирта (70%) и с его помощью извлекается из зерна. Из других представителей проламинов можно назвать гордеин, получаемый из ячменя, и зеин — из кукурузы. Эти белки, подобно глиадину, экстрагируются из клейковины раствором спирта (70—80 %). Всепроламины характеризуются относительно высоким содержанием пролина.
Отличительной особенностью белков опорных тканей является их полная нерастворимость в воде, солевых растворах, разведенных кислотах и щелочах. Их объединили под общим названием протеиноидов, что значит белковоподобные. Эти белки относятся к фибриллярным, или волокнистым, белкам, частицы которых имеют форму более или менее вытянутых волокон или нитей. Вследствие нерастворимости протеиноидов в воде на них не действуют ферменты пищеварительных соков. Протеиноиды, как правило, непригодны для питания. К ним относятся, например, белки рогов, копыт, шерсти, волос и др. В то же время ряд белков опорных тканей способен перевариваться пищеварительными соками. Это белки костной ткани, сухожилий, хрящей.
Из отдельных представителей протеиноидов большой интерес представляет коллаген, входящий в состав соединительной ткани (рис. 1). Простейшим методом его получения является обработка костей разведенной соляной кислотой. При этом минеральные вещества переходят в раствор, а коллаген остается. Биологическим предшественником коллагена является проколлаген. Он наряду с коллагеном найден в коже и других тканях. Этот белок удалось выделить в кристаллическом виде. От коллагена он отличается как своим аминокислотным составом (в нем много содержится аминокислоты пролина, в то время как в коллагене — гидроксипролина), так и тем, что расщепляется всеми ферментами, гидролизующими белки.
Белковое вещество сухожилий и связок носит название эластина. Этот протеиноид несколько легче поддается действию пищеварительных соков, чем коллаген.
Кератины являются характерными протеиноидами волос, рогов, ногтей, эпидермиса и шерсти. В их состав входит относительно большое количество цистеина и цистина.
Фиброины являются протеиноидами, вырабатываемыми в прядильных железах насекомых: пауков, гусениц некоторых бабочек (шелкопрядов) и др. Фиброин шелка, составляющий основную массу шелковой нити, выделяется в жидком виде, но затем быстро затвердевает. Шелковые нити, идущие на изготовление тканей, представляют собой фиброин, освобожденный от клея серицина.
Сложные белки
Важнейшими сложными белками являются нуклео-протеиды, хромопротеиды, гликопротеиды, фосфопротеиды, липопротеиды. К группе сложных белков относятся белки, в состав которых, помимо белковой части, входит та или иная небелковая группа — простетическая группа. Она освобождается при гидролизе протеидов наряду с продуктами гидролитического расщепления белковой молекулы— аминокислотами. Так, нуклеоп роте иды дают при гидролизе нуклеиновые кислоты и продукты их распада, гликопротеиды — углеводы и близкие к углеводам вещества, фосфопротеиды — фосфорную кислоту, хромопротеиды — окрашенную группировку, чаще всего гем, липопротеиды — различные липиды. Сложные белки-ферменты можно также расщепить на белковую часть и небелковую простетическую группу. Все эти простетические группы, более или менее прочно связанные с белковым компонентом сложного белка, в большинстве случаев хорошо изучены с химической точки зрения.
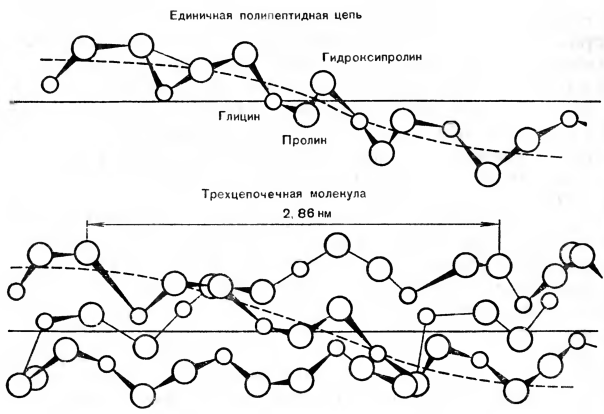
Рис. 1. Схема структуры коллагена.
Среди сложных белков очень большой интерес представляют нуклеопротеиды. Значение нуклеопротеидов определяется прежде всего тем, что из этих белков, как показывает их название, состоит основная масса чрезвычайно важной части клетки — клеточного ядра. Ядро является центром управления жизнедеятельности клетки. Такие процессы, как деление клетки, передача наследственной информации, управление биосинтезом белков, осуществляются при участии ядерных структур. Нуклео-протеиды, а точнее дезоксирибонуклеопротеиды, могут быть выделены из зобной железы, селезенки, из сперматозоидов, ядерных эритроцитов птиц и некоторых других тканей. В их составе, помимо белковой части, находится дезоксирибонуклеиновая кислота, ответственная за хранение и передачу наследственной информации.
В то же время другой тип нуклеопротеидов — рибонуклеопротеиды входят в состав по преимуществу цитоплазмы клеток, принимая непосредственное участие в образовании важнейших биологических систем, в первую очередь системы биосинтеза белка. В клетке рибонуклеопротеиды являются составной частью клеточной органеллы — рибосомы.
Дезоксирибонуклеиновая кислота (ДНК) входит в хроматин — сложный нуклеопротеид, из которого состоят хромосомы. Кроме того, в клетке существует несколько типов рибонуклеиновой кислоты (РНК). Есть информационная РНК (иРНК), которая синтезируется при считывании информации с ДНК и на которой потом синтезируется полипептидная цепь; транспортная РНК (тРНК), доставляющая аминокислоты к иРНК, и рибосомальная РНК (рРНК), входящая в состав клеточных органелл — рибосом, которые образуют комплексы с иРНК В этих комплексах при участии всех трех типов РНК и аминокислот происходит синтез белка.
Нуклеиновые кислоты, находящиеся в составе нуклеотидов, представляют огромный интерес и как компоненты вирусов, занимающих промежуточное место между молекулами сложных белков и самыми мелкими болезнетворными микроорганизмами. Многие вирусы могут быть получены в кристаллической форме. Эти кристаллы представляют собой совокупность вирусных частиц, а те в свою очередь состоят из белкового «футляра» и находящейся внутри него спирализованной молекулы нуклеиновой кислоты (рис. 2). Белковый «футляр» (оболочка вируса) построен из большого количества субъединиц — молекул белка, соединенных между собой с помощью ионных и гидрофобных связей. Причем связь между белковой оболочкой и нуклеиновой кислотой у вирусных частиц весьма непрочна. При проникновении некоторых вирусов в клетку белковая оболочка остается на поверхности, нуклеиновая кислота внедряется в клетку и заражает ее. При участии этой нуклеиновой кислсты в клетке синтезируются белки вируса и вирусная нуклеиновая кислота, что приводит в конечном итоге к образованию большого количества новых вирусных частиц и гибели зараженной клетки. Все это позволяет считать вирусную частицу — гигантскую молекулу сложного белка-нуклеопротеида — своеобразной сверхмолекулярной структурой. Вирусы — это промежуточное звено между химическими веществами и сложными биологическими системами. Вирусы, как нуклеопротеиды, как бы заполняют разрыв между «химией» и «биологией», между веществом и существом.
Белковыми компонентами сложных белков клеточного ядра, помимо уже известных нам белков основного характера, гистонов и протаминов, являются и некоторые кислые белки, так называемые негистоновые белки хроматина, основной функцией которых является регуляция активности дезоксирибонуклеиновой кислоты, как основного хранителя генетической информации.
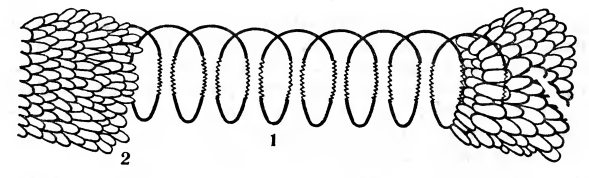
Рис. 2. Вирус мозаичной болезни табака: 1 — спираль РНК; 2 — субъединицы белка, образующие защитный футляр.
Хромопротеиды — сложные белки, которые состоят из простого белка и связанного с ним окрашенного химического соединения. Это соединение может принадлежать к самым различным типам химических веществ, однако чаще всего такое органическое соединение образует еще и комплекс с металлом — железом, магнием, кобальтом.
К хромопротеидам относятся такие важные белки, как гемоглобины, при помощи которых осуществляется перенос кислорода с кровью в ткани, и миоглобин — белок мышечных клеток позвоночных и беспозвоночных. Миоглобин в четыре раза меньше, чем гемоглобин. Он забирает кислород у гемоглобина и снабжает им мышечные волокна. Кроме того, к хромопротеидам относится гемоцианин, переносящий кислород у многих беспозвоночных. Этот гигантский по размерам молекулы белок содержит медь вместо железа, как в гемоглобине, и потому имеет голубой цвет. Поэтому кровь ракообразных, кальмаров, осьминогов голубая в отличие от красной крови животных.
В растениях содержится хромопротеид зеленого цвета — хлорофилл. Его небелковая часть очень напоминает небелковую часть гемоглобина, только вместо железа она содержит магний. С помощью хлорофилла растения фиксируют энергию солнечных лучей и используют ее для фотосинтеза.
Фосфопротеиды — это сложные белки, при гидролизе которых наряду с аминокислотами получается более или менее значительное количество фосфорной кислоты. Важнейшим представителем этой группы белков является казеиноген молока. Помимо казеиногена, к группе фосфопротеидов относятся ововителлин — белок, выделенный из яиц, ихтулин — белок, полученный из рыбьей икры, и некоторые другие. Большой интерес представляют фосфопротеиды, обнаруженные в клетках мозга. Установлено, что фосфор этих белков обладает очень высокой скоростью обновления.
Гликопротеиды — сложные белки, небелковая группа которых является производным углеводов. Отделение углеводного компонента от гликопротеидов часто сопровождается полным или частичным гидролизом гликопротеида. Таким образом, при гидролизе различных гликопротеидов
получаются наряду с аминокислотами и продукты гидлиза углеводной группы: манноза, галактоза, фукоза, ксозамины, глюкуроновая, нейраминовая кислоты и др. составе простетической группы различных гликопроидов обычно находятся не все перечисленные вещества, некоторых гликопротеидов углеводная часть непрочно связана с белковым компонентом и легко от него отляется. Простетические группы некоторых гликопротеинов, известные под общим названием мукополисахаридов (более современное название — гликозаминогликалы), встречаются в тканях и в свободном виде. Такими важнейшими мукополисахаридами являются гиалуроноваяя и хондроитинсерная кислоты, входящие в состав соединительной ткани.
Гликопротеиды входят в состав всех тканей и носят соответственно названия: хондромукоиды (из хряща), стеомукоиды (из костей), овомукоиды (из яичного белка), муцин (в слюне). Они присутствуют также в связках и сухожилиях и имеют большое значение. Например, высокая вязкость слюны, связанная с наличием в ней муцина, облегчает проскальзывание пищи в желудок, защищая слизистую оболочку полости рта от механических повреждений и раздражений химическими веществами.
В настоящее время принято разделять все гликоротеиды на две большие группы: собственно гликопротеиды и полисахарид-белковые комплексы. Первые имеют небольшое число разных моносахаридных остатков, лишенных повторяющегося звена и присоединенных ковалентно к полипетидной цепи. Большинство сывороточых белков является гликопротеидами. Полагают, что эти гетерополисахаридные цепочки являются для сывороточных белков как бы почтовыми открытками, по которым белки распознаются теми или иными тканями. В то же время гетерополисахаридные цепочки, находящиеся на поверхности клеток, являются адресами, по которым эти белки следуют, чтобы попасть в клетки именно той ткани, не другой.
Полисахарид-белковые комплексы имеют большое количество углеводных остатков в полисахаридной части, в ней всегда можно выделить повторяющиеся звенья, в одних случаях связь белок — углевод бывает ковалентная, в других — электростатическая. Из полисахарид-белковых комплексов большую роль играют протеогликаны. Они образуют внеклеточную основу соединительной ткани и могут составлять до 30 % сухой массы ткани. Это вещества, содержащие большое количество отрицательно заряженных группировок, множество различных гетерополисахаридных боковых цепей, ковалентно связанных с полипептидным остовом. В отличие от обычных гликопротеидов, которые содержат несколько процентов углеводов, в протеогликанах до 95 % и более углеводов. По своим физико-химическим свойствам они больше напоминают полисахариды, чем белки. Полисахаридные группы протеогликанов можно получить с хорошим выходом после обработки их протеолитическими ферментами. Протеогликаны выполняют несколько биологических функций: во-первых, механическую, так как они защищают суставные поверхности и служат смазочным материалом; во-вторых, являются ситом, задерживающим крупномолекулярные частицы, и способствуют проникновению через протеогликановый барьер только низкомолекулярных частиц; в-третьих, связывают катионы, причем настолько прочно, что даже катионы К+ и Na + , связанные с протеогликанами, почти не диссоциируют и их ионные свойства не проявляются. Катионы же Са2+ не просто связываются протеогликанами, а и способствуют объединению их молекул.
В клеточных оболочках микроорганизмов содержатся полисахарид-белковые комплексы еще более прочные. В этих комплексах вместо белков находятся пептиды, и поэтому они носят название пептидогликанов. Практически вся клеточная оболочка представляет собой одну гигантскую макромолекулу мешковидного типа — пептидогликан, причем его структура может несколько варьировать в зависимости от вида бактерии. Если углеводная часть пептидогликана у бактерий разного вида практически одинакова, то в белковой части происходит варьирование как аминокислот, так и их последовательности в зависимости от вида бактерий. Связи между углеводами и пептидами в пептидогликанах ковалентные и очень прочные.
Сложные белки липопротеиды состоят из белковой части и связанной с ней в различных соотношениях липидной — жировой части. Липопротеиды обычно нерастворимы в эфире, бензоле, хлороформе и других органических растворителях. Однако известны соединения липидов с белками, которые по своим физико-химическим свойствам стоят уже ближе к типичным липидам и липоидам, т. е. жироподобным веществам, чем к белкам. Такие вещества называются протеолипидами.
Способностью соединяться с липидами с образованием более или менее прочных комплексов обладает целый ряд белков: альбумины, некоторые фракции глобулинов, белки клеточных мембран и некоторых микроструктур клетки. В живом организме с различными липидами и липоидами могут быть связаны простые белки. Чаще всего связь между белком и липидом в таких случаях нековалентная, но тем не менее она прочная, и даже при обработке органическими растворителями в мягких условиях липиды не отделяются от белка. Это возможно только при денатурации белковой части.
Липопротеиды играют важную роль в образовании структурных компонентов клетки, особенно в формировании разнообразных мембран клетки: митохондриальной, микросомальной и т. д. Очень много липопротеидов входит в состав нервной ткани. Они выделены и из белого, и из серого вещества головного мозга. В крови человека и животных также имеются липопротеиды.
Среди белков, наделенных каталитическими функциями,— ферментов можно также встретить не только простые, но и сложные белки, состоящие из белкового компонента и небелковой группы. К таким протеидам относятся ферменты, катализирующие различные окислительно-восстановительные процессы. Небелковые группы некоторых из них близки по строению и свойствам к небелковым группам гемоглобина — гему и обладают выраженной окраской, что позволяет их отнести к группе хромопротеидов. Существует целый ряд белков-ферментов, которые содержат атомы того или иного металла (железа, меди, цинка и др.), непосредственно связанные с белковой структурой. Эти сложные белки-ферменты называют металлопротеидами.
К железосодержащим белкам относятся ферритин, трансферрин, гемосидерин. Трансферрин — растворимый в воде железопротеид с молекулярной массой около 90 000, находящийся главным образом в сыворотке крови во фракции в-глобулинов. Белок содержит 0,13 % железа; это примерно в 150 раз меньше, чем в ферритине. Железо соединяется с белком с помощью гидроксильных групп тирозина. Трансферрин — физиологический переносчик железа в организме.
Известен ряд ферментов, активность которых зависит от присутствия металлов в составе белковой молекулы. Это алкогольдегидрогеназа, содержащая цинк, фосфогидролазы, включающие магний, цитохромоксидаза, содержащая медь, и другие ферменты.
Кроме перечисленных групп белков, можно выделить и более сложные надмолекулярные комплексы, в составе которых одновременно присутствуют белки, липиды, углеводы и нуклеиновые кислоты. В мозговой ткани, например, содержатся липонуклеопротеиды, липогликопротеиды, липогликонуклеопротеиды.
Скачать реферат:
Пароль на архив: privetstudent.com