Как построен белок
Как связаны аминокислоты в молекуле белка
С накоплением сведений о структуре белка возник вопрос о том, как связаны между собой аминокислоты в макромолекуле. В разработке этой проблемы значительная роль принадлежит профессору Харьковского университета А. Я. Данилевскому, который предположил в 1888 г., что аминокислоты в белке связаны амидной связью:
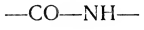
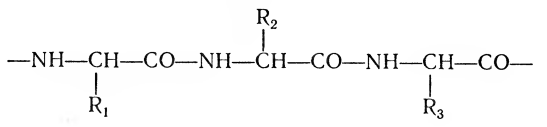
В последние годы выделены сотни белковых веществ. У некоторых из них детально выяснена химическая структура. Оказалось, что, несмотря на разнообразие функций молекул, в структуре белков имеется много общего. Основной связью в молекуле белка является так называемая пептидная, т. е. связь, образованная а-карбоксильными и а-аминогруппами разных (соседних) аминокислот (рис. 1). В зависимости от числа аминокислот, входящих в состав пептида, различают дипептиды (два остатка аминокислот), тетрапептиды (четыре остатка) и т. д. Полипептидами принято называть полимеры, состоящие из 20 или более остатков аминокислот. Впервые подтверждение того, что белковая молекула представляет собой полипептид, было сделано Э. Фишером. Он провел прямой синтез пептидов из отдельных аминокислот и назвал их полипептидами.
В составе белков, выделенных из животных, растений и микроорганизмов, содержится несколько сотен, а иногда и несколько тысяч различных повторений 20 основных аминокислот. Порядок чередования их может быть самым разнообразным. Это дает возможность существовать огромному числу отличающихся друг от друга молекул белка. Например, для белка очень простого строения, состоящего всего лишь из 20 остатков аминокислот, теоретически возможно около 2-1018 вариантов, отличающихся чередованием, а значит, и свойствами различных белковых молекул. Это огромное количество могло бы дать столько же разных изомеров белка.
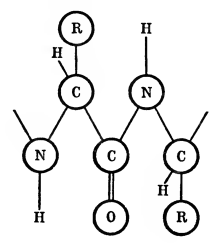
Рис. 1. Фрагмент первичной структуры белка.
Названия пептидов условились обозначать следующим образом: первой называют аминокислоту, у которой свободна а-аминогруппа, а карбоксильная группа участвует в образовании пептидной связи. Эта аминокислота и последующие перечисляются с изменением окончания на -ил, кроме последней. Последняя аминокислота, у которой остается незатронутой а-карбоксильная группа, сохраняет свое название неизменным и произносится в названии пептида последней. Например, тетрапептид, состоящий из остатков глицина, аланина, серина и цистеина, называется глицилаланилсерилцистеином:
Нельзя представить структуру белка как нечто застывшее, навсегда данное, неизменное. При функционировании белковая молекула может претерпеть динамические превращения, отличающиеся не порядком расположения аминокислот (этот порядок сохраняется всегда), а способами упаковки белковой нити в клубок (глобулу). Структура белка зависит от количества и качества ионов в растворе, от кислотности среды, а также от многих других факторов. Часто в белки входит несколько полипептидных нитей, каждую из которых называют субъединицей. В качестве примера приводят обычно структуру знакомого всем белка — гемоглобина, состоящего из четырех субъединиц.
Первичная структура белка
Строго определенную последовательность аминокислотных остатков в полипептидной цепи белковой молекулы называют первичной структурой белка.
Именно с выяснения вопроса о последовательности чередования остатков аминокислот исследователи начинают изучать химическую структуру белка. Работы А. Я. Данилевского и пептидная теория строения Э. Фишера были мощным стимулом для изучения структуры белка в начале XX в. То, что некоторые из полученных синтетическим путем пептидов оказались идентичными с имеющимися в природе, воодушевило ученых.
В разных странах исследователями в 1897—1906 гг. были выделены циклические структуры при гидролизе белков. Эти находки положили начало дикетопиперазиновой теории строения белка. Оставался невыясненным вопрос о том, имеются ли эти циклические структуры в нативном (природном) белке или они образуются в процессе его гидролиза. П. Каррер синтезировал соединения, содержащие циклические структуры, а затем доказал, что они могут расщепляться гидролитическим путем в кислой среде. Но циклических соединений, состоящих из остатков аминокислот, исследователь получить не смог. Просуществовав около сорока лет, дикетопиперазиновая теория была оставлена из-за отсутствия достоверных экспериментальных доказательств.
То, что первичная структура белка действительно представляет собой полипептидную цепь, доказывается рядом фактов. Во-первых, молекулы разных белков содержат небольшое число свободных амино- и карбоксильных групп. Следовательно, почти все остальные эти группы заняты в пептидных связях. При гидролизе же белка количество свободных амино- и карбоксильных групп значительно возрастает. Во-вторых, правильность нашего представления о полипептидной структуре белка доказывают успехи искусственного синтеза белков и высокая активность таких синтезированных искусственно макромолекул.
Большие успехи в установлении структуры белков принадлежат Ф. Сенгеру из Кембриджского университета (Англия). Всемирную известность ему принесли работы по выяснению структуры инсулина — гормона поджелудочной железы. Объект исследования был удобен, так как его относительная молекулярная масса невелика— около 12 000. Ученый предложил следующий метод определения первичной структуры, т. е. порядка чередования аминокислот в инсулине. Он использовал реакцию взаимодействия динитрофенола с концевой аминогруппой белка. При гидролизе такого белка образуется смесь аминокислот, одна из которых будет динитрофениламинокислотой. После определения этой аминокислоты определяли следующие. Так установили порядок их чередования в инсулине. Выяснилось, что инсулин состоит из 51 аминокислоты и имеет двунитчатое строение: 21 аминокислота в одной полипептидной цепочке и 30 — в другой.
Сходный метод определения аминокислотной последовательности был разработан П. Эдманом. Если подействовать ка белок фенилизотиоционатом, то этот реактив будет реагировать со свободной аминогруппой. Если теперь обработать белок соляной кислотой в нитрометане, можно отщепить концевые аминокислоты. Есть и другие методы определения аминокислотной последовательности в белках, например обработка белков ферментами, их разрушающими: аминопептидазы отщепляют аминокислоты с N-конца, карбоксипептидазы — от карбоксильного С-конца.
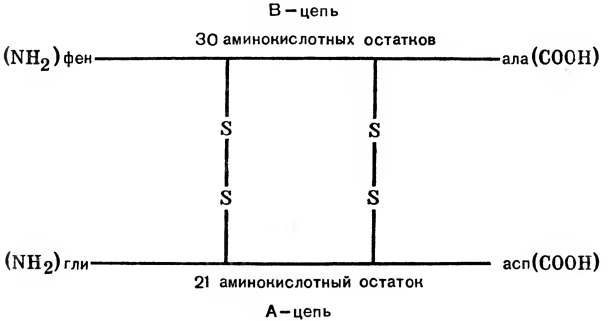
Рис. 2 Схема строения инсулина.
Однако, чтобы разобраться в аминокислотной последовательности, т. е. чтобы установить первичную структуру белка, нужно разрушить пространственную конфигурацию молекулы, превратить белок в нить. Для этого необходимо разрушить дисульфидные и водородные связи, поддерживающие определенную структуру макромолекулы. При этом —S—S-связи или окисляются, или восстанавливаются. Например, в молекуле инсулина имеются две дисульфидные связи, фиксирующие полипептидные цепи А и В. Третья дисульфидная связь находится только в A-цепи между остатками цистеина и в фиксации параллельной цепочки аминокислот не участвует (рис. 2).
Кроме пептидной, дисульфидной (—S—S—) и водородной связи, в молекулах белка существуют ионные и неполярные (рис. 3). Дисульфидные мостики образуются, как мы уже говорили, из сульфгидрильных групп —SH аминокислоты цистеина путем отщепления водорода при окислении. Ионные связи возникают в молекулах белка, как правило, между кислыми и основными группами аминокислот. В их образовании принимают участие чаще всего диаминомонокарбоновые аминокислоты, с одной стороны, и моноаминодикарбоновые аминокислоты — с другой.
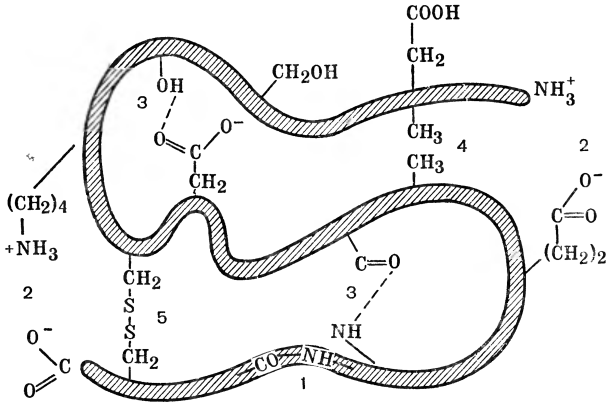
Рис. 3. Химические связи, встречающиеся в белках:
1 — пептидные; 2 — ионные; 3 — водородные; 4 — неполярные; 5— дисульфидные.
Вторичная структура белка
Огромное значение в поддержании специфических структур белка имеют многочисленные водородные связи. Как известно, водородная связь возникает между молекулами, в состав которых входят водород и сильно электроотрицательный элемент, в частности кислород или азот. Водородная связь намного слабее ковалентной, примерно в 15—20 раз. Несмотря на это, ее роль в формировании и поддержании структур белка чрезвычайно велика. Это объясняется тем, что в молекулах аминокислот имеются многочисленные поляризованные СО- и NH-группы, способные образовывать между собой водородные связи. Интересно, что в белке водородные связи образуются между остатками разных молекул аминокислот, и такие связи можно считать межмолекулярными. В то же время эти связи образуются в пределах одной полипептидной нити, одной макромолекулы белка; и в этом случае водородную связь следует считать внутримолекулярной.
На основании данных рентгеноструктурного анализа и кропотливых исследований и расчетов Л. Полинг, Р. Кори и другие ученые доказали, что только спиральная структура полипептидной цепи, стабилизированная множеством водородных связей, обеспечивает максимальную стабильность молекулы белка. Дело в том, что в образовании пептидной связи не принимают участие радикалы аминокислот. Они выступают в разные стороны в периодически повторяющихся одинаковых фрагментах:
Если бы полипептидная нить состояла из а-, в- и других аминокислот, то это нарушало бы периодичность и сделало бы невозможным образование четкой спирализованной структуры. Эти периодически повторяющиеся структуры имеют также периодическую повторяемость углов и длин связей между атомами. Такой способ организации полипептидной цепи носит название вторичной структуры белка.
Водородные связи в спирали образуются между СО-группами одного аминокислотного остатка и NH-rpyппами другого остатка аминокислоты, расположенного над или под первым. Один виток спирали состоит из 3,6 аминокислотного остатка.
Хотя радикалы аминокислот не принимают участия в построении спирали и в образовании пептидной связи, они все же оказывают влияние на вторичную структуру. Если два близко расположенных радикала окажутся положительно заряженными, то они будут отталкиваться друг от друга. Это приведет к тому, что в месте встречи таких аминокислот нарушается правильность построения спирали и она образует изгиб. Примером могут служить радикалы в молекуле лизина, которые при нейтральных значениях pH несут положительные заряды. Аминокислота пролин тоже нарушает спираль. В каком бы месте белковой молекулы ни находился пролин, он влечет за собой петлю или изгиб спиральной структуры белка, прерывая монотонность спирали. Таким же свойством обладают глицин и аспарагин.
Аминокислоты, такие, как аланин, лейцин, глутаминовая кислота, благоприятствуют образованию а-спирали, особенно если эти аминокислоты находятся рядом в полипептидной цепи.
Однако а-спираль не единственная конфигурация, которую принимает полипептидная нить, оторвавшись от рибосомы. Некоторые фибриллярные белки (фиброин шелка, белки волос, шерсти и др.) имеют иную вторичную структуру. Полипептидные нити этих белков значительно растянуты, а водородные связи устанавливаются не между витками одной цепи, как в а-спиралях (рис. 4), а мэжду СО- и NH-группами разных нитей белка. Такая зигзагообразная структура полипептидной цепи называется (3-конформацией или структурой типа складчатого слоя (рис. 5). Процент таких белков относительно невелик.
В природе преобладают белки, вторичная структура которых представляет собой а-спираль. У одного из типов фиброина каждой второй аминокислотой является глицин. Поэтому все R-группы, расположенные по одну сторону слоя, представлены атомами водорода. Но у большинства типов фиброина преобладает аланин, поэтому R-группами на другой стороне слоя являются метальные группы. Этот тип структуры обладает высокой стабильностью.
В кератинах, также находящихся в волосах, шерсти, шелке, содержатся аминокислоты с R-группами различных размеров, в том числе одинаково заряженные и довольно крупные, поэтому стабильное существование структур типа складчатого слоя для кератинов невозможно из-за взаимного отталкивания R-групп. Именно по этой причине растянутые формы белков волос, шерсти, шелка неустойчивы и самопроизвольно переходят из в- в а-спиральную форму. В настоящее время хорошо известно, что такие аминокислоты, как метионин, валин и изолейцин, при определенном их расположении в молекуле белка способствуют образованию в-структур.
Следует сказать, что между а-кератинами и фиброином имеются еще два различия. В а-кератинах все пептидные цепи направлены в одну сторону, тогда как в фиброине соседние пептидные цепи — в противоположные стороны. Кроме того, в а-кератине содержится много остатков цистеина, расположенных таким образом, что между соседними пептидными цепями образуются межцепочечные S—S-связи. Эти связи придают а-кератинам значительную стабильность и прочность. Разрушение дисульфидных связей в этих белках лежит в основе химической завивки волос (перманент). Для этого используют какде-либо серосодержащее соединение, под действием которого временно разрываются поперечные дисульфидные связи. После окисления волос воздухом образуются новые поперечные дисульфидные связи, стабилизирующие прическу. В фиброине же дисульфидные связи отсутствуют.
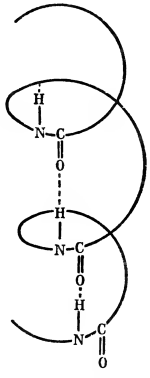
Рис. 4 а-Структура полипептида.
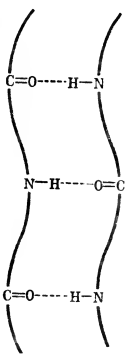
Рис. 5 в-Структура полипептида.
Упаковка полипептидной цепи
Когда мы говорим о белковой молекуле, то представляем себе часто именно белковую глобулу — компактное тело без пустот внутри. Многими методами, в том числе и методом рентгеноструктурного анализа, было показано, что в белковой глобуле атомы соприкасающихся цепей сближены на расстояния, соответствующие суммам их радиусов, т. е. плотность упаковки достаточно велика. При этом не следует смешивать плотную укладку атомов внутри молекулы белка с рыхлой упаковкой самих белковых молекул во влажном белковом кристалле. Например, искусственно синтезированная полипептидная цепочка со случайным чередованием аминокислотных остатков и случайным чередованием R-групп в растворе имеет вид неплотного и нестабильного образования. Поэтому, когда говорят, что пространственная структура белка определяется последовательностью аминокислотных остатков в его полипептидной цепи или его первичной структурой, необходимо всегда помнить, что речь идет не просто о произвольной первичной структуре, а о последовательности аминокислот, эволюционно закрепленной за каждым белком. Именно генетически заданная последовательность аминокислотных остатков решающим образом определяет все те взаимодействия между различными участками полипептидной цепи, которые приводят к самосвертыванию цепи в компактную глобулу и стабилизируют полученную структуру. Этот процесс самоорганизации присущ и многим другим, более высоким уровням организации биологических систем. Возможность образования компактной белковой глобулы, устойчивой и неповторимой для каждого белка, подготовлена всем процессом эволюции, своего рода естественным отбором на уровне первичной структуры.
Способ укладки спиральных структур в глобулярных белках называют третичной структурой белка (рис. 6).
То, что спиралевидная полипептидная цепь должна быть каким-то образом упакована, свернута, уплотнена,— факт очевидный. Ведь трудно себе представить, чтобы спиралевидная палочка, например, у пептидной нити альбулина, в которой длина больше толщины в 60 раз, могла бы находится в прямолинейном, несвернутом состоянии. У многих белковых молекул эти соотношения еще больше. А опыт показывает, что в упакованном состоянии молекулы большинства известных белков имеют эллипсоидную форму, в которой толщина относится к длине, как 1:3 или 1:4. В образовании третичной структуры начинают играть большую роль радикалы аминокислот, которые (как мы уже упоминали) не принимали прямого участия в образовании первичной и вторичной структур. Основными связями, стабилизирующими третичную структуру, являются дисульфидные мостики, сложноэфирные, водородные и амидные связи.
Как влияет состав белка на его структуру
Зная состав белка, можно прогнозировать его строение, форму, свойства и роль в клетке.
Стремление каждой полипептидной цепи к образованию стабильной а-спиральной конфигурации определяется природой и последовательностью радикалов (R-групп) аминокислот в цепи. Для выяснения этого были проделаны опыты на синтетических полипептидах, в которых использовали полипептиды, состоящие из какой нибудь одной аминокислоты. Оказалось, что полиаланин R-группы которого малы и не имеют заряда, самопроизвольно образует а-спиральные структуры в водном нейтральном растворе. Такой полипептид выглядит как столбик, состоящий из одной а-спирали. Полилизин при таких же условиях находится в виде беспорядочного клубка. Это объясняется тем, что все R-группы полилизина несут положительный заряд, так как к азоту аминогруппы присоединяется протон по типу донорно-акцепторно связи и вся группа приобретает положительный заряд В этом случае близко расположенные положительно заряженные R-группы отталкиваются друг от друга, причем сила этого отталкивания превышает стремление к образованию внутрицепочечных водородных связей, стабилизирующих а-спираль. Если же среда станет щелочной, то недостаток протонов вызовет диссоциацию аминогруппы и она превратится в нейтральную. Поэтому в щелочной среде полилизин будет спонтанно образовывать а-спираль. Полиглутаминовая кислота, подобно полилизину, также представляет собой при нейтральном pH беспорядочный клубок. Причина этого состоит в том, что в R-группах полиглутаминовой кислоты содержатся свободные карбоксильные группы, которые в нейтральной и щелочной среде отдают в раствор свой протон и приобретают отрицательный заряд, а одноименные заряженные аминогруппы, отталкиваясь друг от друга, препятствуют образованию а-спиральной структуры. Если же довести pH среды до 2, то избыток протонов нейтрализует карбоксильные группы и полиглутаминовая кислота образует а-спираль.
Рис. 6. Третичная структура белка.
Некоторые полиаминокислоты не могут образовывать а-спирали по другим причинам. Так, в состав R-группы полиизолейцина входит объемистый, разветвленный заместитель, который, располагаясь рядом с а-углеродным атомом, служит стерической помехой образованию спирали. Полисерин имеет в R-группе гидроксильную группу, которая сама может участвовать в формировании водородных связей. Поэтому полисерин образует спиральную структуру, отличную от а-спирали. Полиглицин в принципе способен образовывать а-спираль, но он стремится принять конформацию другого типа, так называемую p-структуру, при которой цепи находятся в относительно растянутом состоянии. В такой структуре на один ниток приходится гораздо больше остатков глицина, чем в а-спирали.
Особенно интересно строение полипролина. В его молекуле атом азота входит в состав жесткого кольца, чго исключает возможность какого-то ни было вращения вокруг С—N-связи. Кроме того, в полипролине нет внутрицепочечных водородных связей, стабилизирующих а-спираль, так как атомы азота в нем не связаны с атомами водорода. Поэтому для полипролина характерна не а-спираль, а спираль другого типа. Она напоминает по своей периодичности спираль, обнаруженную в фибриллярном белке коллагене, входящем в состав соединительной ткани животных и человека. Когда же пролин или оксипролин входит в состав обычных природных белков, то, в каком бы месте они не находились, они неизменно нарушают а-спираль, так возникает петля или изгиб.
Если бы все аминокислоты способствовали образованию а-спирали, то белковая молекула не могла бы свернуться в глобулу, а представляла бы собой столбик. Компактность молекулы белка (глобула) определяется во многом ее взаимодействием с водной средой. Неполярные (гидрофобные) остатки этой молекулы отталкиваются от молекул воды и стремятся собраться внутри белковой молекулы, притягиваясь силами Ван-дер-Ваальса, а полярные (гидрофильные) почти все находятся на поверхности белковой глобулы. Все это стабилизирует глобулу. Чтобы свертывание в глобулу было возможным, необходима определенная первичная структура, что ясно указывает на закономерный, эволюционно выработанный характер первичной структуры.
Фактором, стабилизирующим структуры белка, служат и водородные связи. Образование водородных связей между группами остова полипептидной цепи определяет тот или иной тип вторичной структуры. Кроме того, в образовании водородных связей, как правило, участвуют еще и R-группы остатков серина, треонина, тирозина и гистидина. Возможность возникновения таких водородных связей как бы заранее предусмотрена при образовании определенной третичной (пространственной) структуры.
Существенным фактором стабилизации структуры служат дисульфидные связи между остатками цистеина. Они играют большую роль в поддержании структуры таких белков, как инсулин, рибонуклеаза и др. Дисульфидные мостики как бы сшивают с помощью ковалентных связей и закрепляют в определенном положении сформировавшуюся третичную структуру. Если молекула белка содержит много дисульфидных связей, то для ее денатурации требуется сначала разрушить дисульфидные мостики, чего достигают чаще всего путем их восстановления до сульфгидрильных групп. Молекулу фермента рибонуклеазы можно денатурировать и затем снова восстановить ее активность, если в мягких условиях окислить образовавшиеся сульфгидрильные группы. Этот эксперимент доказал, что вся информация для образования третичной структуры содержится в самой последовательности аминокислот в полипептидной цепи, т. е. в первичной структуре, а дисульфидные мостики только закрепляют возникшую третичнуюю структуру как окончательную упаковку полипептидной цепи в пространстве.
Высшая организация белковых молекул
Содержащийся в эритроцитах белок гемоглобин играет важнейшую роль, осуществляя дыхательную функцию крови. Он переносит кислород от легких к тканям и углекислый газ от тканей к легким. Гемоглобин — сложный белок, состоящий из собственно белковой части — глобина и небелкового участка — гема. В гемоглобине человека и животных гем имеет одинаковое строение, а белковые части несколько отличаются. В результате 25-летних исследований М. Перутц и его сотрудники установили точную структуру гемоглобина. Они выяснили, что молекула этого белка состоит из четырех отдельных полипептидных цепей: две цепи имели по 141 аминокислотному остатку каждая, а две другие — по 146 остатков. Каждая пептидная цепь связана с одним гемом, т. е. в одной молекуле гемоглобина имеется четыре гема. Каждая пептидная цепь свернута в клубок и очень напоминает своей третичной структурой другой белок — миоглобин.
Такое сходство дает основание предположить, что биологическая функция этих разных белков — связывание кислорода — обусловлена сходством химической структуры.
Для некоторых белков (это относится прежде всего к гемоглобину) характерно более сложное строение, чем то, которое определяется как третичная структура. Четыре полипептидные нити гемоглобина объединяются в более сложную глобулу, которую и называют четвертичной структурой белка (рис. 7). При определенных условиях «кирпичики» четвертичной структуры, т. е. полипептидные нити, могут диссоциировать, распадаться на составляющие глобулу субъединицы — полипептидные цепи. При изменении условий полипептидные нити соединяются, и четвертичная структура восстанавливается.
При соединении кислорода с гемоглобином четвертичная структура этого белка меняется, расстояние между цепями уменьшается, создается впечатление сжатия глобулы. Таким образом, в процессе выполнения своей функции — переноса кислорода — гемоглобин сам претерпевает изменения: молекула сжимается при связывании с кислородом и расправляется при отдаче его. Этот феномен академик В. А. Энгельгардт сравнил с дыханием, когда сжимается и расправляется грудная клетка.
Замечено, что большинство глобулярных белков, молекулярная масса которых близка к 50 000,— это белки, состоящие из нескольких полипептидных цепей, или субъединиц, т. е. они уже имеют четвертичную структуру. К таким белкам, для которых доказано существование четвертичной структуры, относятся амилаза, вирус табачной мозаики, пепсин, лактоглобулин, инсулин и др.
Рис. 7. Четвертичная структура белка.
Но для большинства белков понятия «субъединица» и «полипептидная цепь» не совпадают, т. е. в одну субъединицу может входить несколько полипептидных цепей. Например, четвертичная структура фермента глутамат-дегидрогеназы состоит из восьми субъединиц. Общая относительная молекулярная масса всего фермента 2,2 млн., молекулярная масса одной субъединицы 280 000, а полипептидной цепи — около 50 000. Следовательно, каждая субъединица состоит из нескольких цепей.
Установлено, что для белков, имеющих четвертичную структуру, ферментативная активность теряется при распаде белка на субъединицы, т. е. такой белок активен только при наличии четвертичной структуры. Какое же значение имеет четвертичная структура, в чем биологическая роль субъединиц в таком агрегированном белке?
Предполагают, что если белок, например, с молекулярной массой около 100 000 состоит только из одной нити, то случайное включение хотя бы одной ошибочной аминокислоты приводит к «браку» всей огромной молекулы белка. Если же белок, имея ту же молекулярную массу, состоит из десяти полипептидных нитей, то такая случайная ошибка коснется только одной из десяти цепей, а остальные соединятся между собой и возьмут «неотбракованную» десятую субъединицу. Такой вариант сохранит белок для выполнения предназначенной ему функции. Эксперименты подтверждают это предположение: если в одной субъединице есть ошибка в аминокислотном составе, то такая дефектная частица не подходит к соседним субъединицам и они находят в растворе для себя правильную небракованную субъединицу Только после этого происходит самосборка крупной молекулы белка с четвертичной структурой.
Так как во многих белках отдельные цепи идентичны, т. е. состоят из одинаковых аминокислот, значит, их синтез может кодироваться только одним участком ДНК. Это приводит к значительной экономии участков ДНК и информационной РНК (иРНК), т. е. к экономии генетического материала. Ведь если бы белок составляли не несколько отдельных цепей, а одна длинная, состояая из такого же числа аминокислот, что и сумма аминокислот во всех субъединицах, то для кодирования такого белка потребовалась бы ДНК, в несколько раз
превышающая по длине ту ДНК, которая достаточна для кодирования одной более короткой полипептидной цепи.
Таким образом, четвертичная структура белка определяется первичной структурой, т. е. аминокислотной последовательностью каждой субъединицы. Такие отдельные субъединицы способны к самосборке в более крупные белки, и это дает ряд преимуществ перед одноцепочечными молекулами белка: сводятся к минимуму последствия ошибок при синтезе белков, а также экономится генетический материал.
Скачать реферат:
Пароль на архив: privetstudent.com