На зарождение центров кристаллизации, как установлено Тамманом, влияет число «обработок», предшествующих опыту и заключающихся в том, что выращенные из раствора кристаллы растворяются в новой порции того же растворителя. Из полученного раствора вновь выращиваются кристаллы, которые затем подвергаются растворению и т. д. При увеличении числа чередующихся операций скорость зарождения кристаллов падает. В. И. Данилов рассматривает «обработку» как способ самоочистки вещества от нерастворимых примесей, часть которых всегда оттесняется поверхностью растущего кристалла.
Вопрос о том, можно ли предупредить способность вещества к переходу в кристаллическое или аморфное состояние, Тамман решает следующим образом. Каждое вещество характеризуется определенной кривой зависимости числа центров и кривой линейной скорости кристаллизации (СК) от степени переохлаждения. Линейная скорость кристаллизации есть скорость, с которой перемещается граница между расплавом и закристаллизовавшимся веществом в направлении, перпендикулярном поверхности раздела. В зависимости от взаимного расположения кривой СК и кривой ЧЦ переохлажденный расплав может или закристаллизоваться или «просто затвердеть», перейти в стеклообразное состояние. Тамман различает три типа зависимости числа центров кристаллизации и скорости кристаллизации от переохлаждения (рис. 13). Кривые ЧЦ и СК, полученные Тамманом и другими исследователями, до сих пор остаются экспериментальными и не получили теоретического объяснения.
На рисунке 13 в первом случае (а) получается мелкозернистый сросток при медленном охлаждении, так как температура Ть соответствующая максимуму ЧЦ, намного меньше Т2, определяющей максимум СК. Наоборот, при быстром охлаждении создается крупнозернистый полукристаллический сросток. При таком частичном перекрывании кривых ЧЦ и СК в зависимости от скорости охлаждения вещество (например, селен) может быть получено как в кристаллическом, так и аморфном состояниях.
В случае (б) наложения или близости положений максимумов обеих кривых вещество легко кристаллизуется, и его трудно или невозможно получить при охлаждении расплава в аморфном состоянии (например, металлы).
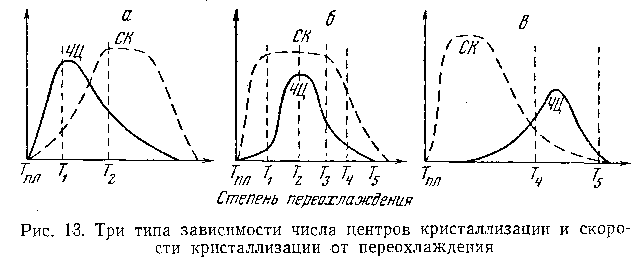
Когда же максимумы кривых (ЧЦ и СК) не совпадают и кривые не перекрываются (в), вещество легко переходит в стеклообразное состояние, его трудно получить в кристаллическом состоянии (окись кремния и др.).
По кристаллизационной способности вещества делятся на группы. Хорошо кристаллизуются металлы со структурой типа плотнейших и плотных шаровых упаковок. Металлы с усложненными структурами (цинк, олово, сурьма, селен и др.) обладают большей склонностью к переохлаждению. Многие молекулярные органические вещества также легко образуют стекла, поскольку образование «регулярной» кристаллической структуры в этих случаях требует не только периодического расположения центров молекул, но и строго определенной взаимной ориентации молекул в пространстве.
Для того чтобы кристалл рос с измеримой в лабораторных условиях скоростью (порядка 1 м в месяц), необходима степень пересыщения не менее 26—50%. То обстоятельство, что на практике заметную скорость роста кристаллов определяют пересыщения порядка 1%, говорит о большом расхождении теории роста идеального кристалла с опытом.
Современные молекулярно-кинетические теории зарождения кристаллов, основанные на идее Гиббса об их скачкообразном росте, имеют некоторые преимущества перед чисто термодинамическими теориями.

Они помогают проникнуть в молекулярный механизм процессов зарождения и роста кристаллов, благодаря чему удалось вычислить множители перед экспонентами в выражениях для вероятности и скорости образования зародышей, а также для линейной скорости кристаллизации.
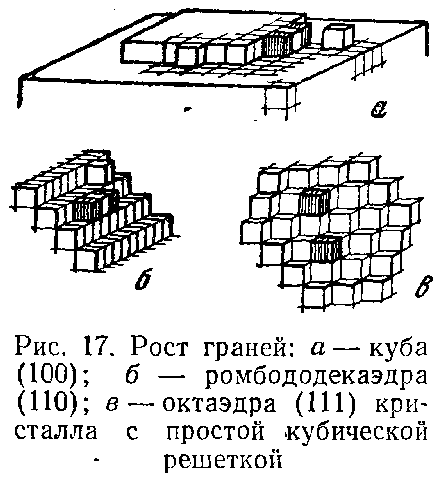
Термодинамические теории бессильны в объяснении скорости роста граней, не связанных с образованием двумерного зародыша, так как термодинамически не удалось определить одномерные и нульмерные зародыши. Этим явлениям вполне удовлетворительное объяснение дали молекулярно-кинетические теории Косселя и Странского, показавшие, что кристаллические грани, по своей поверхностной структуре подразделяются на зеркально гладкие грани и грани с более или менее ясно выраженной шероховатостью (рис. 16). Гладкие или «плотноупакованные», G-грани описываются малыми индексами (hrl). Рост таких граней связан с образованием двумерных зародышей (рис. 17, а). Грани с шероховатой поверхностью образованы выступами (субиндивидами), которые ограничены участками гладких граней. При этом субиндивиды могут иметь строение и величину либо одинаковые (штриховые линии, см. рис. 16), либо различные (пунктирные линии, см. рис. 16). Грани со ступенчатой поверхностью растут путем присоединения отдельных рядов одномерных зародышей (рис. 17, 6). Образование одномерных зародышей также связано с преодолением, хотя и меньших, чем в предыдущем случае, энергетических барьеров.
Существуют грани, которые растут путем присоединения отдельных частиц, нульмерных зародышей, в так называемые изломы ступени (рис. 17,в). Излом ступени — это трехгранный угол, который представляет собой энергетически наиболее выгодный участок для увеличения поверхности растущего кристалла.
Вопросы, связанные с определением предэкспоненциального множителя и подсчетом энергий нульмерных, одномерных и двумерных зародышей. Молекулярно-кинетическая теория зарождения кристаллов имеет тот большой недостаток, что остается теорией идеальных кристаллов и, несмотря на «принципиальную правильность», оказывается в большинстве случаев (неприменимой для реальных кристаллов.
Еще раз приходится отметить, что пока нет единой теории зарождения кристаллов. Характерными для всех теорий остаются общие соображения без более конкретной связи с особенностями строения кристаллического вещества и с силами взаимодействия между частицами этого вещества.
Скачать реферат:
Пароль на архив: privetstudent.com