КРИСТАЛЛИЗАЦИЯ ИЗ ТВЕРДОГО, ЖИДКОГО И ГАЗООБРАЗНОГО
СОСТОЯНИЙ
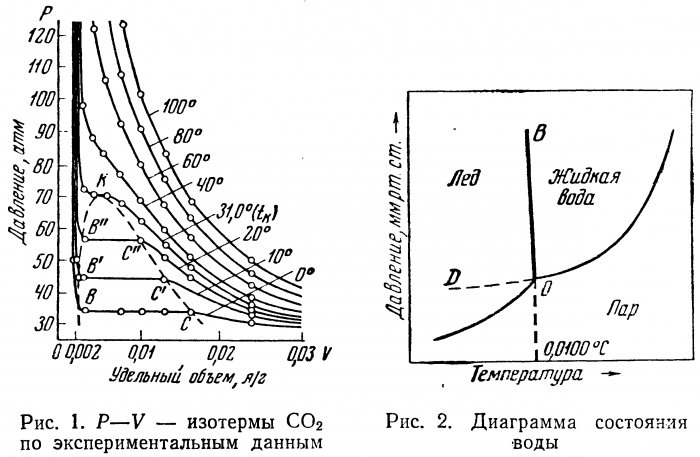
Помимо трех фазовых состояний вещества: газообразного, жидкого и твердого приходится считаться с существованием еще и межфазного состояния. В фазовой диаграмме (рис. 1) область межфазного состояния лежит выше критической точки К. В ней вещества характеризуются наименьшей термодинамической устойчивостью. Здесь ни при каком давлении не происходит конденсация пара в жидкость. В области пониженной устойчивости фазы существуют, но не могут сосуществовать. Примером если не теоретического, то практического межфазного состояния могут служить жидкие кристаллы.
Превращения вещества из одного состояния в другое при соответствующих термодинамических условиях, которые сопровождаются возникновением границы раздела двух фаз, характеризуюхциеся скачком теплосодержания Q и обращением теплоемкости в бесконечность, как известно, называются фазовыми переходами первого рода. Фазовые переходы второго рода, напротив, характеризуются отсутствием резкой границы раздела и скачка Q, при этом теплоемкость остается конечной величиной. Фазовые переходы второго рода представляют собой скачкообразное изменение лишь некоторых свойств жидкости или твердого тела. Так, при плавном изменении внешних условий ряд свойств жидкостей (поверхностное натяжение, показатель преломления, плотность и другие), находящихся в квазикристаллическом состоянии, может меняться скачком, что позволяет говорить об их полиморфизме. В частности, для воды это постепенное изменение заходит настолько далеко, что ее при температурах, близких к 0° и 25—75° С, можно рассматривать как два различных по своей природе растворителя. Примером фазового перехода второго рода в кристаллических телах являются точки Кюри, ограничивающие температурную область существования ферромагнитного превращения в магнетиках и спонтанной поляризации в сегнетоэлектриках. Из всего многообразия фазовых превращений нас, прежде всего, интересуют процессы перехода вещества из любого состояния в кристаллическое (кристаллизация вещества).
Чтобы вырастить монокристалл из вещества, находящегося в любом агрегатном состоянии, необходимы три условия:
1) перевод системы в метастабильное состояние, 2) наличие затравочного кристалла и направленный теплоотвод.
Метастабильное состояние — это относительно устойчивое состояние пересыщенных растворов, переохлажденных расплавов и т. д., которое перестает быть устойчивым, когда в систему вводится затравка — кристаллик не меньше определенного, так называемого критического размера. На затравке происходит кристаллизация вещества, если при этом обеспечен постоянный отвод тепла. Например, кристаллизация льда из переохлажденной воды может быть осуществлена в области ВОД (рис. 2).