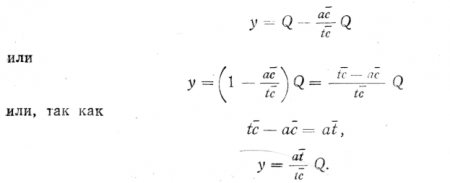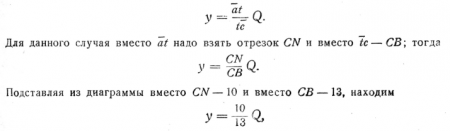Так как свойства металлов и сплавов определяются не только их химическим составом, но также и структурой и так как всякое структурное изменение в них происходит при соответствующей температуре, то для изучения, свойств металлов и сплавов важно знать их критические точки.
Ввиду того что законы равновесия между фазами, которым подчиняются сплавы и растворы солей в воде, аналогичны, изучение явлений, происходящих при охлаждении сплавов, удобно начинать с изучения явлений, происходящих при охлаждении соляных растворов.
Построим кривые охлаждения для растворов поваренной соли в воде с содержанием соли 0; 10; 15; 23,5 и выше 23,5% и сгруппируем их на одной диаграмме (фиг. 63).

Кривая I представляет собой уже известную нам кривую охлаждения чистой воды,ее критическая точка 0°; при этой температуре начинается и заканчивается процесс кристаллизации воды. Кривая II изображает изменения температур с течением времени при охлаждении соляного раствора, содержащего 10% NaCl; рассматривая эту кривую, видим, что изменение направления кривой происходит не при 0°, а только при — 8° (точка А кривой II), после чего кривая принимает несколько более пологое, чем на вышележащем участке, направление. Когда температура опустится до —22°, произойдет температурная остановка (участок ВС кривой II). Исследуя физическую сторону явления, можно убедиться в том, что, начиная от точки А до точки В кривой ll, из соляного раствора выделяются кристаллы
льда, и концентрация раствора, постепенно повышаясь, доходит до 23,5% В течение времени, равного участку ВС кривой II, при температуре —22° происходит кристаллизация и воды и соли одновременно, при этом концентрация жидкого маточного раствора сохраняется в течение всего времени замерзания постоянной.
Несколько большая пологость кривой на участке АВ, чем на вышележащей ее части, объясняется тем, что происходящий на этом участке процесс кристаллизации сопровождается выделением тепла, вследствие чего падение температуры на этом участке не может быть столь быстрым, как на вышележащем.
Характер кривой охлаждения раствора, содержащего 15% NaCl (кривая III), аналогичен кривой II, но перегиб кривой здесь имеет место не при —8°, а при —11°; на участке AВ кривой также кристаллизуется только вода и на участке ВС — вода и соль одновременно. Концентрация соли в растворе при температуре —22° и в этом случае равна 23,5%.
Кривая охлаждения раствора (кривая V), содержащего 23,5% NaCl, имеет только одну температурную остановку, соответствующую кристаллизации воды и соли одновременно.
При увеличении концентрации соли сверх 23,5% кривые охлаждения имеют характер, подобный кривым II, III и IV, но физическая сторона процесса здесь несколько иная; кристаллизация начинается в точке Л, но на участке АВ кривой VI выделяются кристаллы не воды, а соли. Вследствие того что на участке АВ происходит кристаллизация соли, крепость раствора от A до В уменьшается; в точке В, т. е. при температуре —22°, крепость раствора делается равной 23,5%.
Сравнивая между собой кривые II, III, IV, V и VI, замечаем, что раствор, содержащий 23,5% NaCl, начинает затвердевать и заканчивает затвердевание при постоянной и самой низкой температуре (—22°).
Следовательно, этот раствор является и наиболее легкоплавким; такие растворы называются эвтектическими.
При охлаждении доэвтектических растворов кристаллизация начинается, как мы видели, с воды, а при охлаждении заэвтектических— с соли, и для всех растворов кристаллизация заканчивается (при —22°) одновременным выделением кристаллов воды и соли. Твердая масса, образующаяся при —22°, представляет собой смесь мелких кристаллов льда и соли. Таким образом, доэвтектические растворы соли после затвердевания превращаются в массу, состоящую из более крупных первичных кристаллов льда и эвтектики, состоящей из смеси мелких кристаллов льда и соли, а заэвтектические — в массу, состоящую из более крупных кристаллов соли и эвтектики.
Критические точки для растворов различных концентраций можно представить на одной диаграмме, откладывая по оси X весовые проценты соли в растворе, а по оси Y — температуру; такая диаграмма, построенная по критическим точкам, взятым с кривых охлаждения I, II, III, IV, V и VI, представлена на фиг. 64. Ход построения диаграммы таков: 1) по оси X откладывают точки, соответствующие концентрациям растворов, для которых были построены кривые охлаждения (в данном случае — 0; 10; 15; 23,5 и свыше 23,5%); 2) через полученные точки проводят линии, параллельные оси У, и на них наносят критические точки, взятые с соответствующих кривых охлаждения (в данном случае точки А и В); 3) все точки А соединяют кривой и через все точки В проводят линию, которая будет параллельна оси X.
Рассматривая построенную таким путем диаграмму, видим, что так как точки AI, AII, АIII, АV, AVI показывают температуру начала затвердевания соответствующей концентрации растворов, то выше кривой AI AI, АVI лежит область, где системы из воды и соли находятся в жидком состоянии. В области, лежащей между линиями AII, АIII и ВII, ВIII системы из воды и соли находятся частью в твердом, частью — в жидком состоянии; при этом твердая часть системы состоит из кристаллов воды. Подобно этому, все точки области, находя-
щиеся между кривыми AVAVI и BVBVI соответствуют частично жидкому и частично твердому состоянию, причем твердая часть состоит из кристаллов NaCl. Ниже линии ВII BVI все растворы находятся в твердом состоянии; левее линии ВvС и ниже ВllВv находится область твердой массы, состоящей из кристаллов воды и эвтектики из льда и соли; правее линии BVC и ниже ВvВvl — область твердой массы, состоящей из кристаллов соли и эвтектики льда и соли. Наконец, все точки линии ВVС соответствуют твердому состоянию раствора, причем его твердая масса состоит только из эвтектики льда и соли.
Линию начала затвердевания (AIАIIAIIIAIVAVAVI) называют линией ликвидуса (граница жидкого состояния), линию конца затвердевания (ВIIВVI)—линией солидуса (граница твердого состояния).
Очевидно, взяв любую точку диаграммы, можно сказать, к раствору какой концентрации она относится, какую раствор имеет температуру в этой точке и в каком состоянии он находится. Такая диаграмма называется диаграммой состояния.
Пользуясь диаграммой состояния, можно не производя непосредственно опытов ответить на ряд вопросов, относящихся к изучаемой системе. Ниже приведено несколько задач, решаемых при помощи диаграмм состояния.
1. Определить в каком состоянии будет находиться система, содержащая k% NaCl (при температуре, равной —t).
Для решения задачи надо найти пересечение линий, проведенных параллельно осям координат через точки k и —t. Положение точки а на диаграмме определяет состояние системы, которая будет находиться частью в жидком и частью в твердом состоянии.
2. При какой температуре окончательно расплавится система, содержащая k% NaCl.
Проводим через k линию, параллельную оси У, до пересечения с линией ликвидуса в точке b; проведя через точку b линию, параллельную оси X до пересечения с осью Y (в точке — t1), находим искомую температуру (—t1).
3. Определить концентрацию раствора в точке а. Если провести через точку а линию, параллельную оси X, до пересечения с линией ликвидуса в точке с, отрезок tc покажет искомую концентрацию раствора, так как при температуре —t° начнет затвердевать раствор, содержащий tc% NaCl.
4. Определить весовое количество льда в точке а.
Обозначим через Q вес раствора (системы) в кг; k — концентрацию NaCl в растворе; x — вес льда в точке а (при температуре—t°); (Q—х) — вес жидкой части раствора в точке а (при температуре —t°).
Так как точка а была взята произвольно и так как решение найдено в общем виде, то очевидно, что полученное выражение для определения величины х даст ответ на аналогичный вопрос относительно любой точки в пределах диаграммы.
5. Определить весовое количество жидкой части раствора в точке а.
Искомая величина будет, очевидно, равна у =Q—х; подставляя сюда найденное выше выражение для х, находим
Диаграммы состояния всех двойных сплавов строятся аналогичным способом, т. е. путем перенесения критических точек с кривых охлаждения на диаграмму, в которой по оси X откладываются весовые проценты компонентов, а по оси У температуры.
Рассмотрим главные типы диаграмм состояния двойных сплавов.
1) Диаграмма состояния двойных сплавов, образующих при затвердевании смесь кристаллов чистых компонентов. Явления, происходящие при затвердевании таких сплавов, совершенно аналогичны тем, которые происходят при затвердевании раствора поваренной соли в воде. Рассмотрим в виде примера сплав свинца с сурьмой, структура которого относится к рассматриваемому типу.
Чтобы получить диаграмму состояния сплавов системы свинец—сурьма, строим предварительно кривые охлаждения для сплавов с различным содер
жанием свинца и сурьмы, затем берем систему осей координат ХY и, откладывая по оси X весовые соотношения свинца и сурьмы, а по оси Y — температуры, переносим на нее с кривых охлаждения критические точки.
Чем больше будет взято для наблюдения сплавов с различным содержанием свинца и сурьмы, т. е. чем больше будет построено кривых охлаждения, тем более точно может быть построена диаграмма состояния.
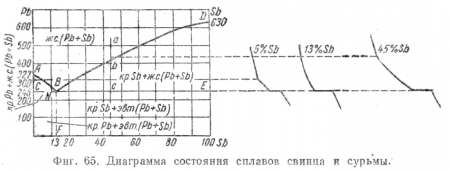
Главных критических точек будет три: температура плавления свинца (327°), температура плавления сурьмы (630°) и температура плавления эвтектики этого сплава (246°), получающаяся, как показывает опыт, при 13% содержания в сплаве сурьмы.
Построенная таким путем диаграмма представлена на фиг. 65; справа от диаграммы помещено несколько кривых охлаждения, по которым такая диаграмма строится (для 5, 13 и 45% Sb). Все задачи, которые были поставлены выше для растворов Н20—NaCl и решены графически, при помощи диаграммы состояния, могут быть решены таким же методом и для сплава.
Проследим за изменением в состоянии сплава с содержанием 45% Sb при охлаждении его от 500°. От а до b (фиг. 65) сплав находится в жидком состоянии и представляет собой одну фазу жидкого раствора; в точке b начинается выделение из жидкого раствора кристаллов Sb; в интервале от b до с сплав представляет смесь двух фаз — жидкого раствора и твердых кристаллов Sb, при этом состав жидкой фазы изменяется по линии ликвидуса bВ и в точке с доходит до концентрации 13% Sb. В точке с происходит затвердевание оставшегося жидкого сплава и распадение его на эвтектическую смесь кристаллов Рb и Sb. В период затвердевания эвтектики, пока сплав находится при температуре 246°, он представляет собой смесь трех фаз — жидкого раствора (Pb, Sb), кристаллов Рb и кристаллов Sb. Ниже точки с сплав представляет смесь двух фаз — кристаллов Рb и кристаллов Sb.
Пример. Определить количество эвтектики в сплаве, состоящем из 10% Sb и 90% Рb.
Рассуждаем так: эвтектика затвердевает при 246°, следовательно, когда температура рассматриваемого сплава, снижаясь, достигнет 246°, вся жидкая его часть при застывании образует эвтектику; таким образом, задача сводится к тому, чтобы определить количество жидкой фазы в точке N. Решение можно будет отыскать, применяя формулу
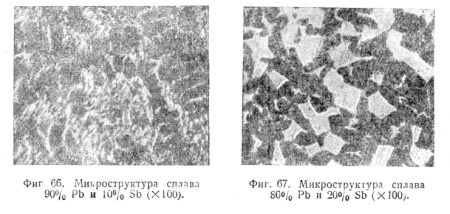
На фиг. 66 приведена микроструктура одного из доэвтектических сплавов, содержащего 90% Рb и 10% Sb; на фотографии видны древовидные образования кристаллов свинца, окруженные эвтектикой.
На фиг. 67 представлена микроструктура одного из заэвтектических сплавов, содержащего 80% Рb и 20% Sb. Здесь на фоне мелкозернистой массы выступают более крупные кристаллы сурьмы.
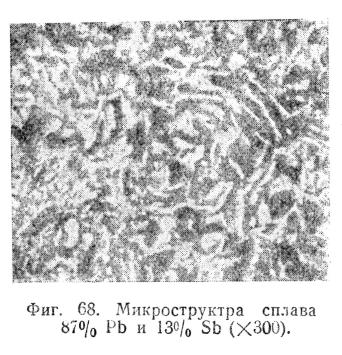
На фиг. 68 можно видеть микроструктуру эвтектики сплава свинец —сурьма.
Диаграммы состояния сплава свинец — сурьма представляют собой частный случай диаграммы состояния двойных сплавов, образующих при затвердевании смесь кристаллов чистых компонентов. В общем виде диаграмма состояния сплавов компонентов А и В представлена на фиг. 69; температуры плавления компонентов —- соответственно ta и tb\ эвтектика затвердевает при температуре tэвт; содерание компонента В в эвтектике равно k%.
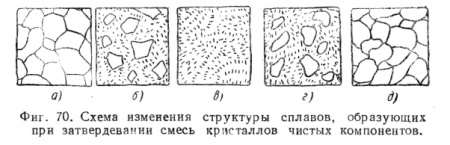
Построение этой диаграммы аналогично построению диаграммы сплава свинец — сурьма. На фиг. 70 представлена схема изменения структуры сплавов А и В, диаграмма состояния которых дана на фиг, 69; на фиг. 70, а показана структура компонента А (соответствует точке а на диаграмме состояния фиг. 69); ка фиг. 70, б — структура доэвтектических сплавов (точка б на диаграмме); на фиг. 70, в — структура эвтектического сплава (точка в диаграммы); на фиг. 70, г — структура заэвтектических сплавов (точка г диаграммы); на фиг. 70, д — структура компонента В (точка д диаграммы). Такого типа диаграммы состояния имеют, кроме сплава свинец — сурьма, ряд сплавов, например, кадмий — висмут, алюминий — олово, олово — цинк.
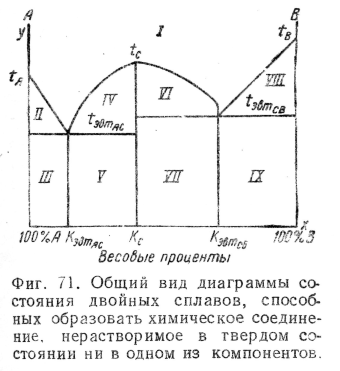
2) Диаграммы состояния двойных сплавов, способных образовать химические соединения, нерастворимые в твердом состоянии ни в одном из компонентов. Рассмотрим случай, когда компоненты сплава А и В способны образовать лишь одно химическое соединение С.
Пусть для образования химического соединения С требуется Кс%В и (100— Кс)% А; если количество В будет меньше Кс%, то в результате взаимодействия А и В образуется С при некотором свободном остатке свободного A; при избытке же В сверх Кс% образуется С при наличии остатка свободного В. Диаграмма состояния таких сплавов из А и В представлена на фиг, 71.
Области этой диаграммы имеют следующие значения:
При концентрации, равной КэвтАс%, получим эвтектику (А + С).
При концентрации, равной Кс%, получим С.
При концентрации, равной Кэвтсв%у получим эвтектику (С + В).
Имеются металлы, способные образовать между собой не одно, а несколько химических соединений.
В качестве примера таких сплавов приводится диаграмма (фиг. 72) для сплавов меди с магнием, способных образовать химические соединения Cu2Mg и CuMg2 при 17 и 43% магния. Диаграмму состояния сплава медь—-магний можно рассматривать как сложенные вместе три диаграммы первого типа:
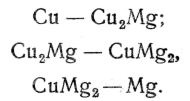
3)Диаграмма состояния двойных сплавов, компоненты которых обладают полной взаимной растворимостью как в жидком, так и в твердом виде. Если два тела способны сохранить взаимную растворимость не только в жидком, но и в твердом состоянии, то при затвердевании они образуют кристаллы смешанного состава. Вещества, входящие в состав кристаллов твердого раствора, могут содержаться в этих кристаллах в произвольных весовых отношениях.
Если два тела способны к образованию твердых растворов, то при затвердевании жидких растворов этих тел из жидкости начинается выпадение кристаллов твердого раствора, более богатых компонентом, повышающим температуру плавления раствора. Таким образом, кристаллы твердого раствора имеют переменный состав; в случае медленного охлаждения состав кристаллов твердого раствора может выравниваться вследствие диффузии.
Допустим, что вещества А и В, имеющие температуры плавления tA и tB ,способны к образованию твердого раствора. Составим из этих веществ ряд смесей всевозможных концентраций В и А и построим для каждой смеси кривую охлаждения, подобную кривой на фиг. 73 (правая часть чертежа). Возьмем с каждой кривой охлаждения точки начала и конца затвердевания и перенесем их на диаграмму состояния, затем соединим все точки начала затвердевания одной линией и все точки конца затвердевания — другой. Первая из этих линий будет, очевидно, линией ликвидуса, а вторая — солидуса. В результате такого построения получим диаграмму состояния, представленную на фиг. 73: здесь tAmtB — линия ликвидуса и tAntB— линия солидуса.
При температурах, лежащих выше температуры, определяемой точкой 1 на кривой охлаждения, сплав состава К представляет
собой жидкую фазу; в интервале температур, определяемых точками 1 и 2, сплав имеет две фазы— жидкий раствор и кристаллы твердого раствора; при температурах, лежащих ниже температур, определяемых точкой 2, сплав представляет одну твердую фазу (твердый раствор). Возьмем сплав, содержащий К%В при температуре г; состояние этого сплава на диаграмме определяется точкой q. Из диаграммы видно, что при температуре t° сплав будет находиться частью в твердом и частью в жидком состоянии. Рассматривая линию tpqr, можно заметить, что при температуре t0 нацело затвердевает сплав, содержащий tr% В, и в совершенно жидком состоянии будет сплав, содержащий tp%B. С изменением температуры точка q будет перемещаться кверху или книзу по линии kq, а точки г и р будут скользить по линиям солидуса и ликвидуса; следовательно, состав твердой фазы сплава во время затвердевания будет изменяться по линии tAntB, а состав жидкой фазы — по линии tAmtB.
Определим также и весовые количества твердой и жидкой фаз сплава для случая, когда его состояние определяется точкой q диаграммы.
Обозначим для этого:

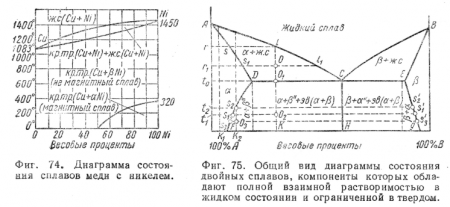
На фиг. 74 приведен частный случай диаграммы состояния сплава из двух компонентов, обладающих полной взаимной растворимостью как в жидком, так и в твердом состоянии, — сплава меди и никеля Кроме линий ликвидуса и солидуса. на диаграмме состояния сплава медь—никель имеется линия, указывающая на магнитное превращение, происходящее при твердом состоянии сплава. Это превращение происходит для чистого никеля при 320°, а для его сплавов с медью при более низких температурах. Температура превращения тем ниже, чем больше меди находится в сплаве.
При температурах, лежащих ниже 320°, никель обладает магнитными свойствами — это aNi; при более высоких температурах никель их теряет— это pNi. Из диаграммы видно, что сплав никеля с медью практически перестает быть магнитным при содержании меди, близком к 50%.
Из числа сплавов, образующих при затвердевании непрерывный ряд твердых растворов, кроме сплава меди с никелем, можно указать, например, сплавы железа с никелем или хромом, золота с медью или серебром.
Нужно иметь в виду, что некоторые из диаграмм состояния сплавов, образующих твердые растворы, имеют более сложные очертания линий ликвидуса
и солидуса, чем диаграмма для сплава медь — никель, а также имеют в некоторых случаях очень сложную систему линий, указывающих на превращения, происходящие при твердом состоянии сплава.
4) Диаграмма состояния сплавов, обладающих полной взаимной растворимостью в жидком виде и ограниченной в твердом. Большинство металлов обладает способностью растворять в себе другие металлы или металлоиды лишь в ограниченной степени. Если такой ограниченной взаимной растворимостью обладают вещества А и В, то при затвердевании доэвтектических сплавов сначала будут выпадать кристаллы А, содержащие в растворе некоторое количество В, а при затвердевании заэвтектических сплавов кристаллы В, содержащие в растворе некоторые количества А; эвтектика же будет состоять из кристаллов двух твердых растворов.
Диаграмма состояний сплава из двух компонентов, обладающих полной взаимной растворимостью в жидком виде и ограниченной в твердом, представлена в общем виде на фиг. 75. Эта диаграмма будет вполне понятна, если мы проследим по ней за охлаждением нескольких сплавов, состав которых соответствует наиболее характерным областям диаграммы.
Рассмотрим несколько случаев.
а) Сплав содержит К% В.
В точке l начинается затвердевание сплава; кристаллы твердого раствора а, образующиеся в точке /, содержат rs % В; при снижении температуры, когда состояние сплава будет определяться точкой О, кристаллы твердого раствора будут содержать r1s1 % В. Таким образом, состав твердого раствора будет изменяться по линии sD а состав жидкого — по линии /С. Для точки О количество твердой фазы будет относиться к количеству жидкой, как Ol1 : Os1.
В точке O1 сплав будет состоять из твердого раствора а, содержащего t0D % В, и жидкого раствора, содержащего t0C% В. Жидкая часть при затвердевании образует эвтектику, состоящую из твердых растворов а Кси р, содержащих соответственно t0D% В и t0E% В. При дальнейшем охлаждении сплава происходит уменьшение взаимной растворимости компонентов A и В и выделение вторичных кристаллов b из твердого раствора а и вторичных кристаллов а из твердого раствора b; изменение составов кристаллов твердых растворов ниже температуры t°0 происходит по линиям DF и EG; например, в точке O2при температуре сплав будет состоять из двух твердых растворов состава s1 и s'1, которые образуются в результате распада твердых растворов состава D и Е.
б)Сплав содержит K1 % В.
Из диаграммы ясно, что этот сплав после затвердевания будет состоять только из кристаллов твердого раствора а состава K1% В.
в) Сплав содержит K2% Б.
При охлаждении этого сплава до температуры ниже t2 из насыщенного твердого раствора а начнут выделяться кристаллы твердого раствра b состава S1- Для точки O3 состав твердых растворов определяется точками S и S3.
Менее общим будет случай, когда растворимость одного компонента в другом не уменьшается с понижением температуры.
Такие сплавы в пределах определенных концентраций дают эвтектическую структуру; в виде примера можно указать сплав Ag — Сu.
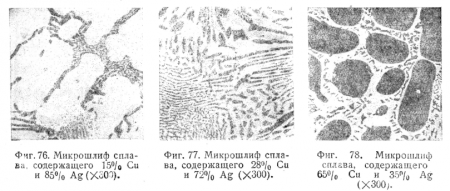
На фиг. 76 дана фотография шлифа сплава 15% Сu и 85% Ag; здесь видны кристаллы твердого раствора меди в серебре, окруженные эвтектикой; на фиг. 77 — фотография шлифа сплава 28% Сu и 72% Ag — эвтектического; характерное строение эвтектики ясно видно на фотографии; на фиг. 78 — фотография шлифа сплава 65% Сu и 35% Ag. Здесь видны кристаллы твердого раствора серебра в меди, окруженные эвтектикой твердых растворов.
Необходимо отметить, что для большинства систем, которым раньше приписывались диаграммы первого типа (металлы, взаимно нерастворимые в твердом состоянии), при детальном изучении была обнаружена незначительная взаимная растворимость компонентов. Так, например, свинец растворяет в твердом состоянии до 2,5% сурьмы, а сурьма около 4% свинца. Повидимому, какую-то (хотя бы ничтожную) взаимную растворимость в твердом состоянии имеют все способные сплавляться между собой металлы, так что диаграмма первого типа является лишь схемой.
5)Перитектическсе превращение. Перитектическим называется такой вид превращения, при котором жидкий сплав, взаимодействуя с ранее образовавшимися кристаллами, образует новый вид кристаллов.
Перитектические превращения происходят при постоянной температуре.
На фиг. 79 приведен общий вид диаграммы состояния с перитектическим превращением.
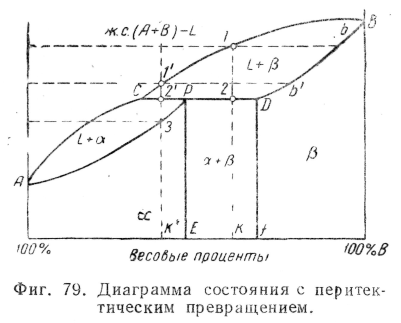
Линией ликвидуса здесь является линия АСВ, линией солидуса — APDB; перитектическое превращение происходит при температуре, определяемой отрезком CPD, параллельным оси X.
Проследим за охлаждением сплава, содержащего К% В.
Кристаллизация начинается в точке 1; содержание компонента В в образующихся кристаллах твердого раствора р определяется точкой b; при падении температуры от 1 до 2 содержание В в кристаллах твердого раствора меняется
по линии bD, а в жидком сплаве по линии 1C; при температуре 2 жидкий сплав и кристаллы твердого раствора р, содержащие D% B, взаимодействуя, образуют твердый раствор а, содержание В в котором определяется точкой Р; перитектический процесс образования твердого раствора а может быть выражен так:
![]()
Таким образом, после перитектического превращения этот сплав будет состоять из твердых растворов а и р; структура этих двух твердых фаз будет состоять из крупных участков ранее образовавшихся кристаллов b и участков, образовавшихся затем из кристаллов b и жидкого сплава кристаллов а. Следовательно, в результате перитектического превращения получается несходная с эвтектической структура, состоящая из сочетания участков двух фаз твердых растворов а и b.
Рассмотрим процесс кристаллизации сплава, содержащего К1%В. В этом случае при перитектическом превращении вследствие избытка жидкой фазы на образование кристаллов а расходуется все количество кристаллов b ранее исчерпания всего запаса жидкой фазы; поэтому ниже точки 3, когда весь сплав будет в твердом состоянии, он будет состоять только из кристаллов твердого раствора а.
Скачать реферат:
Пароль на архив: privetstudent.com