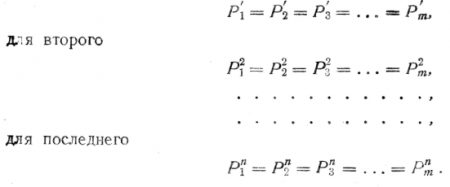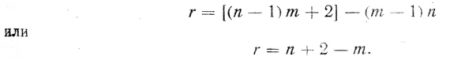Сплавы можно рассматривать как совокупность компонентов, связанных между собой силами межатомного или межмолекулярного притяжения и отталкивания. Если сплав находится в таком состоянии, которое отвечает минимальному термодинамическому потенциалу при данных температуре и давлении, составляющие сплав вещества не обнаруживают стремления к взаимным перемещениям. Такое состояние является устойчивым, равновесным.
При изменении внешних условий — температуры и давления — в сплаве могут происходить превращения — переход из твердого состояния в жидкое, взаимное растворение компонентов, аллотропические превращения, образование химических соединений. Все эти превращения всегда направлены к тому, чтобы система сплава снова пришла в устойчивое состояние, нарушенное изменением внешних условий.
Как было сказано ранее, фазой называют физически и химически однородную часть сплава, которая отделена от других однородных частей сплава «поверхностью раздела». Следовательно, сплав в жидком состоянии представляет собой обычно однофазную систему. Сплав, состоящий из смеси кристаллов двух твердых растворов, имеет две фазы; сплав, являющийся однородным твердым раствором, однофазен и т. д.
Возможность изменения температуры, давления или концентрации без изменения числа фаз называют степенью свободы системы (сплава). Например, если число степеней свободы равно единице, то можно изменить только один из названных факторов, чтобы число фаз сплава не изменилось. Количественную зависимость между числом степеней свободы системы и числом компонентов и фаз принято называть правилом фаз.
Если при определенной температуре и определенном давлении в системе прекратились перемещения компонентов из одной фазы в другую, система пришла в равновесие или в устойчивое состояние. Это возможно в том случае, когда термодинамический потенциал каждого из компонентов будет одинаковым во всех фазах; при несоблюдении этого условия произойдет движение компонента от места высшего потенциала к месту низшего, пока термодинамические потенциалы его не сделаются одинаковыми во всех фазах.
Пусть имеется система сплава, состоящего из n компонентов; пусть число его фаз равно т. Обозначим термодинамические потенциалы через Р с указанием сверху номера компонента и снизу фазы.
Условием равновесия для каждого компонента является равенство термодинамического потенциала во всех фазах; для первого компонента это условие выразится так:
Если мы возьмем разность между числом написанных уравнений и числом входящих в уравнение переменных, то эта разность определит число вариантов решения уравнений.
В каждой строке имеется (т— 1) уравнений и в п строках имеется (т—1) n уравнений.
Переменными являются концентрации, температура и давление.
Число переменных концентраций будет зависеть от числа компонентов и фаз; в каждую фазу могут входить все компоненты, поэтому переменных концентраций для каждой фазы может быть (n—1), а для т фаз — число переменных концентраций (n—1) т. Но у нас имеется еще две переменные величины — температура и давление; следовательно, полное число переменных будет
![]()
тогда числy вариантов решении, равное числу степеней свободы нашей системы, будет
Принимая давление постоянным, можно считать
![]()
Таким образом, приведенное равенство и является выражением числовой зависимости между числом степеней свободы системы сплава и числом его компонентов и фаз.
При r = 0, т. е. когда число переменных равно числу уравнений, каждое переменное получает лишь одно значение. Следовательно, система не имеет степеней свободы и может существовать лишь при определенной температуре и концентрации; такую систему называют абсолютной и нонвариантной (безвариантной).При r =1, т. е. когда система имеет одну степень свободы, имеем
такую систему называют одновариантной или моновариантной.
т. е. число фаз на единицу меньше числа компонентов; такая система называется двухвариантной.
При r = 3 система называется трехвариантной и т. д.
Рассмотрим в качестве примера применение правила фаз к сплаву свинца с сурьмой; здесь n = 2.
Пусть сплав находится в расплавленном состоянии; для такого состояния т =1. Тогда по правилу фаз r = n + 1 — т = 2 + 1 — 1 =2, т. е. система сплава имеет две степени свободы. Отсюда следует, что в известном интервале температур к жидкому сплаву свинца с сурьмой можно прибавлять некоторые количества свинца или сурьмы, а также изменять температуру, и сплав будет оставаться в жидком состоянии.
В период затвердевания того же сплава имеют место случаи затвердевания до начала образования эвтектики и с момента ее образования. В первом случае сплав, имеет две фазы — жидкую и кристаллы (свинца или сурьмы) вариантность системы будет
r=n+1 — m = 2+1— 2 = 1;
следовательно, система моновариантна — мы можем менять лишь один фактор — температуру; концентрация же должна оставаться вполне определенной и соответствовать выбранной температуре. Во втором случае (затвердевание с образованием эвтектики) мы имеем три фазы: жидкий сплав, кристаллы свинца и кристаллы сурьмы. Тогда уравнение
r = n + 1 — т
принимает вид
r = 2 + 1 — 3 = 0;
следовательно, система сделалась нонвариантной: концентрация и температура этого сплава на все время процесса образования эвтектики не изменяются; это подтверждается и диаграммой состояния сплава свинца с сурьмой, приведенной на фиг. 65.
Из материала, изложенного в § 16, 17 и 18, можно сделать следующие выводы
1. Выше были подробно рассмотрены наиболее типичные диаграммы состояния двойных сплавов. Мы уже обращали внимание на то, что многие реальные сплавы являются многокомпонентными, т. е. содержат три, четыре и более компонентов. Поэтому на практике приходится часто пользоваться, например, диаграммами состояния тройных сплавов, учитывать влияние четвертого компонента, пятого и т. д. Многокомпонентные системы изучены еще слабо, но принципы исследования многокомпонентных сплавов остаются те же, что и принципы, использованные нами при анализе двойных сплавов.
2. Диаграммы состояния реальных сплавов часто имеют очень сложный вид. Но следует иметь в виду, что описанные выше диаграммы состояния являются теми элементами, из которых обычно состоят диаграммы промышленных сплавов, например,
![]()
Таким образом, значение основных типов диаграмм позволит разобраться и в этих сложных диаграммах.
3.Диаграмма состояния дает нам возможность для любого из сплавов данной системы определить его фазы и охарактеризовать структуру для равновесного состояния (т. е. после достаточно медленного охлаждения).
Но в конечном итоге мы интересуемся свойствами сплава. Диаграммы состояния во многих случаях могут в этом отношении оказаться полезными. Работами акад. Н. С. Курнакова и его учеников установлен ряд принципиальных положений о связи диаграмм состояния со свойствами.
Основные из них заключаются в следующем.
Как видно из рассмотренных диаграмм состояния, в определенных областях концентраций сплавы могут быть однофазными и представлять собой твердые растворы, в других областях концентраций сплавы могут быть двухфазными; при изменении состава сплавов, лежащих в двухфазных областях, изменяется количественное соотношение фаз. Оказывается, зная свойства компонентов, образующих сплав (свойства чистых веществ или химических соединений), можно составить представление и о свойствах сплава.
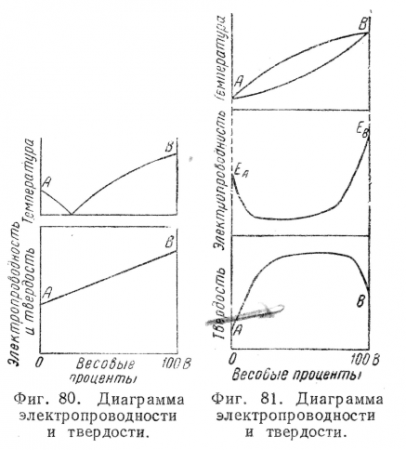
Установлено, что в двухфазных сплавах многие свойства - электропроводность, твердость — обычно изменяются при изменении состава по закону прямой линии (или, как говорят, аддитивно), т. е. величина, например, электропроводности для любого сплава двухфазной области будет определяться как среднее арифметическое от величины твердости фаз, образующих данный сплав (фиг. 80).
Более сложная зависимость свойств от состава наблюдается в однофазных областях.
Например, твердость при увеличении концентрации твердого раствора сначала растет, а затем падает (фиг. 81), т. е. минимальную твердость имеют чистые компоненты.
Изменение электропроводности в случае изменения состава твердого раствора имеет обратный характер, т. е. чистые компоненты имеют максимальную величину электропроводности. Отсюда становится понятным и факт, хорошо известный в практике, что наивысшей электропроводностью обладают чистые металлы.
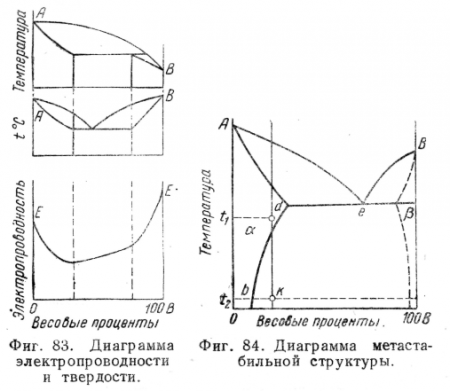
На фиг. 82 и 83 даны более сложные диаграммы состояния и схемы изменения свойств (электропроводности). Для других свойств (физических, механических) наблюдаются подобные же типы связи с составом и природой сплавов (или по типу изменения электропроводности, или по типу изменения твердости).
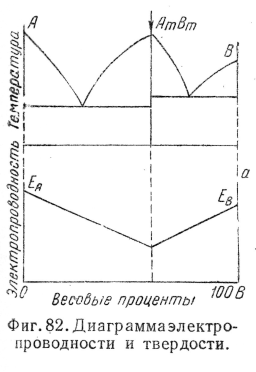
Очевидно, что на основании этих схем мы можем судить лишь о направлении изменений свойств при изменении состава и получать ориентировочные данные.
4. Следует еще раз подчеркнуть, что диаграммы состояния подчиняются правилам фаз и, следовательно, являются диаграммами равновесия, т. е. дают сведения о равновесных фазах и равновесных или «стабильных» структурах, образующихся при соответствующей температуре после достаточно длительной выдержки. Это обстоятельство важно потому, что все превращения в сплавах (затвердевание, превращения в твердом состоянии и т. п.) протекают с определенной скоростью. Фактор времени диаграммой состояния не учитывается, но сильно отражается на структуре сплава. При чрезвычайно медленном охлаждении эвтектического сплава можно получить структуру, состоящую из совершенно обособленных крупных кристаллов твердых фаз и, наоборот, очень быстрое охлаждение сплава неэвтектического состава может привести к типично эвтектической структуре, т. е. к тесной механической смеси твердых фаз.
Далее, если, например, сплав (фиг. 84) очень быстро охладить от температуры t1 где его структура представляет собой твердый раствор, до комнатной температуры t2, то выделение избыточного компонента при высоких температурах произойти не успеет, а при низких температурах этот процесс из-за малой подвижности атомов будет затруднен. Таким образом, будет зафиксирована неравновесная (или метастабильная) структура пересыщенного твердого раствора. Дальше мы увидим, каким образом в практике термической обработки сплавов используются эти возможности управления изменениями структуры сплавов.
Скачать реферат:
Пароль на архив: privetstudent.com