Протяженность метастабильной области зависит от природы вещества, от степени загрязненности и других причин. При перемешивании максимально возможное переохлаждение воды, при котором еще не наступает самопроизвольная кристаллизация, не превышает 0,4—0,5° С; вода, находящаяся в спокойном состоянии, может быть переохлаждена до 30° С. Многие органические вещества (тимол, салол и др.) допускают переохлаждение более чем на
20° С. Металлы характеризуются небольшим протяжением метастабильной области.
Кристаллизация из метастабильного состояния может быть вызвана, если предварительно затратить работу А на образование поверхности раздела двух фаз, т. е. затравочного кристалла. При этом вероятность образования зародыша а находится в экспоненттияльной зависимости от работы А.
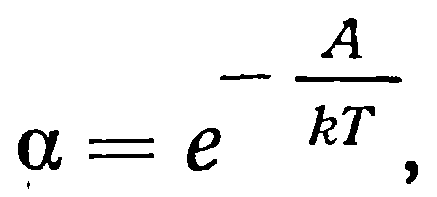
где r — газовая постоянная Больцмана,
Т—абсолютная температура.
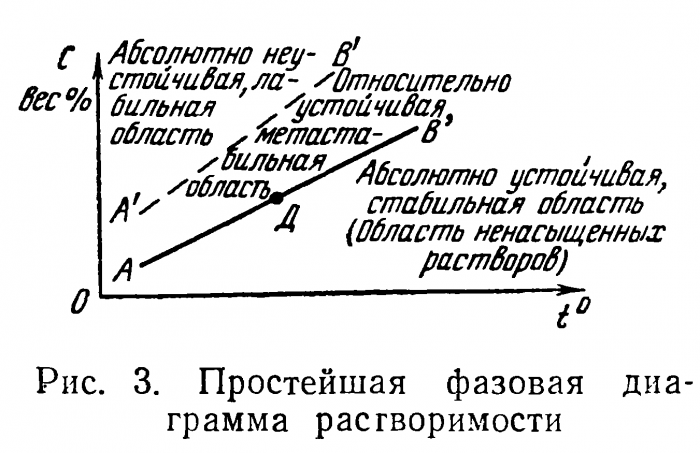
Как видно из фазовой диаграммы воды (см. рис. 2), вероятность образования зародышей возрастает по мере продвижения от кривой ОВ влево. Нет четкой границы метастабильной и области спонтанной (самопроизвольной) кристаллизации жидкости, которая наступает, когда величина созданного запаса энергии больше или равна работе, затраченной на образование зародыша.
Например, для кристаллизации ортохлорнитробензола необходимо затратить А = 22000 кал/г моль. Кристаллизация, как и любой фазовый переход, значительно легче осуществляется на примесях. Если систему особенно тщательно очистить от примесей, то, будучи в большой мере переохлажденной, она потеряет способность к кристаллизации. Многочисленные опыты по выдержке переохлажденных, предварительно перегретых, тщательно очищенных и помещенных в герметически закрытых сосудах жидкостей, показывают, что верхняя граница метастабильной области А'В' (рис. 3) может быть сдвинута далеко влево.
Одним из параметров кристаллизации является время. Процессы кристаллизации, рассматриваемые во времени, называют кинетическими. Различают три типа кинетических кривых кристаллизации.
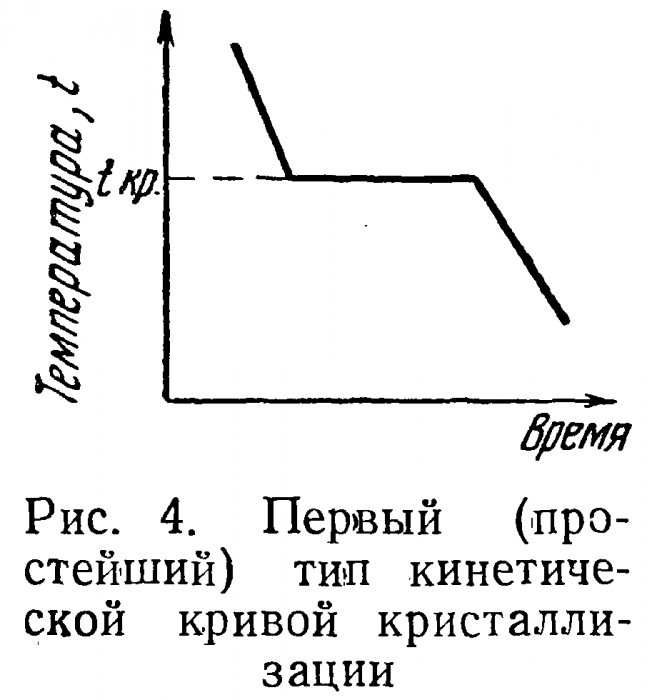
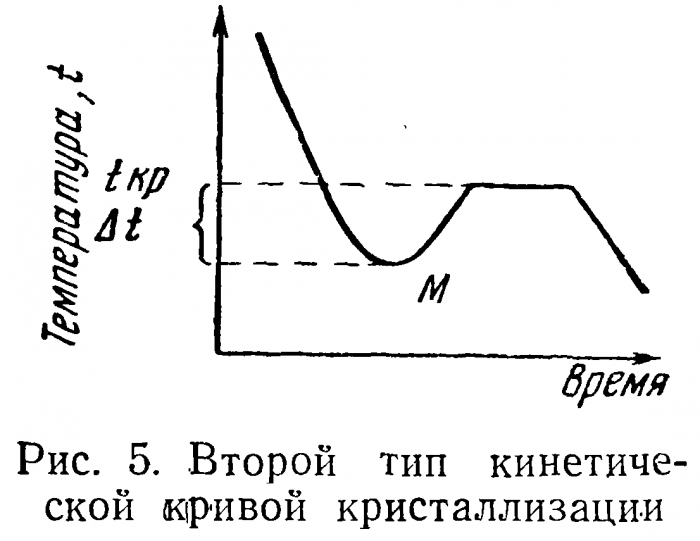
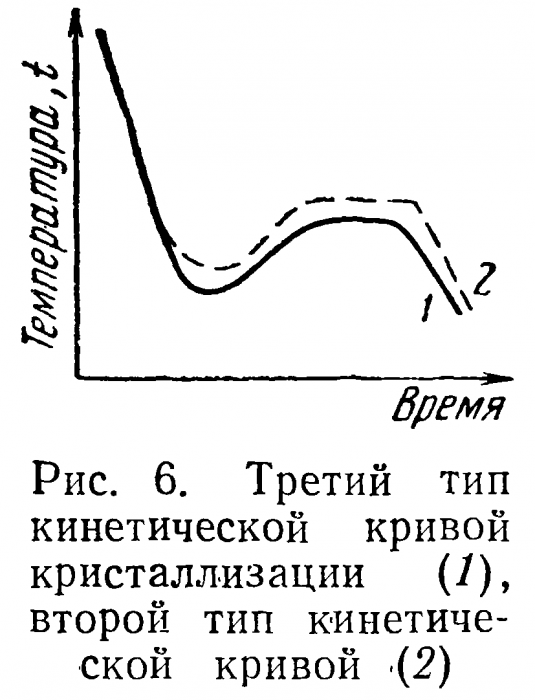
Простейший тип кинетической кривой показан на рис. 4. На оси ординат отложена температура, на оси абсцисс — время, tKP — температура кристаллизации. Кривая этого вида отражает идеализированное представление о процессах кристаллизации. На самом деле начало кристаллизации обычно имеет место при температурах более низких, чем tKP (рис. 5). Тепло кристаллизации в М нагревает систему и она принимает температуру кристаллизации tKP (Дt—степень переохлаждения). При значительном переохлаждении и быстром процессе охлаждения подъем температуры может и не достигнуть этого уровня. В этом случае наблюдаемая температура не будет равна истинной температуре кристаллизации (рис. 6).
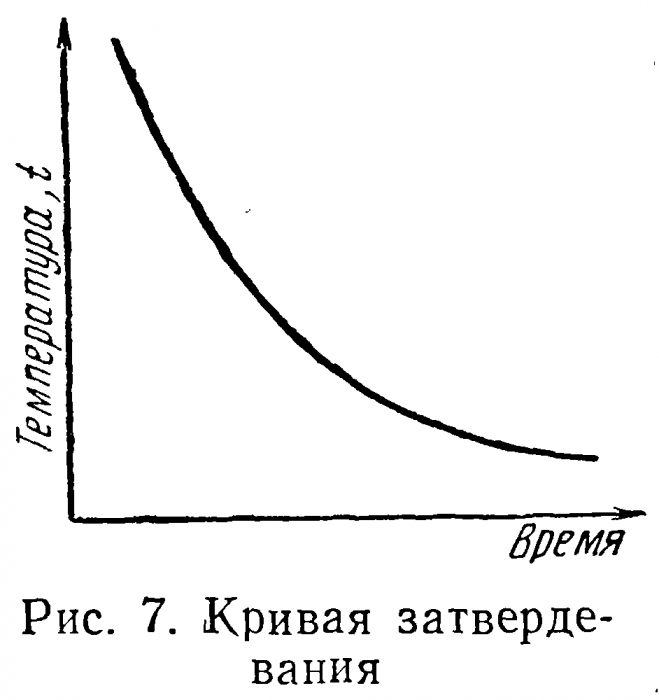
Нередки случаи, когда кристаллическое вещество после плавления и последующего охлаждения переходит в аморфное состояние (рис. 7). Это характерно для жидкостей с большой вязкостью, препятствующей кристаллизации, или происходит, когда охлаждение
ведется слишком быстро и жидкость, хотя и подвижная, «не успевает» закристаллизоваться даже в присутствии затравок и переходит в вязкое, аморфное состояние. Характерными примерами таких веществ могут служить сахар, превращающийся в кара-мель, кварц — в стекло и т. д.
Чтобы закристаллизовать аморфные вещества, которые причисляются к телам, находящимся в неустойчивом состоянии, необходимо продолжительно выдерживать их в размягченном состоянии в присутствии готовых центров кристаллизации. Принципиально в этих условиях может быть закристаллизовано всякое аморфное вещество. Таковы явления «расстекловывания» стекла, долгое время находящегося в размягченном состоянии, «засахаривание» карамели, потеря каучуком эластичности и т. д.
Температура плавления остается неизменной только при постоянстве внешнего давления. При увеличении давления температура плавления может либо повышаться, либо понижаться. Для изменения температуры плавления на несколько градусов необходимо изменить давление на тысячи атмосфер.
Удельный объем, как правило, претерпевает резкое изменение при переходе вещества из жидкого состояния в кристаллическое. Знак этого изменения зависит от кристаллической структуры вещества. Большинство кристаллических тел при кристаллизации уменьшается в объеме, особенно сильно — железо, олово, свинец. Вода, висмут, кремний и другие вещества при кристаллизации расширяются. В практике кристаллизации знак и величина изменения объема, конечно, очень важны.