Кристаллизация из растворов и расплавов
Растворами называются такие системы, в которых одно вещество равномерно распределено в среде другого или других веществ. В общем случае этот термин может относиться к любому агрегатному состоянию системы. Сюда входят смеси газов, жидкие растворы и твердые растворы или смешанные кристаллы. Процесс растворения связан с различными взаимодействиями химического и физического характера между частицами растворенного вещества и растворителя.
Частицы, образующие раствор, могут быть атомами, молекулами или ионами. В соответствии с этим различают атомные, молекулярные, ионные растворы (электролиты), которые часто называются истинными растворами. Если растворенное вещество не находится в состоянии молекулярной (атомной, ионной) дисперсности, то тогда говорят о коллоидных растворах. И, наконец, более крупные частицы (агрегаты) составляют механические смеси.
Сейчас в вопросах о строении жидкостей, в частности растворов, преобладает та точка зрения, которая рассматривает жидкость ближе к кристаллу, чем к газу. Отсюда следует активная роль жидкости то отрешению к растущему в ней кристаллу. Это можно проиллюстрировать на примере воды и некоторых водных растворов, структуры которых в последнее время подвергаются детальному изучению.
В агрегировании молекул воды основную роль играют осуществляемые протонами водородные связи, энергия которых (5—10 ккал/моль) зависит от длины. Она невелика по сравнению с энергией ионной и ковалентной (сотни ккал/моль), но значительна по сравнению с энергией вандер-ваальсовских связей. Без водородных связей, судя по тенденции изменения температур у аналогичных веществ, вода имела бы tпл — 100° С и tкип — 80° С. Направленность водородной связи роднит ее с ковалентной, поэтому среди кристаллов с водородными связями часто встречаются рыхлые структуры. Такова и структура льда. О ней обычно говорят, что она аналогична структуре тридимита с тем отличием, что протон колеблется между двумя атомами кислорода. Молекула воды связана с четырьмя ближайшими соседями, в результате чего образуется ажурная постройка.
Увеличение (плотности при переходе лед—вода составляет 10%. Уплотнение происходит за счет того, что часть молекул воды (10%) приобретает координационное число 6. Такое состояние воды неустойчиво. Меняющееся соотношение между разного рода молекулами (в отношении координации) объясняет целый ряд аномалий воды.
Структуру воды можно также сравнить со структурой алмаза, в котором, однако, состояние атома связано парами ковалентных электронов, тогда как в воде связь осуществляется единственным осциллирующим протоном.
Растворение в воде сводится к внедрению в ее структуру ионов посторонних веществ, что приводит к целому ряду эффектов, величина которых зависит от размера иона, его заряда, концентрации.
Процесс растворения есть процесс химический, т. е. он происходит при непременном взаимодействии растворяемого вещества и растворителя. Это всегда сопровождается тепловыми, объемными и другими явлениями. Последние рассматривают как следствие возникновения в растворах группировок (в большей или меньшей степени неустойчивых во времени), состоящих из иона (Me) растворенного вещества и окружающих ионов (молекул) растворителя. Прочность группировки или комплекса определяется типом связи ион—кислород воды >(Ме—О). Экспериментально доказано, что в случае побочных подгрупп связь Me—О имеет ковалентный характер. Степень ковалентности (прочности) связи Me—О помимо индивидуальных свойств самого иона будет зависеть от концентрации других ионов с соответствующим значением электроотрицательности. В щелочных растворах связь в гидратных комплексах прочнее, чем в растворах с большой концентрацией ионов и с высоким значением электроотрицательности водорода, хлора и др. Так, в водных растворах едкого натра кремнезем существует в виде комплексов [Si04]*aq, алюминий в виде [Al04]*aq, цинк в виде [Zn04]*aq, марганец в виде [Mn06]*aq и т. д. Все эти комплексы являются основным «строительным материалом» при синтезе алюмо-цинкосиликатов и силикатов марганца в водных растворах NaOH. Впервые Н. В. Беловым показано для цеолитподобных фаз, что алюмо-кремнекислородные тетраэдры в силу своей химической инертности строят каркас вокруг активных центров «затравок». Роль таких затравок играют крупные ассоциации молекул воды или натриевые, гидратированные центры.
Можно говорить о ближней и дальней сольватации (гидратации). Под ближней — понимают прочное, постоянное связывание ионом молекул растворителя, под дальней — изменения, происходящие с остальной частью молекул растворителя (изменение скорости диффузии, плотности и пр.). Их различают по величине скорости диффузии молекул воды, находящихся в непосредственной близости от иона (по О. Я. Самойлову).
Взаимодействие между ионом и растворителем не ограничивается только ближайшими молекулами. В растворе вся масса воды оказывается в сильном электростатическом поле ионов. Образовавшиеся в растворе гидратные комплексы определяют структурную характеристику кристаллизующейся фазы.
Весьма распространенно представление о сиботактическом строении жидкости. В момент плавления исчезает единая кристаллическая решетка, но взаимные расположения атомов не становятся вполне произвольными. Таким образом, не только вода, но и другие вещества при плавлении отчасти сохраняют структуру («ближний» порядок, но не «дальний») соответствующего твердого тела. Показано, что способность жидкости к переохлаждению зависит от различия структуры жидкости и твердого тела. Чем меньше разница между этими структурами, тем больше склонность жидкости к переохлаждению. Для воды показано, что, кроме того, степень переохлаждения зависит от предыдущей истории жидкости и до перегрева ~30°С переохлаждение пропорционально предварительному перегреву. Последнее связано с тем, что в воде велико время релаксации — время установления равновесного состояния в данных условиях. При термической обработке нарушается равновесие— ближний порядок, который затем лишь медленно восстанавливается.
Все эти факты и соображения заставляют подходить к изучению растворов, как структурных систем. Кристаллизация из растворов есть прежде всего перегруппировка частиц. Ряд авторов, начиная с П. П. Орлова и П. А. Замятченского, описывая кристаллизацию из растворов, выделяют процессы дегидратации (десольватации), с одной стороны, и процесс взаимодействия («атаки») частиц раствора с кристаллической поверхностью, с другой. Легко видеть, что структура грани играет важнейшую роль в кристаллизации вещества из растворов.
При выращивании кристаллов из растворов мы имеем дело с многокомпонентными системами. В простейшем случае (двойной системе) одной компонентой выступает растворяемое кристаллическое вещество, другой — растворитель. Однако практически приходится считаться с тем, что в растворах присутствуют различного рода примеси, оказывающие заметное влияние на процесс кристаллизации и свойства растущего кристалла. Полностью исключить это влияние представляет собой очень сложную и трудоемкую задачу. Во всяком случае, успешное выращивание идеальных монокристаллов возможно при использовании достаточно чистых реактивов.
Процесс кристаллизации из раствора состоит в отдаче растворителем избытка растворенного в нем вещества. Отсюда следует, что кристаллы могут выпадать только из пересыщенных растворов.
Пересыщение можно вызвать удалением (например, испарением) растворителя или изменением (снижением или повышением) температуры. Удаление растворителя можно осуществить также путем введения в раствор другого вещества, более растворимого, чем -первое. Осаждение первоначально растворенного вещества будет результатом частичного отнятия растворителя вторым вновь введенным в раствор веществом. Так, добавление парафина к раствору серы в сероуглероде обусловливает выделение из раствора кристаллов серы. Введение спирта в насыщенные водные растворы многих неорганических солей почти всегда приводит к образованию в массе раствора облака мелких кристаллов растворенных солей.
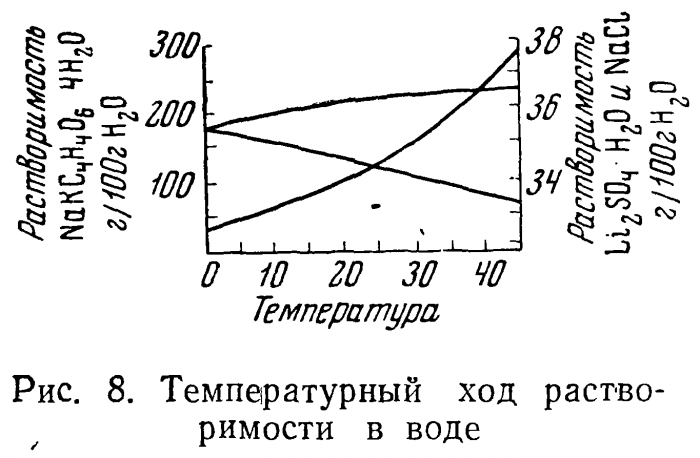
Для подавляющего большинства веществ растворимость падает при снижении температуры. Это имеет место в отношении сегнетовой соли NaKC4H406*4H20, квасцов, медного купороса, сахара (в водных растворах) и т. д. Путем понижения температуры насыщенных растворов таких веществ можно перевести в пересыщенную, а затем и в кристаллическую фазу определенное количество вещества из каждого литра раствора. Наоборот, в солях, растворимость которых понижается с повышением температуры (сульфат лития Li2S04*H20, КС1 и др.), определенное количество вещества можно выделить нагреванием раствора (рис. 8). Говорят, что вещества первой группы имеют положительный температурный коэффициент растворимости (т.к.р.), а вещества второй — отрицательный.
Очевидно, что вещества с ходом т.к.р., близким нулю, не пригодны для выращивания монокристаллов по методу изменения температур. К веществам этой группы относится, например, поваренная соль NaCl. В каких случаях бывает рациональным применение того или иного способа, (показывает форма кривой растворимости (рис. 8).
Пересыщенные растворы, в которых во время их приготовления тщательно уничтожены все зародыши, способны сохраняться в герметически закрытых сосудах неопределенно долгое время, не кристаллизуясь. Однако имеется некоторый предел, при переходе которого в растворе наступает самопроизвольная кристаллизация. Достижимая степень пересыщения изменяется от вещества к веществу в весьма широких пределах.
На рисунке 3 представлена простейшая фазовая диаграмма реальных растворов. Стабильной области, расположенной ниже кривой растворимости АВ, соответствуют ненасыщенные растворы, которые могут оставаться однофазными неопределенно долгое время. В них кристаллы растворяются. Кристаллы же, введенные в раствор, отвечающий, например, точке Д, могут неопределенно долго оставаться без изменения. Это состояние определяется как подвижное равновесие, когда скорости роста и растворения кристалла одинаковы. В метастабильной области теоретически возможное начало кристаллизации практически никогда не наблюдается. Однако кристалл, помещенный в раствор, отвечающий метастабильной области, будет расти. Чем дальше точка Д раствора от кривой насыщения, тем более неустойчив он. По достижении кривой А'В', за которой простирается лабильная область, достаточно малейшего «толчка» для начала бурной кристаллизации.
При сильном охлаждении может сильно возрасти вязкость раствора и в связи с этим временное торможение процесса кристаллизации растворенного вещества. При очень быстром охлаждении раствора веществ, состоящих из длинных и сложных молекул, образуется вязкая жидкость, в которой кристаллизация не происходит, а получается стеклообразное вещество.