Гибридизация клеток, принадлежащих к разным видам
Существуют три основные проблемы: 1) природа и специфичность цитоплазматических сигналов, регулирующих синтез РНК в ядрах соматических клеток; 2) механизм репрессии синтеза ядерной РНК; 3) механизм передачи генетической информации из ядра в цитоплазму. Исследования начались в 1965 году с опыта, который мы поставили вместе с Дж. Ф. Уоткинсом. Мы показали, что вирус животных, после инактивации ультрафиолетовыми лучами, может быть использован для индукции слияния клеток мыши и человека и образования их гибридов. Мысль использовать для этой цели вирусы возникла в связи с наблюдениями, сделанными более ста лет назад. Давно известно, что при многих заболеваниях в пораженных тканях обнаруживаются многоядерные клетки. В медицинской литературе XIX века велась длительная и оживленная полемика о механизмах их образования. Многоядерные клетки находят главным образом в очагах поражений, вызванных некоторыми патогенными вирусами. В последнее десятилетие стало ясно, что, по крайней мере в некоторых случаях, вирус вызывает появление многоядерных элементов, индуцируя слияние отдельных клеток. Оставалось сделать всего один шаг, а именно узнать, нельзя ли использовать вирус для того, чтобы индуцировать слияние клеток разных типов, а также выяснить, будут ли жизнеспособными гибриды, если они вообще образуются. Поскольку при заражении живым вирусом гибриды могли погибнуть, обработку производили убитым вирусом. При этом оказалось, что вирус, инактивированный ультра-фиолетовыми лучами, можно использовать для индукции слияния дифференцированных и недифференцированных клеток разных видов и даже разных классов позвоночных. Такой метод дал возможность получать межвидовые гибридные клетки, которые длительное время жили в культуре и во многих случаях обладали способностью к неограниченному размножению. По этой причине они оказались удобной моделью для изучения ядерно-плазменных отношений и дали возможность поставить такие опыты, которые раньше были нереальны. Результаты некоторых опытов я намереваюсь обсудить.
В работе использовали миксовирус Сендай из подгруппы парагриппа, так как, по данным Окада, было известно, что высокие дозы этого вируса стимулируют слияние опухолевых клеток животных. Предварительно вирус облучали такой дозой ультрафиолетового света, которая не влияла на его способность индуцировать слияние клеток, но снижала инфекционность в миллион раз. На начальном этапе работы исследовали клетки двух типов: HeLa (клетки человека, много лет растущие в культуре) и клетки асцитной опухоли Эрлиха (опухолевые клетки мыши, свободно размножающиеся в брюшной полости).
Эти два типа клеток были выбраны по ряду чисто технических причин, но главным образом потому, что их ядра легко отличить по морфологическим признакам. Когда суспензию, содержащую смесь этих клеток, обрабатывают при соответствующих условиях инактивированным вирусом, клетки собираются в группы. На электронных микрофотографиях на поверхностях соседних клеток между переплетающимися микроворсинками видны вирусные частицы. Если клетки инкубировать при 37° С, то оболочки слипшихся клеток в местах контакта растворяются и между клетками образуются цитоплазматические мостики. Число таких мостиков увеличивается до тех пор, пока цитоплазма соседних клеток не сольется полностью и не образуются многоядерные клетки, число ядер в которых может быть разным.
Когда такие клетки помещают в культуральный сосуд, они оседают на дно сосуда или на помещенные в него покровные стекла и через 3—4 ч распластываются по поверхности стекла. При изучении окрашенных препаратов выяснилось, что во многих клетках содержатся как ядра клеток HeLa, так и ядра клеток асцитной опухоли Эрлиха.
Для того чтобы окончательно доказать, что многоядерные клетки в самом деле представляют собой гетерокарионы (т. е. содержат ядра разных типов клеток), популяцию клеток HeLa выращивали в присутствии меченного тритием тимидина до тех пор, пока ядра практически всех клеток не включали метку; затем суспензию, содержащую эти меченые клетки HeLa и немеченые клетки асцитной опухоли Эрлиха, обрабатывали вирусом. Образовавшимся многоядерным клеткам давали возможность прикрепиться к покровному стеклу и затем готовили препараты для получения радиоавтографов. На радиоавтографах было видно, что многоядерные клетки содержат как меченые, так и немеченые ядра, причем меченые ядра обладали морфологическими признаками ядер HeLa, а немеченые — признаками клеток асцитной опухоли Эрлиха. Таким образом, не оставалось сомнения, что под влиянием вируса образуются гибриды, содержащие одновременно ядра клеток человека и мыши.
Синтез макромолекул в гибридных клетках
Далее было интересно выяснить, каковы возможности гибридных клеток: способны ли они синтезировать белок, РНК, ДНК и могут ли они делиться? С помощью 3Н-лейцина удалось установить, что белок в них действительно синтезируется, причем интенсивность метки и характер распределения зерен в цитоплазме гибридов были такими же, как и в соседних одноядерных клетках. После обработки гибридных клеток в течение нескольких минут меченым предшественником РНК метка обнаруживается в обоих типах ядер гетерокариона. Значит, в этих клетках считываются гены и человека, и мыши. При более длительной инкубации с меченым предшественником РНК метка выявляется также и в цитоплазматической РНК. Следовательно, синтез РНК в гетерокарионах подчиняется тем же закономерностям, что и в одноядерных клетках, за одним исключением — в гетерокарионе в этом процессе одновременно участвуют ядра клеток человека и мыши.
Обработка 3Н-тимидином показала, что в ядрах обоих типов синтезируется также и ДНК. Сначала синтез ДНК в ядрах гетерокарионов происходит не одновременно, но постепенно этот процесс синхронизируется. Особенно легко синхронизация синтеза ДНК достигается в многоядерных клетках с одинаковыми ядрами. Наблюдается она и в гетерокарионах; однако в некоторых случаях при слиянии клеток очень далеких видов животных синхронизация синтеза ДНК может не наступить. В клетках, содержащих всего два ядра, наблюдается, как правило, более полная синхронизация, чем в клетках, где число ядер больше.
Образование и поведение одноядерных гибридных клеток
Хотя многоядерные клетки, образовавшиеся в результате слияния, при благоприятных условиях сохраняют жизнеспособность в течение нескольких недель, способность же к дальнейшей репродукции зависит от образования одноядерных дочерних клеток. Дочерние клетки могут образовываться разными способами, но каковы бы ни были эти способы, все они характеризуются слиянием отдельных ядер гетерокариона в одно более крупное ядро. Такое слияние происходит во время митоза. В двухъядерной клетке при синхронном митозе обычно образуется одно веретено деления. Все хромосомы располагаются в общей метафазной пластинке. В результате деления образуются две дочерние одноядерные клетки, содержащие в своих ядрах хромосомы обеих родительских клеток. Встречаются также и другие типы митозов, особенно часто трех- и четырехполюсные, при которых возникает различное число дочерних клеток, причем некоторые из них оказываются двухъядерными. Иногда ядра гетерокариона вступают в митоз, но сама клетка при этом не делится: после митоза все хромосомы могут объединиться либо в одно очень крупное ядро, либо образуются два ядра, каждое из которых содержит хромосомы обоих родителей. В гетерокарионах, содержащих больше двух ядер, абортивные и неправильные митозы происходят чаще, тем не менее и в этих условиях все же иногда возникают дочерние клетки, содержащие хромосомы разных родительских клеток. Таким образом, существует несколько способов образования из гетерокарионов дочерних гибридных клеток с одним ядром, содержащим генетический материал обеих исходных клеток.
Эти одноядерные гибридные клетки также синтезируют белок, РНК, ДНК и в положенное время приступают к делению; при анализе метафазных пластинок было обнаружено, что соотношение хромосом обоих родителей бывает в них разным. Многие одноядерные гибридные клетки способны к неограниченному размножению, причем в большинстве случаев видовые различия между родительскими клетками, по-видимому, не влияют на их способность к репродукции. Благодаря применению вируса удалось произвести гибридизацию клеток мыши и хомячка, мыши и человека и даже мыши и цыпленка и получить одноядерные гибридные клетки, способные к неограниченному размножению. Результаты этих исследований свидетельствуют о том, что клетки самых разных видов позвоночных при слиянии в единое целое вполне совместимы друг с другом. Очевидно, у них нет внутриклеточных механизмов для распознавания чужого, подобных тем, которые ответственны за узнавание и отторжение тканей или органов, пересаженных от одного индивидуума к другому, причем к такому «дружественному» объединению способна не только цитоплазма разных клеток, но также и ядро. Функции сложной гибридной клетки, образующейся после слияния ядер, полностью интегрированы.
Гибриды, получающиеся при слиянии дифференцированных клеток
Я описал гибриды, образующиеся при слиянии клеток, каждая из которых способна к синтезу РНК, ДНК и к делению, но можно также получить гетерокарионы из клеток, в которых частично или полностью подавлен синтез либо ДНК, либо РНК, либо обеих этих нуклеиновых кислот вместе. Клетки, неспособные синтезировать ДНК или РНК, можно объединить друг с другом или с клетками, в которых синтез этих кислот протекает нормально. Такие типы гетерокарионов особенно удобно использовать при изучении цитоплазматических сигналов, регулирующих синтез РНК в ядрах животных клеток, а также механизмов, осуществляющих эту регуляцию.
Для исследования были выбраны три типа высокодифференцированных клеток: макрофаги кролика, лимфоциты крысы и эритроциты курицы. Макрофаги — подвижные фагоцитирующие клетки, основная функция которых — очистка тканей организма от продуктов распада. Эти клетки можно выделить в больших количествах из брюшной полости кролика путем некоторых экспериментальных воздействий. Ядро клеток имеет овальную или бобовидную форму. Макрофаги, выделенные из брюшной полости кролика, синтезируют РНК, но не синтезируют ДНК и не делятся ни в организме, ни in vitro.
Лимфоциты представляют собой мелкие клетки с плотным компактным ядром, окруженным очень небольшим количеством цитоплазмы. Чистую популяцию малых лимфоцитов можно получить из грудного лимфатического протока крысы. Малые лимфоциты синтезируют неодинаковое количество РНК: после инкубации в течение 1 ч с радиоактивным предшественником РНК, взятым в очень высокой концентрации, в некоторых клетках метка практически отсутствует, т. е. в них почти не синтезируется РНК, тогда как в других лимфоцитах в этих же условиях включается значительное количество предшественника. Обычно малые лимфоциты не синтезируют ДНК и не делятся, но они могут начать синтезировать ДНК и делиться, если их обработать антигеном. В этом случае они превращаются в клетки, играющие главную роль в иммунном ответе организма.
Эритроциты большинства млекопитающих, как правило, утрачивают ядра в процессе созревания, эритроциты же птиц, амфибий, рептилий, а также некоторых млекопитающих сохраняют ядро в течение всего жизненного цикла клетки. Зрелые эритроциты курицы, содержащие ядро, не синтезируют заметных количеств РНК и ДНК и не делятся. Это предельно дифференцированные, так называемые «конечные» клетки. После определенного периода циркуляции в крови они разрушаются. Поэтому казалось интересным узнать, особенно это касается эритроцитов, содержащих ядра, обратимы ли изменения, возникающие в процессе дифференцировки. Можно ли заставить инертную или частично инактивированную клетку возобновить синтез РНК, ДНК или обеих этих нуклеиновых кислот, если объединить ее в гетерокарионе с клеткой, нормально синтезирующей нуклеиновые кислоты?
Меняя количественное соотношение двух типов клеток и концентрацию инактивированного вируса, в определенных пределах удается контролировать число и соотношение типов ядер в гетерокарионах.
Следовательно, в этих гетерокарионах, как и в гетерокарионах HeLa — клетка Эрлиха, в синтезе РНК принимают участие и те и другие ядра. Такой результат не удивителен; известно, что и клетки HeLa, и макрофаги способны синтезировать РНК. Гораздо интереснее тот факт, что при инкубации гетерокарионов, образованных макрофагами и клетками HeLa, с меченым тимидином метка включается не только в ядра клеток HeLa, но и в ядра макрофагов. Если через сутки после слияния клеток ввести в среду на 1 ч меченый тимидин, то в гетерокарионах оказываются мечеными более 80% ядер макрофагов. Из этого следует, что неспособность макрофагов синтезировать ДНК, а значит, и реплицировать свой генетический материал, обратима: после слияния макрофага с клеткой HeLa в его ядре вновь начинается синтез ДНК.
Такой же результат был получен при исследовании гетерокарионов HeLa — малые лимфоциты крысы. Для того чтобы практически все ядра HeLa и лимфоцитов в этих гетерокарионах оказались мечеными, достаточно всего на 20 мин ввести в среду 3Н-уридин. А поскольку даже после часовой экспозиции с радиоактивными предшественниками РНК, взятыми к тому же в очень высокой концентрации, почти половина малых лимфоцитов, выделенных из грудного протока, остается немеченой, очевидно, что многие ядра лимфоцитов в гетерокарионе получили сигнал к возобновлению или, по крайней мере, к резкому увеличению синтеза РНК. Когда же к гетерокарионам HeLa — лимфоциты добавили 3Н-тимидин, оказалось, что не только в ядрах клеток HeLa, но и в ядрах лимфоцитов синтезируется ДНК.
Еще более поразительны результаты, полученные при изучении гетерокарионов HeLa — куриные эритроциты. В зрелых куриных эритроцитах меченые предшественники не включаются в РНК и ДНК в таком количестве, которое можно определить с помощью радиоавтографии. Даже когда эти клетки несколько часов инкубируют в присутствии высоких концентраций меченных тритием рибонуклеозидов или тимидина, на радиоавтографах, полученных соответствующим образом, не наблюдается достоверно меченных ядер. Однако если с меченым уридином инкубируют гетерокарионы HeLa — куриные эритроциты даже в течение всего лишь 15—20 мин, то оказывается, что не только в ядрах HeLa, но и в большинстве ядер эритроцитов синтезируется РНК. Следовательно, можно заключить, что в этих гетерокарионах восстанавливается генетическая активность обычно инертных ядер эритроцитов. С помощью меченого тимидина удалось показать, что в гетерокарионах многие ядра эритроцитов возобновляют также и синтез ДНК . Так как из всех клеток позвоночных, содержащих ядра, эритроциты птиц представляют собой одну из самых дифференцированных форм, можно, по-видимому, сделать вывод, что пока в клетке есть ядро, все ограничения, которые дифференцировка накладывает на синтез нуклеиновых кислот, в значительной мере обратимы.
Можно также предположить, что возобновление синтеза РНК и ДНК происходит не потому, что покоящиеся или частично инактивированные ядра эритроцитов попадают в цитоплазму клетки, в которой содержатся инструкции для синтеза нуклеиновых кислот в своем собственном ядре, а только потому, что они оказались в чужой цитоплазме: восстановление их активности рассматривается тогда как неспецифичная реакция на «чужеродное» окружение. Это предположение можно проверить разными способами, например исследовать гетерокарионы, образовавшиеся при слиянии дифференцированных клеток. Так, если получить гетерокарионы макрофаг кролика — лимфоцит крысы или макрофаг кролика — куриный эритроцит, то все ядра окажутся в чужой или в частично чужой цитоплазме; полученные гетерокарионы отличаются от гетерокарионов, образовавшихся при слиянии любой из этих клеток с клетками HeLa, тем, что обе родительские клетки не синтезируют ДНК. Поэтому мы вправе ожидать, что с помощью таких гетерокарионов удастся выяснить, действительно ли восстановление синтеза ДНК в покоящемся ядре определяется чужеродностью цитоплазмы гетерокариона или же дело здесь в чем-то ином.
Периферическое расположение ядер в определенных типах многоядерных клеток впервые отметил Ланганс, поэтому, когда в патологических условиях обнаруживают подобные клетки, их обычно называют клетками Ланганса. Такая своеобразная морфология, по-видимому, характерна для гетерокарионов, основным клеточным элементом которых являются макрофаги. Если гетерокарионы макрофаг — лимфоцит обработать 3Н-уридином, то оказывается, что в ядрах обоих типов синтезируется РНК. Следовательно, в клетке вновь активны оба набора генов. В гетерокарионах макрофаг — эритроцит наблюдается такая же картина: в ядрах обоих типов синтезируется РНК. Таким образом, цитоплазма макрофага кролика, как и цитоплазма клетки HeLa, способна стимулировать восстановление генетической активности в покоящемся ядре эритроцита.
Но ни один из этих гетерокарионов не синтезирует ДНК и не делится: сколько бы их ни инкубировали с меченным тритием тимидином, метка не включается ни в одно из ядер. С другой стороны, если в гетерокарионе объединить эритроциты куриного зародыша с фибробластами того же самого зародыша, в ядрах эритроцитов возобновится синтез ДНК, несмотря на то что они находятся не в «чужой», а в «своей» цитоплазме. Значит, покоящиеся ядра возобновляют синтез ДНК в гетерокарионе не потому, что они оказались в «чужой» цитоплазме, а потому, что эта цитоплазма дает им соответствующие инструкции. Когда же ядро эритроцита попадает в цитоплазму макрофага, который обычно синтезирует РНК, а не ДНК, в ядре эритроцита также индуцируется синтез именно РНК, а не ДНК.
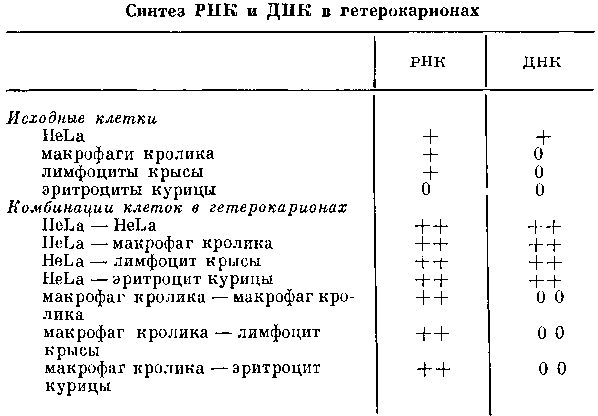
Результаты опытов с дифференцированными клетками приведены в табл. 1. При анализе этих опытов выявляются следующие закономерности: 1) если одна из родительских клеток способна синтезировать РНК, то синтез РНК будет происходить в обоих типах ядер гетерокариона; 2) если одна из родительских клеток способна синтезировать ДНК, то синтез ДНК будет происходить в обоих типах ядер гетерокариона; 3) если ни одна из родительских клеток в норме не синтезирует ДНК, то и гетерокарион также не будет способен к синтезу ДНК. Следовательно, в гетерокарионе регуляция синтеза нуклеиновых кислот происходит всегда только таким образом, что при слиянии клетки, способной к синтезу какой-либо нуклеиновой кислоты, с клеткой, не синтезирующей этой кислоты, активная клетка вызывает такой же синтез у инертного партнера. Инертная клетка никогда не подавляет синтез у активного партнера, даже в гетерокарионах, образованных множеством инертных клеток — макрофагов — с одной активной — клеткой HeLa. Если применить современную терминологию, используемую для описания подобных явлений у бактерий, то в этой ситуации можно сказать, что синтез ДНК и РНК находится под позитивным контролем.
Природа цитоплазматических сигналов
Для изучения природы цитоплазматических сигналов, которые включают синтез нуклеиновых кислот в покоящихся или частично инактивированных ядрах, особенно важны гетерокарионы, содержащие ядра куриных эритроцитов. Все другие описанные мною гетерокарионы образуются при слиянии двух клеток и содержат поэтому не только ядра, но и цитоплазму обоих родителей. Этого нельзя сказать о гетерокарионах, одна из родительских клеток которых — ядерный эритроцит. Дело в том, что вирус Сендай — гемолитический вирус, и при высоких концентрациях, которые используются для индукции слияния клеток, происходит лизис цитоплазмы эритроцитов (гемолиз); в результате этого эритроциты превращаются в так называемые «тени», состоящие почти исключительно из ядер и поврежденных клеточных мембран.
Если суспензию, содержащую куриные эритроциты и клетки человека или мыши, растущие в культуре, обработать вирусом и затем сделать электронные микрофотографии, то можно увидеть скопления теней эритроцитов и культуральных клеток; между их соприкасающимися ободочками находятся вирусные частицы. Как всегда, под влиянием вируса между клетками образуются цитоплазматические мостики. Через эти мостики цитоплазма клеток человека или мыши перетекает в эритроцит, заполняя пространство, освободившееся от его собственной цитоплазмы в результате гемолиза. Затем мембрана культуральной клетки растворяется в месте контакта с эритроцитом, и ядро эритроцита входит в цитоплазму этой клетки. Следовательно, в данном случае гетерокарион образуется путем включения лишенного цитоплазмы ядра эритроцита в цитоплазму клетки человека или мыши.
Тот факт, что гибридные клетки способны функционировать как единое целое, не мало говорит нам о механизмах, регулирующих активность генов. Во всяком случае мы можем быть уверены, что сигналы, посылаемые цитоплазмой гибридной клетки одному из геномов, воспринимаются другим геномом и воспринимаются правильно: если бы эти сигналы для одного из ядер гетерокариона были «ложными», то в конечном счете наблюдались бы прогрессирующие нарушения в обмене веществ всего гетерокариона. Однако известно, что на самом деле некоторые межвидовые гибридные клетки размножаются даже быстрее, чем каждая из родительских клеток в отдельности. Поэтому предположение о том, что один из геномов неправильно воспринимает сигналы гибридной цитоплазмы, можно отклонить. Остается предположить, что либо каждый набор генов реагирует на сигналы только своей собственной цитоплазмы, либо сигпалы, посылаемые гибридной цитоплазмой, одинаково действуют на оба генома. То, что ядра эритроцитов можно вводить в другие клетки и при этом не вносить в них значительного количества цитоплазмы, позволяет нам выяснить, какое из этих двух предположений правильно.
Опыты, которые я здесь описал, показывают, что для реактивации ядра куриного эритроцита не требуется участия его собственной цитоплазмы. Активность ядра эритроцита, лишенного цитоплазмы в результате гемолитического действия вируса Сендай, восстанавливается в цитоплазме клеток самых разных видов животных — от мыши до человека. В этих клетках можно реактивировать также ядра эритроцитов лягушки. Следовательно, ядра эритроцитов действительно отвечают на сигналы, исходящие из совершенно чужой для них цитоплазмы. Такая удивительно полная интеграция при образовании межвидовых гибридных клеток была бы невозможна, если бы каждый набор генов отвечал на сигналы лишь своей собственной цитоплазмы. Восстановление активности ядра эритроцита в цитоплазме клетки человека или мыши проявляется не только в возобновлении синтеза нуклеиновых кислот, но, как я покажу дальше, также и в упорядоченном синтезе специфичных белков, детерминируемых этими ядрами. Итак, мы можем прийти к заключению, что сигналы, исходящие из цитоплазмы клетки человека или мыши, воспринимаются ядром куриного эритроцита совершенно правильно. Иначе говоря, эти цитоплазматические сигналы не видоспецифичны.
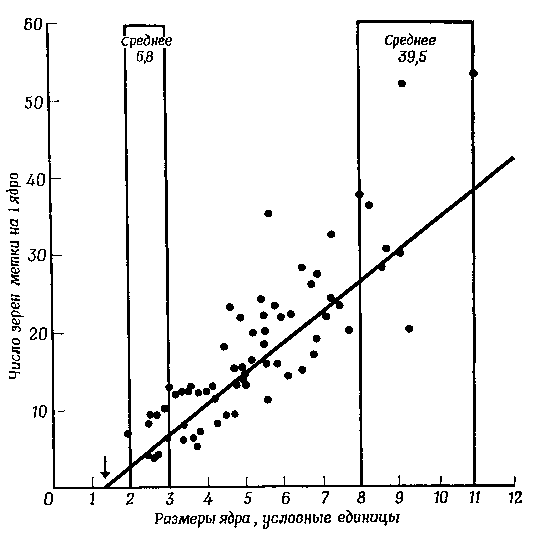
Фиг. 1. Соотношение между максимальными размерами поперечных сечений ядер эритроцитов (способ измерения объема ядра) и числом зерен метки, обнаруженных в этих ядрах на радиоавтографах.
Наиболее заметным морфологическим событием, связанным с реактивацией ядра эритроцита, является резкое увеличение его объема. Хотя точное измерение объема ядра затруднительно, тем не менее очевидно, что оно увеличивается по крайней мере в 20—30 раз. Набухание ядра сопровождается дисперсией его сильно конденсированного хроматина, что легко обнаружить с помощью соответствующих цитологических методик. Если такие гетерокарионы инкубировать в течение нескольких минут с радиоактивным предшественником РНК, то с помощью метода радиоавтографии можно показать, что количество РНК, синтезируемой реактивированным ядром эритроцита в единицу времени, прямо пропорционально увеличению его объема. Как показано на фиг. 1, количество РНК, синтезированной ядром эритроцита, является простой функцией от его объема; в тех же эритроцитах, в которых ядра не увеличились, РНК не синтезируется. Увеличение ядра объясняется не только всасыванием воды: одновременно в 4—6 раз возрастает сухая масса ядра, в основном за счет увеличения содержания белка. Если перед образованием гетерокарионов облучить эритроциты большой дозой ультрафиолетового света, синтез нуклеиновых кислот в их ядрах не возобновляется, но размер таких облученных ядер тем не менее увеличивается, как обычно. Это означает, что набухание ядер в процессе реактивации не связано с синтезом и накоплением в них РНК и ДНК. Следовательно, увеличение ядра — событие, которое управляет синтезом нуклеиновых кислот.
Я только что отметил, что сухая масса ядер эритроцитов, в которых синтез РНК подавлен ультрафиолетовыми лучами, увеличивается так же, как и у необлученных ядер. Облученные ядра не могут синтезировать свои собственные белки, поэтому увеличение их сухой массы обусловлено, по всей вероятности, притоком белков из гибридной цитоплазмы. Несомненно, это белки клеток мыши или человека, которые тем не менее способны вызвать в ядре куриного эритроцита соответствующие процессы. Так как ядро эритроцита в гетерокарионе определяет синтез именно куриных белков, то, следовательно, такое ядро функционирует, и функционирует совершенно нормально в окружении чужеродных белков.
Дисперсия хроматина, происходящая при увеличении ядра эритроцита, сопровождается некоторыми изменениями его структуры, которые могут быть выявлены цитохимическими методами. Наиболее важное из этих изменений состоит в увеличении сродства хроматина к интеркалярным красителям, таким, как акридиновый оранжевый и этидийбромид . Еще до начала репликации ДНК количество связанного хроматином красителя увеличивается приблизительно в 4 раза и в дальнейшем по мере набухания ядра продолжает нарастать. Аналогичные результаты были получены в опытах с эктиномицином D при определении способности этого антибиотика связываться с транслирующимися участками ДНК. В процессе реактивации хроматина увеличивается его чувствительность к тепловой денатурации, что обнаруживают по изменению кривой плавления. Все эти наблюдения свидетельствуют о том, что увеличение ядра сопровождается разрыхлением хроматина, которое делает его более доступным не только для небольших молекул, таких, как акридиновые красители или актиномицин D, но и для макромолекул. Несомненно, этот же процесс делает хроматин более доступным для молекул, участвующих в его транскрипции, так что, чем больше разрыхляется исходно конденсированный хроматин, тем большая его часть считывается.
Многие цитохимические изменения, которые претерпевает ядро эритроцита при реактивации в гетерокарионе, можно вызвать искусственно в тенях эритроцитов, если их обработать при определенных условиях агентами типа хелатов, связывающими двухвалентные катионы. Таким образом, вполне вероятно, что в ядрах эритроцитов, так же как и в ядрах других эукариотических клеток, одним из механизмов, регулирующих транскрипцию ДНК, является взаимодействие хроматина с двухвалентными катионами и другими электролитами. Я уже упоминал, что процессы изменения размеров ядра, появления конденсированных Х-хромосом и образования дополнительных хромоцентров в соматических клетках некоторых позвоночных определенным образом связаны друг с другом; я обсудил также, каким образом изменение баланса электролитов в среде может вызывать избирательную конденсацию хроматина и, следовательно, инактивацию разных частей генома. Результаты изучения ядер эритроцитов, реактивированных в гетерокарионах, полностью подтверждают точку зрения, что генетическая активность регулируется с помощью избирательной конденсации и дисперсии хроматина, а связь между синтезом РНК и размерами ядра свидетельствует о том, что изменение этих размеров представляет собой часть единого механизма, обеспечивающего последовательное включение и выключение соответствующих участков генетического материала. Во всяком случае, если местное изменение баланса электролитов действительно вызывает реактивацию покоящегося ядра эритроцита, то совсем не удивительно, что такая реактивация происходит в цитоплазме клеток животных самых разных видов. С этой точки зрения сигналы, поступающие в ядро куриного эритроцита из цитоплазмы клеток человека или мыши, должны иметь самый общий характер, и, по всей вероятности, они одинаковы у всех клеток позвоночных.
Перенос информации из ядра в цитоплазму.
Результаты опытов по возобновлению активности ядер эритроцитов
Гетерокарионы, одна из родительских клеток которых — ядерный эритроцит, дают нам блестящую возможность для изучения механизма реализации генетической информации в цитоплазме клеток млекопитающих. Восстановление активности ядер эритроцитов, которая до слияния клетки была полностью подавлена, происходит довольно медленно, что позволяет подробно изучать каждую стадию этого процесса. Реактивированные ядра можно в любой момент извлечь из гетерокариона и исследовать синтезированную ими РНК; можно также наблюдать переход этой РНК в цитоплазму и исследовать связь между транскрипцией генов и синтезом соответствующих белков. Короче говоря, с помощью гетерокарионов процесс передачи информации можно изучать с такой точностью, которая вряд ли возможна при работе с любым другим биологическим объектом. В этом разделе будут представлены результаты такого анализа.
При изучении любого белка, синтез которого определяется ядром куриного эритроцита, реактивированного в цитоплазме мышиной или человеческой клетки, необходимо прежде всего доказать, что исследуемый белок именно куриный, а не мышиный или человеческий. Поэтому первыми для изучения в гетерокарионах были выбраны белки, представляющие собой видоспецифичные поверхностные антигены. Их выявляют на поверхности клеток, растущих в культуре, с помощью высокоспецифичного и очень чувствительного метода гемадсорбции с применением смеси антиглобулинов. В качестве маркеров используются сенсибилизированные эритроциты, которые антисывороткой прикрепляются к тем точкам поверхности гетерокариона, где находятся куриные антигены. Если правильно подобрать разведение антисыворотки, то можно избежать перекрестной реакции между куриными и мышиными (или человеческими) антигенами, поэтому адсорбцию эритроцитов на поверхности гетерокарионов можно считать доказательством того, что на ней находятся куриные антигены.
Поскольку такие гетерокарионы образуются в результате включения тени эритроцита в клетку-реципиент, сразу же после слияния на поверхности гетерокариона появляются компоненты мембраны эритроцита, которые выявляются с помощью реакции гемадсорбции. В течение первых нескольких дней после слияния антигены ведут себя крайне необычно. Так как в это время ядро куриного эритроцита возобновляет активность и начинает синтезировать большие количества РНК, то следовало бы ожидать, что количество куриных антигенов на поверхности гетерокариона должно увеличиваться. Но в действительности оказалось, что антигены постепенно исчезают с поверхности клеток и на 4-й день у большинства гетерокарионов их уже нельзя обнаружить. При анализе этого явления выяснилось, что исчезновение видоспецифичных куриных антигенов с поверхности гетерокарионов объясняется постепенным вытеснением их антигенами мыши (или человека), которые продолжает синтезировать клетка-реципиент. И хотя все это время в ядрах эритроцитов образуются значительные количества РНК, на поверхности гетерокарионов новые видоспецифичные куриные антигены не появляются. Не изменяется и скорость исчезновения антигенов, встроившихся в мембрану в процессе образования гетерокариона.
В одном очень важном отношении реактивацию ядер эритроцитов в первые два-три дня после слияния клеток можно считать неполноценной: несмотря на то что они заметно увеличиваются в размерах и возобновляют синтез ДНК и РНК, нормальные ядрышки в них не возникают . На третий, а иногда на второй день после слияния в некоторых ядрах появляются мелкие структуры, которые в световом микроскопе напоминают рудиментарные ядрышки, но не обладают признаками, характерными для ядрышек обычных культуральных клеток. Так как эритроциты берут у нормальных кур, нет оснований считать, что у них имеется какой-то генетический дефект. Остается предположить, что либо цитоплазма клетки мыши (или человека) не совсем подходящая среда для ядер куриных эритроцитов, либо эти гетерокарионы живут не столь долго и ядрышко просто не успевает полностью развиться. В первые четыре дня почти все гетерокарионы вступают в митоз, после которого ядра эритроцитов так или иначе перестают существовать как обособленные структуры. Для увеличения продолжительности жизни ядер эритроцитов с тем, чтобы в них успели сформироваться ядрышки, клетку-реципиент облучали определенной дозой у-лучей. Облученные клетки продолжали расти примерно три недели и не вступали в митоз; таким образом создавались условия для более полного развития ядер эритроцитов как самостоятельных элементов гетерокариона. В этих условиях ядрышки в ядрах эритроцитов начинали появляться на третий день и затем постепенно увеличивались в размерах. К одиннадцатому дню более 80% ядер эритроцитов содержали одно или два легко распознаваемых ядрышка.
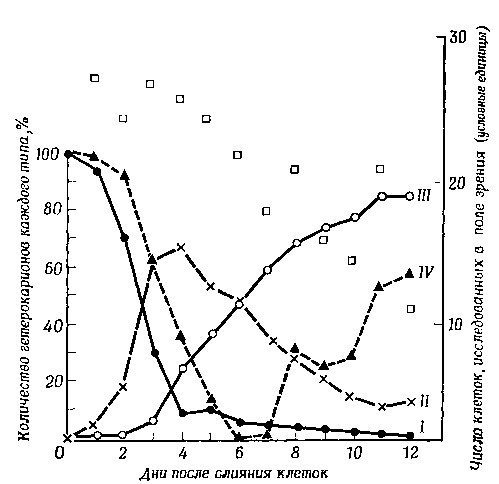
Фиг. 2. Появление куриных видоспецифичных антигенов на поверхности гетерокарионов, образовавшихся при слиянии облученных клеток мыши с эритроцитами взрослых кур.
Видоспецифичные куриные антигены можно обнаружить на поверхности практически всех облученных гетерокарионов сразу же после слияния клеток или в течение последующих суток. Затем, как обычно, эти антигены начинают постепенно исчезать, и к шестому дню их не остается совсем. Однако на восьмой день в некоторых клетках вновь появляются куриные поверхностные антигены, причем сначала они обнаруживаются только на концах цитоплазматических отростков. В последующие дни число клеток, содержащих антиген, увеличивается, и теперь он располагается по всей периферии цитоплазмы. Количество антигена, приходящееся на каждую клетку (определяли методом гемадсорбции), продолжает расти до одиннадцатого дня, когда реакция происходит на всей поверхности большинства гетерокарионов, причем интенсивность этой реакции во много раз превышает ту, которая наблюдалась сразу после слияния клеток.
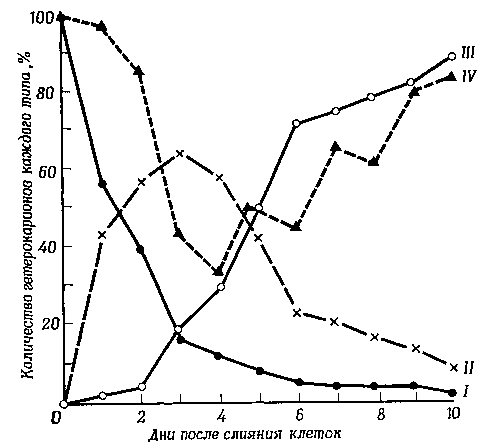
Фиг. 3. Повторное появление куриных видоспецифичпых антигенов на поверхности гетерокарионов, образовавшихся в результате слияния облученных клеток мыши с эритроцитами зародыша курицы.
Опыт с эритроцитами двенадцатидневных куриных зародышей дал по существу аналогичные результаты, только весь процесс протекал быстрее. Уже на второй день после слияния клеток в ядрах эритроцитов начиналось образование ядрышек; и еще до полного исчезновения антигенов, встроившихся в мембрану при слиянии, появлялись уже новые специфичные поверхностные куриные антигены. Когда эритроциты брали у более молодых зародышей, ядрышки и новые поверхностные антигены обнаруживали еще раньше. Во всех случаях наблюдалась четкая связь между скоростью образования ядрышек и временем повторного возникновения на поверхности клеток видоспецифичных куриных антигенов. Следовательно, эти опыты показывают, что ядра куриных эритроцитов могут активироваться в цитоплазме клеток животных самых разных видов и способны контролировать в ней синтез видоспецифичных поверхностных антигенов, но такие реактивированные ядра не индуцируют образование антигенов до тех пор, пока в них не сформируются ядрышки.
Поскольку эти видоспецифичные антигены можно обнаружить только после их появления на поверхности клетки, нельзя исключить возможность того, что между временем их синтеза и временем, когда их удается выявить с помощью метода гемадсорбции, имеется лаг-период. Если этот лаг-период длится довольно долго, то связь между формированием ядрышек и синтезом поверхностных антигенов может быть просто случайной: антигены могут синтезироваться задолого до образования ядрышек. Поэтому очень важно было узнать, как ведут себя другие белки, синтез которых контролируется ядром эритроцита, особенно растворимые, не входящие в состав каких-либо структур. Естественно было выбрать для исследования растворимый фермент, и такой фермент был выбран — это пирофосфорилаза инозиновой кислоты, катализирующая соединение гипоксантина и фосфорибозил-пирофосфата. Так как фосфорилаза необходима для включения гипоксантина в нуклеиновые кислоты, ее содержание можно определять как прямым способом (в гомогенатах клеток), так и косвенным (по включению меченого гипоксантина в интактные клетки). Этот фермент выбрали еще и потому, что имелась подходящая для работы, лишенная пирофосфорилазной активности линия мышиных клеток.
Когда после инкубации клеток Ад с 3Н-гипоксантином делали радиоавтографы, в нуклеиновых кислотах обнаруживали лишь незначительное количество метки. Гетерокарионы, образовавшиеся при слиянии облученных клеток Ад и ядер эритроцитов, в первое время тоже включали очень мало гипоксантина. Увеличение размера и восстановление активности ядер эритроцитов ничего не меняло в этом отношении до тех пор, пока не появлялись ядрышки, после чего способность гетерокарионов включать гипоксантин резко возрастала, а во многих клетках при радиоавтографическом исследовании обнаруживалась меченая РНК. Число ядер эритроцитов, в которых образовались ядрышки, а также включение гипоксантина в гетерокарионы в дальнейшем продолжали расти pari passu. Однако во всех случаях, когда в ядрах эритроцитов, входящих в состав гетерокарионов, не образовывались ядрышки, не увеличивалось и количество включенного гипоксантина. Прямое определение фермента в гомогенатах подтвердило данные, полученные при радио-автографическом исследовании интактных клеток. В первые дни активность пирофосфорилазы инозиновой кислоты в гетерокарионах очень низка, но когда в ядрах эритроцитов начинают образовываться ядрышки, активность ее резко увеличивается и продолжает расти по мере развития ядрышек. Электрофоретическое исследование пирофосфорилазы, синтезированной гетерокарионами, показало, что это фермент, специфичный для клеток курицы, а не для клеток мыши.
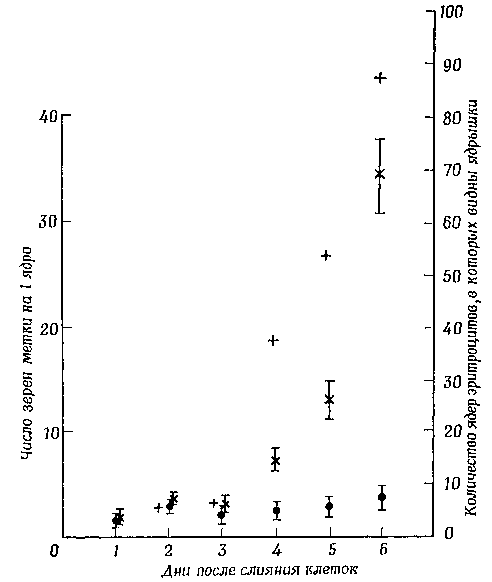
Фиг. 4. Активность пирофосфорилазы инозиновой кислоты у гетерокарионов Аэ — куриный эритроцит (активность фермента определяли по включению 3Н-гипоксантина в нуклеиновую кислоту).
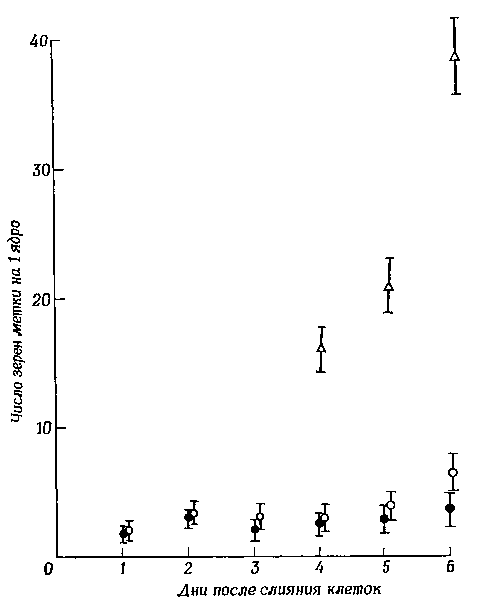
Фиг. 5. Сравнение двух типов гетерокарионов А9 — куриный эритроцит: тех, у которых в ядре эритроцита появилось ядрышко, и тех, у которых его еще нет.
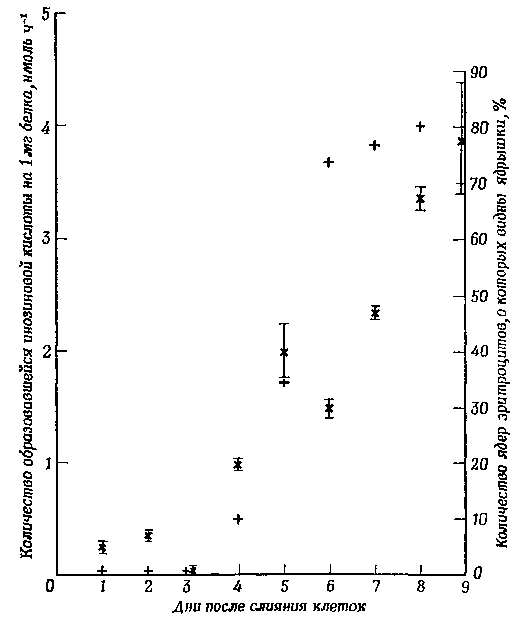
Фиг. 6. Активность пирофосфорилазы инозиновой кислоты в гетерокарионах А9 — куриный эритроцит.
То, что растворимый белок появляется в гетерокарионах одновременно с видоспецифичным куриным поверхностным антигеном, делает маловероятным наличие некоего лаг-периода (продолжительность которого соответствует временной шкале этих экспериментов) между синтезом антигена и его появлением на клеточной поверхности; мы, таким образом, пришли к выводу, что и фермент, и антиген, совершенно не связанные друг с другом ни в структурном, ни в функциональном отношении, начинают синтезироваться в гетерокарионе только после образования ядрышек в ядре эритроцита и не ранее. Сам факт полного отсутствия зависимости между ферментом и антигеном заставляет серьезней отнестись к мысли, что ответственные за эти белки гены начинают считываться только после возникновения ядрышек в ядре эритроцита. Ведь трудно себе представить, почему транскрипция именно этих генов должна быть отложена на несколько дней, а затем вдруг одновременно начаться; у нас нет также оснований считать, что эти конкретные белки принимают участие в функционировании ядрышка. Пожалуй, имеется гораздо больше оснований предположить, что кинетика синтеза всех других белков эритроцита подобна кинетике синтеза этих двух белков и что способность ядра эритроцита определять синтез любых белков зависит от развития ядрышка. Во всяком случае, это предположение послужило отправным пунктом для дальнейших исследований.
Нет необходимости объяснять, насколько важно было выяснить, какие же типы РНК синтезируются в реактивированных ядрах эритроцита до и после образования ядрышек. С этой целью был разработан метод, позволяющий выделять ядра из гетерокарионов и отделять ядра эритроцитов от ядер клеток мыши (или человека). Через различные промежутки времени после образования гетерокарионов в среду добавляли меченые предшественники РНК. Затем методом центрифугирования в градиенте плотности сахарозы изучали РНК, синтезированную в каждом из двух типов ядер гетерокарионов. Оказалось, что ядра клеток мыши (или человека) образуют и «быстрометящуюся, полидисперсную» РНК, и нормальные 28S- и 16S-компоненты РНК, тогда как ядра эритроцитов до появления в них ядрышек синтезируют лишь «полидисперсную» РНК: синтез 28S- и 16S-PHK начинается в них только после формирования ядрышек. Радиоавтографический анализ показал, что до образования ядрышка синтез полидисперсной РНК происходит grosso modo во всем объеме ядра эритроцита, и поэтому она, очевидно, представляет собой результат активности большого числа генов. Таким образом, при анализе этой РНК выявился еще один парадокс: ядра эритроцитов в течение нескольких дней синтезируют высокомолекулярную полидисперсную РНК, представляющую собой продукт деятельности многих генов, и в то же время в них не происходит синтез видоспецифичных белков; но когда в ядрах эритроцитов начинается образование рибосомной РНК (28S- и 16S-PHK), появляются и специфичные для этих ядер белки.
По-видимому, имеется три возможных варианта для объяснения этих наблюдений. Например, что полидисперсная РНК, которая образуется в ядрах эритроцитов до развития ядрышек, не содержит инструкций для синтеза белка. Такое объяснение кажется неприемлемым, поскольку влечет за собой неправдоподобный вывод, что гены, определяющие синтез белков, все это время не транскрибируются, а затем в какой-то момент после появления ядрышка вдруг начинается их транскрипция. Более того, если полидисперсная РНК не содержит хоть сколько-нибудь молекул с инструкциями для синтеза белков, то ее функции непонятны, особенно если учесть, что эта РНК, по-видимому, представляет собой единственный продукт деятельности большой группы генов. Можно также предположить, что полидисперсная РНК содержит инструкции для синтеза белков, но не способна программировать уже существующие рибосомы гетерокариона. Поскольку в гетерокарион почти не попадает цитоплазма эритроцита (тем более, что зрелые эритроциты фактически не содержат рибосом), и все исходно присутствовавшие в гетерокарионе рибосомы представлены рибосомами клеток мыши или человека, нельзя было исключить возможность того, что РНК, образовавшаяся на куриных хромосомах, не способна программировать мышиные или человеческие рибосомы. Однако если гибридные клетки содержали небольшое количество куриного генетического материала, то в таком случае куриные гены были способны определять синтез видоспецифичного фермента, несмотря на то что в этих гибридах не содержалось куриной рибосомной 28S-PHK (которую можно отличить от 28S-компонентa мышиной рибосомной РНК по электрофоретическим свойствам). Отсюда ясно, что синтезируемая на куриных генах РНК может транслироваться в мышиной цитоплазме. И наконец, возможно, что полидисперсная РНК содержит инструкции для синтеза белков, но перенос ее в цитоплазму осуществляется при участии ядрышка. Поэтому РНК, синтезированная до образования ядрышка, не может быть перенесена в цитоплазму и должна разрушаться внутри ядра.
Последнюю возможность проверили в опытах, где отдельные ядра гетерокариона инактивировали микролучом ультрафиолетового света. Если ядра эритроцитов до образования ядрышек не способны выделять синтезированную ими РНК в цитоплазму, то в гетерокарионах с инактивированными ядрами из клеток мыши (или человека) такие «безъядрышковые» ядра эритроцитов не будут стимулировать включение метки в цитоплазматическую РНК при добавлении в среду меченых предшественников РНК. И наоборот, следует ожидать, что ядра эритроцитов начнут вносить свой вклад в цитоплазматическую РНК гетерокариона, а следовательно, способствовать включению в нее метки сразу же после того, как в них образуются ядрышки. Для исследования были выбраны гетерокарионы, содержащие одно мышиное ядро и до четырех ядер куриных эритроцитов. Мышиные ядра инактивировали микролучом и затем гетерокарионы инкубировали с радиоактивным предшественником РНК в течение различных сроков (время инкубации не превышало 6 ч), после чего определяли количество метки в цитоплазматической РНК. Поскольку после облучения ядра даже в одноядерных клетках метка продолжает включаться в цитоплазматическую РНК (хотя и в очень незначительном количестве), контролем в опытах служили одноядерные клетки мыши из этих же самых культур, у которых также облучали ядро. Измерения производили в разные сроки после слияния клеток: когда еще ни в одном ядре эритроцита не образовались ядрышки, когда они начинали появляться в части ядер и, наконец, спустя много дней после того, как в подавляющем большинстве ядер эритроцитов возникали полноценные ядрышки.
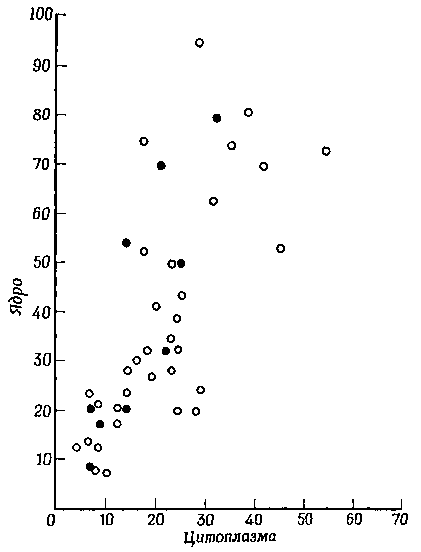
Фиг. 7. Соотношение числа зерен метки в ядре и цитоплазме гетерокарионов и неслившихся клеток мыши.
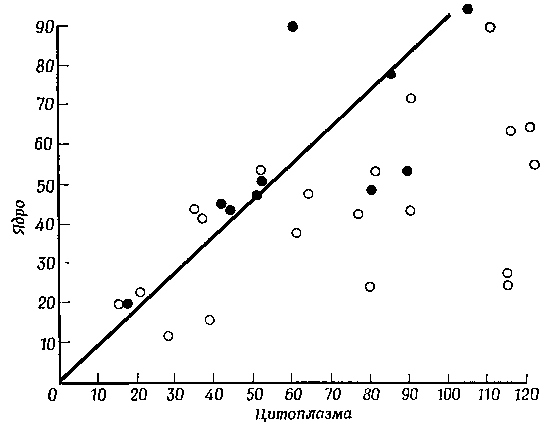
Фиг. 8. Опыт, подобный показанному на фиг. 7, но поставленный на промежуточной стадии, когда в части ядер эритроцитов начали образовываться ядрышки.
До тех пор пока в ядрах эритроцитов еще не появились ядрышки, количество включенной метки в цитоплазму гетерокарионов с инактивированным мышиным ядром не отличалось от такового в контрольных одноядерных мышиных клетках с облученными ядрами. Это наблюдалось даже в гетерокарионах, содержавших по несколько реактивированных ядер эритроцитов, которые, судя по радиоавтографам, совместно синтезировали очень большие количества РНК. Таким образом, несмотря на то, что реактивированные ядра эритроцитов еще до образования ядрышек синтезируют очень много РНК, они не способны выводить хоть сколько-нибудь заметные количества ее в цитоплазму. Опыты, проведенные на стадии, когда в некоторых ядрах эритроцитов уже появились ядрышки, показали, что уровень включения метки в цитоплазму таких гетерокарионов стал теперь заметно выше, чем в одноядерных клетках с облученными ядрами; когда же ядрышки образовались в подавляющем большинстве ядер эритроцитов, в цитоплазме гетерокарионов уже обнаруживалось значительно больше метки, чем в контрольных одноядерных клетках с инактивированным ядром. Приведенные данные позволяют нам понять, почему ядра эритроцитов исходно не могут определять синтез специфичных белков: это невозможно до тех пор, пока в них не разовьются ядрышки; лишь после этого ядра приобретают способность передавать в цитоплазму генетическую информацию.
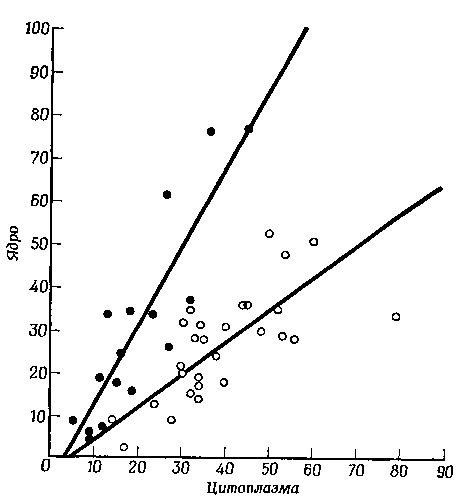
Фиг. 9. Опыт, аналогичный представленным на фиг. 7 и 8, но проведенный на стадии, когда практически во всех ядрах эритроцитов образовались ядрышки.
Конечно, сразу возникает вопрос, относится ли этот вывод только к ядрам эритроцитов, восстановившим активность в таких необычных условиях, или же и в нормальных одноядерных клетках ядрышко играет решающую роль в передаче генетической информации из ядра в цитоплазму. Метод инактивации ядрышка с помощью микролуча ультрафиолетового света позволил получить прямые доказательства участия ядрышка в этом процессе. Для опытов были выбраны нормальные одноядерные клетки HeLa, поскольку многие из них содержат только одно хорошо развитое ядрышко, которое легко инактивировать микролучом. Включение метки в ядерную и цитоплазматическую РНК сравнивали в следующих четырех группах клеток, взятых из одной и той же культуры: 1) необлученные клетки; 2) клетки с одним ядрышком, облученным ультрафиолетовым светом в дозе, снижающей способность к синтезу РНК до 5% нормы; 3) клетки, в которых микролучом в той же дозе облучали внеядрышковую часть ядра (нуклеоплазму); 4) клетки, в которых более широким микролучом облучали целиком все ядро.
Как и в предыдущих опытах, клетки после облучения инкубировали с радиоактивным предшественником РНК в течение различного времени, но не свыше 6 ч, а затем методом радиоавтографии исследовали включение метки в РНК. Было обнаружено, что инактивация только одного ядрышка уменьшала количество меченой РНК в цитоплазме приблизительно на 90% независимо от того, сколько РНК продолжало синтезироваться в остальной части ядра. Такой эффект не мог быть неспецифичным последствием радиации, так как при облучении одной лишь нуклеоплазмы включение метки в цитоплазматическую РНК не снижалось. Облучение всего ядра гораздо большей дозой ультрафиолетового света снижало включение метки в цитоплазматическую РНК примерно так же, как и облучение одного только ядрышка. Результаты этих экспериментов показали, что в отсутствие функционирующего ядрышка РНК, синтезированная остальной частью ядра, не переносится в заметных количествах в цитоплазму.
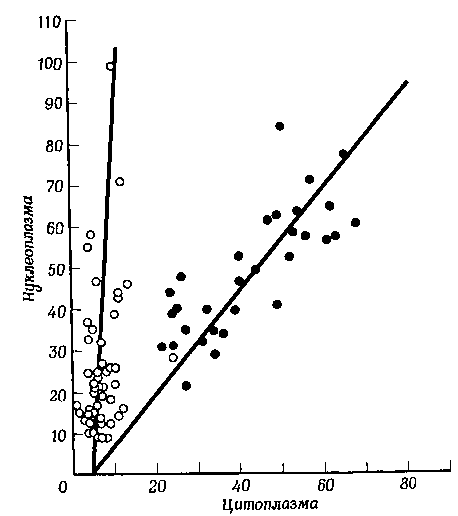
Фиг. 10. Сравнение числа зерен метки в цитоплазме и во внеядрышковой зоне ядра (нуклеоплазме) в необлученных клетках HeLa (черные кружки) и клетках HeLa, у которых облучили ядрышко (белые кружки).
Следовательно, включение метки в РНК одноядерных клеток, у которых инактивировано ядрышко, подтверждает выводы, полученные при изучении ядер эритроцитов, восстановивших свою активность в гетерокарионе. Оба эти случая свидетельствуют об участии ядрышек в переносе не только той РНК, которая образовалась в самом ядрышке, но и РНК, которая синтезировалась в любом другом участке ядра. Чувствительность метода не позволяет, конечно, утверждать, что ядрышко участвует в переносе всей высокомолекулярной РНК из ядра в цитоплазму, но очевидно, что основная часть метки, включенной в РНК, находящуюся вне ядрышка, не может быть перенесена в цитоплазму, если ядрышко искусственно инактивировано или еще не сформировалось. Поэтому кажется маловероятным, что РНК, синтезированная в ядрышке, и РНК, синтезированная в других частях ядра, переносится в цитоплазму клетки независимо друг от друга. Приведенные данные убедительно свидетельствуют о том, что транспорт обоих типов РНК координируется единым механизмом, локализованным в ядрышке или около него.
Эти опыты опровергают любую модель передачи информации из ядра в цитоплазму, в которой постулируется, что РНК, несущая информацию для синтеза белка, проникает из ядра в цитоплазму и там присоединяется к уже существующим рибосомам; они опровергают также любую модель, в которой постулируется переход в ядро цитоплазматических рибосом для того, чтобы снять информационную РНК с генов или перенести ее в цитоплазму. Ядро куриного эритроцита в гетерокарионе не передает в цитоплазму сколько-нибудь заметных количеств РНК и не определяет синтез видоспецифичных белков до тех пор, пока не разовьется его собственное ядрышко и не начнется синтез его собственной 28S-PHK (а возможно, и рибосом). Готовые рибосомы, имеющиеся в цитоплазме гетерокариона, не могут переносить генетическую информацию из «безъядрышкового» ядра эритроцита.
Этот факт очень важен для понимания механизмов реализации генетической информации. Ее поток из ядра в цитоплазму клетки, по-видимому, обязательно сочетается с потоком рибосом; а поток рибосом в свою очередь непосредственно зависит от активности ядрышка. Ядрышко можно рассматривать как центр некоего общего регуляторного механизма, управляющего потоком не только компонентов структурных РНК, какими бы они ни были, но и теми компонентами рибосомного комплекса, которые несут информацию для синтеза белка. Если, исходя из приведенных выше данных, считать, что нет самостоятельного потока информации из ядра в цитоплазму, и если РНК, которая несет инструкции для синтеза белков, переносится в цитоплазму вместе со структурными компонентами рибосомного комплекса, то из этого следует, что в обычных условиях информационная РНК должна обладать в цитоплазме такой же устойчивостью, как и компоненты рибосомного комплекса. Пытаться выявить РНК, несущую инструкции для белкового синтеза, по ее относительной нестабильности с этой точки зрения все равно, что пытаться поймать блуждающие огни. Более того, если генетическая информация не может переходить в цитоплазму без сопутствующего потока рибосом, «репрограммирование» цитоплазмы должно сопровождаться сменой одного семейства «программированных» рибосом другим. Поэтому когда клеткам приходится синтезировать нечто совершенно новое, следует ожидать не только увеличения потока рибосомной РНК из ядра, но и разрушения рибосомных РНК в цитоплазме. И это в точности соответствует тому, что происходит на самом деле.
Поведение реактивированных в гетерокарионе ядер эритроцитов помогает нам понять казавшееся загадочным явление внутриядерного обмена РНК. Если для того чтобы попасть в цитоплазму, образовавшаяся на хромосомах РНК должна сначала быть «захвачена» неким зависящим от активности ядрышка механизмом, то стадией, ограничивающей процесс передачи информации, может оказаться не синтез этой информационной РНК, а ее «захват» ядрышковым механизмом. Если ядрышко играет роль регулятора, что, очевидно, соответствует действительности, то механизм «захвата» должен быть чувствителен к влиянию окружающей среды, в результате чего при изменении условий этим механизмом может захватываться разное количество РНК, синтезированной на хромосомах. Предположение о том, что внутриядерный обмен РНК — это всего лишь распад той РНК, которая не была захвачена ядрышковым механизмом, кажется весьма привлекательным. Если это действительно так, то следует ожидать, что внутриядерные превращения РНК интенсивнее должны происходить в ядрах с плохо развитым или поврежденным ядрышком. Анализ разнообразного экспериментального материала подтверждает это предположение. Но имеется одна трудность. Хотя полидисперсная РНК, по-видимому, представляет собой единственный первичный продукт активности большого числа генов, обнаружить ее в цитоплазме не удается. Поскольку информация, по крайней мере от некоторых генов, все-таки достигает цитоплазмы, приходится предполагать, что РНК, несущая эту информацию, в процессе «захватывания» и выведения в цитоплазму подвергается каким-то вторичным структурным перестройкам, которые меняют ее седиментационные свойства. Но тогда как же нам выявить ее в цитоплазме? Мы располагаем данными, показывающими, что средняя длина молекул «полидисперсной» ядерной РНК очень близка к длине молекул 16S-PHK, что она имеет примерно такой же нуклеотидный состав и что при соответствующих условиях она осаждается в зоне 16 S. Все это свидетельствует о том, что «полидисперсная» РНК, возможно, присутствует в цитоплазме в виде компонентов с коэффициентом седиментации 16 S. Но пока еще мы не можем говорить об этом с уверенностью, и, прежде чем принять или отвергнуть подобную точку зрения, приходится ждать результатов дальнейшего анализа рибонуклеиновых кислот, осаждающихся в зоне 16 S.
Используемая литература: Г. Харрис
Перевод с английского: М. И. Маршак
Ядро и цитоплазма: под ред. и с предисловием д-ра биол. наук Н. И. Шапиро
Москва 1973 год.
Скачать реферат:
Пароль на архив: privetstudent.com