Теория Жакоба и Моно
В 1961 году появилась статья Франсуа Жакоба и Жака Моно озаглавленная «Генетические механизмы регуляции синтеза белка». Предложенная в ней модель регуляции синтеза белка полностью противоречит всем основным заключениям, к которым мы пришли в гл. I. Эта гипотеза в своей простейшей форме предполагает, что регуляторные механизмы действуют не в цитоплазме клетки, где происходит синтез белка (модель цитоплазматического оператора), а непосредственно на уровне генов, контролируя процесс транскрипции ДНК (модель генетического оператора). Данные, которые Жакоб и Моно положили в основу своей теории, были получены на бактериях и ограничивались по преимуществу их собственными исследованиями регуляции синтеза индуцибельного фермента в-галактозидазы у Е. coli. При обсуждении механизмов действия гена нельзя не остановиться на блестящей статье Жакоба и Моно, и не только потому, что она представляет собой величайший интеллектуальный взлет, но также и потому, что выводы, сделанные в этой статье, противоречат всей совокупности фактов, четко установленных при изучении клеток высших организмов. Если модель генетического оператора, предложенная Жакобом и Моно, верна для бактерий, а модель цитоплазматического оператора — для клеток высших организмов, то приходится признать, что механизмы регуляции синтеза белка в бактериальных клетках и клетках высших организмов принципиально различны. Такое заключение, если бы оно подтвердилось, стало бы одним из важнейших биологических обобщений.
Жакоб и Моно сознавали, что генетические эксперименты, составляющие основу их статьи, не противоречат ни «генетической», ни «цитоплазматической» концепции, но они все же пришли к выводу, что данные, и особенно биохи
мические, полученные при изучении бактерий, в целом гораздо лучше объясняются генетической моделью. В пользу этой точки зрения были выдвинуты следующие четыре группы доказательств:
1. У некоторых грамотрицательных бактерий иногда наблюдается координированное проявление активности
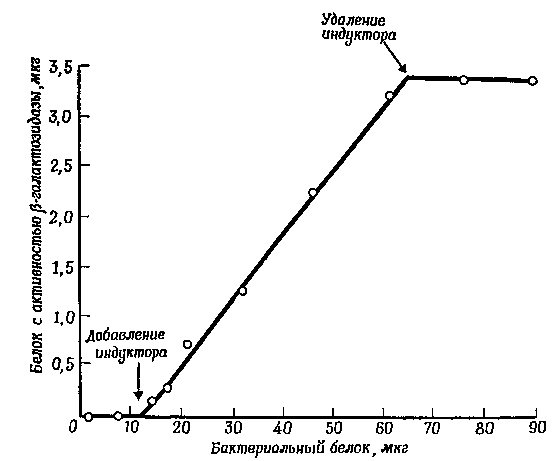
Фиг. 1. Кинетика индуцированного синтеза в-галактозидазы у Escherichia coli.
График, выражающий накопление р-галактозидазы, как функция от приращения массы клеток в растущей культуре.
функционально связанных групп генов, иными словами, синтез ферментов, участвующих в последовательных реакциях какого-либо одного метаболического пути и, очевидно, представленных на бактериальной хромосоме серией близко расположенных или тесно сцепленных генов, согласованно включается и выключается. Казалось, что этот факт очень трудно объяснить с позиций «цитоплазматической» модели хотя бы из-за такой проблемы, как размеры соответствующих цитоплазматических матриц. Сделав некоторые допущения, Жакоб и Моно подсчитали, что для координированной регуляции синтеза трех ферментов с молекулярной массой по 60 000 необходима матрица с молекулярной массой 1, 8-106 дальтон; а так как было известно, что существуют группы из восьми координированно регулируемых ферментов, то оставалось предположить, что существуют матрицы, обладающие соответственными размерами. Однако это представлялось маловероятным, так как в то время считали, что молекулярная масса полирибонуклеотидов Е. coli не превышает 106.
2. В клетке Е. coli синтез в-галактозидазы начинается через 3 мин после добавления в среду соответствующего индуктора и затем продолжается с максимальной скоростью. При удалении индуктора синтез немедленно прекращается. Если бы контроль этого синтеза осуществлялся на уровне генов, то следовало бы ожидать, что, вводя ген, ответственный за в-галактозидазу, в лишенную ее мутантную клетку Е. coli, или, наоборот, удаляя его из нормальной клетки, можно моделировать кинетику индукции и репрессии синтеза фермента. Действительно, было установлено, что, когда при конъюгации структурный ген для в-галактозидазы переходит из нормальной клетки в мутантную, уже через 2—Змин в клетке-реципиенте начинается синтез этого фермента, протекающий с максимальной скоростью. Непосредственное удаление гена из бактериальной клетки едва ли возможно, но предположили, что это можно осуществить косвенным путем, если ввести большую дозу радиоактивного фосфора в содержащую этот ген хромосому перед тем, как она попадет в мутантную клетку-реципиент. При этом ожидали, что при распаде включенного радиоактивного фосфора произойдет инактивация гена in situ. Поставленный эксперимент показал, что и в самом деле по мере разрушения хромосомы под действием радиоактивного фосфора способность клетки-реципиента к синтезу в-галактозидазы снижается. Этот результат был воспринят как доказательство того, что для синтеза фермента необходимо сохранение целостности хромосомы.
3. Заражение Е. coli вирулентными бактериофагами фН, Т2, Т4 ведет к резкому прекращению синтеза факти
чески всех бактериальных белков, в том числе и в-галактозидазы. Как известно, эти фаги вызывают деполимеризацию ДНК. В то же время при заражении Е. coli фагом который не разрушает ДНК клетки-хозяина, синтез в-галактозидазы продолжается вплоть до лизиса клетки. Эти факты рассматривали как еще одно веское доказательство того, что для синтеза белка обязательно сохранение интактной хромосомы.
4. Аналог пиримидина — 5-фторурацил — быстро включается в РНК Е. coli. Было обнаружено, что щелочная фосфатаза, синтезированная бактериальной клеткой в присутствии аналога, обладает повышенной чувствительностью к нагреванию. У штамма Е. coli с конститутивным синтезом в-галактозидазы (т. е. синтезирующего ее и без воздействия соответствующего индуктора) скорость синтеза активного фермента под влиянием 5-фторурацила быстро снижалась, но по-прежнему продолжалось образование белка, реагирующего с антисывороткой против в-галактозидазы. Решили, что этот белок представляет собой структурно модифицированную неактивную форму в-галактозидазы. По своему действию на синтез белка 5-фторурацил считался примечательным в двух отношениях. Во-первых, он почти немедленно вызывает изменение свойств белков, синтезируемых в его присутствии (именно поэтому думали, что синтез аномальных белков начинается сразу же после введения в среду аналога), и, во-вторых, степень дефектности этих белков с течением времени не изменяется.
Эти факты рассматривали как свидетельство того, что аномальны все молекулы щелочной фосфатазы или р-галактозидазы, образовавшиеся после добавления 5-фторурацила. Следовательно, по мнению исследователей, измененные молекулы не могли синтезироваться на матрицах, имевшихся в клетке до введения аналога. Если это заключение соответствует действительности, то из него со всей очевидностью вытекает, что синтез определенного белка прямо и непосредственно связан с актом транскрипции соответствующего гена.
Анализ доказательств
1. Жакоб и Моно вполне отдавали себе отчет в том, насколько слаб аргумент, основанный на предположении, что у Е. coli нет молекул РНК такой величины, чтобы содержать инструкции для координированного синтеза целой серии ферментов, катализирующих какой-либо метаболический путь. Определение молекулярной массы РНК связано с большими методическими трудностями, и поэтому даже сегодня нельзя сделать никаких определенных заключений об истинных размерах молекул некоторых типов РНК, особенно если их вторичная структура выражена слабо. Позже мне представится случай подробнее обсудить ошибки, возникающие при определении размеров молекул РНК на основании их седиментационных свойств; здесь же достаточно сказать, что идея полицистронной матрицы, т. е. матрицы, определяющей последовательность аминокислот всей группы функционально связанных ферментов, пользуется сейчас известной популярностью.
2. Более веский довод в пользу модели генетического оператора был получен при изучении клеток, получивших в результате конъюгации ген, контролирующий синтез Р-галактозидазы, а затем, как предполагалось, утративших его в результате распада радиоактивного фосфора в хромосоме. В этих экспериментах больший интерес представляют, очевидно, последствия удаления гена, а не его введения. Тот факт, что синтез р-галактозидазы начинается через 2—3 мин после введения в клетку соответствующего гена, согласуется почти с любой моделью регуляторного процесса при условии, что транскрипция начинается вскоре после того, как ген попадает в клетку-реципиент. Две или три минуты составляют примерно 1/10 всего времени генерации клетки Е. coli; следовательно, такой лаг-период, предшествующий синтезу фермента, вполне достаточен для осуществления любой формы регуляции. Более того, как указывают и сами исследователи, отнюдь не исключено, что при конъюгации не только ДНК, но и РНК может переходить из одной клетки в другую. Действительно, недавно было показано, что количество РНК, переходящей в клетку-реципиент при конъюгации, достигает 30—100% передаваемой при этом ДНК .
Сам факт, что синтез в-галактозидазы в клетке-реципиенте сразу же достигает максимальной скорости, тоже ничего не говорит нам о том, где осуществляется регуляция этого процесса. По мнению Жакоба и Моно, это можно объяснить либо тем, что синтезируемые на гене матрицы имеют очень небольшую продолжительность жизни, либо тем, что образуется лишь ограниченное число матриц, после чего ген перестает функционировать. Однако такие соображения приемлемы только в том случае, если число матриц строго пропорционально количеству синтезируемого фермента. Но как раз этого-то мы и не знаем. Известно, что в цитоплазме животных и растительных клеток матрицы могут храниться длительное время не функционируя. Поэтому, когда происходит синтез какого-либо белка, мы не можем с полной определенностью сказать, все ли соответствующие матрицы транслируются в цитоплазме или же только часть их. И мы, разумеется, не знаем, только ли числом матриц, имеющихся в клетке, определяется максимальная скорость синтеза данного белка.
Опыты, в которых бактериальная хромосома, содержащая ген для в-галактозидазы, разрушается при распаде радиоактивного фосфора, в сущности аналогичны опытам по энуклеации клеток высших организмов.У высших организмов синтез специфичных белков продолжается, как правило, и после удаления ядра, причем во многих случаях было показано, что этот процесс может регулироваться безъядерной цитоплазмой. На первый взгляд результаты опытов с разрушением хромосомы радиоактивным фосфором свидетельствуют о том, что у бактерий это не так, по крайней мере в случае в-галактозидазы Е. coli. В опытах Жакоба и Моно зигота, получившая радиоактивную хромосому с геном для в-галактозидазы, в результате распада радиоактивного фосфора быстро теряла способность синтезировать фермент.
Однако Макфолл повторил эти опыты и показал, что результат их можно интерпретировать по-иному. Дело в том, что при изучении действия радиоактивного распада клетки на какое-то время замораживают и затем для определения активности фермента вновь оттаивают. Чтобы клетки в процессе замораживания и оттаивания не разрушались, в среду обычно добавляют глицерин; именно так было сделано в опытах Жакоба и Моно. Но клетки Е. coli могут использовать глицерин в качестве источника углерода, и поэтому глицерин, как и любой другой источник углерода, подавляет индукцию синтеза в-галактозидазы. Это явление называли сначала «глюкозным эффектом», а теперь обычно описывают как пример «репрессии катаболитом». Макфолл показал, что, если вместо глицерина добавить в среду гликоль, который не может использоваться в качестве источника углерода, синтез в-галактозидазы в зиготе оказывается относительно устойчивым к распаду радиоактивного изотопа, включенного в хромосому. Даже когда жизнеспособность микроорганизма снижается до 0, 1%, синтез в-галактозидазы может осуществляться со скоростью, составляющей 25% нормальной.
Такой же результат получили при исследовании щелочной фосфатазы. Итак, опыты по передаче радиоактивной хромосомы не только не показали, что для синтеза белка необходима целостность хромосомы, но, наоборот, выявили, что даже после разрушения хромосомы может идти вполне активный синтез. Эти опыты показали также, что продолжающийся синтез фермента все еще чувствителен к регуляции, так как он прекращается под действием катаболита. Таким образом, поведение бактериальной клетки, из которой хромосома «удалена» в результате распада радиоактивного фосфора, в принципе не отличается от поведения энуклеированных клеток высших организмов — в обоих случаях в клетках продолжается регулируемый синтез белков. Конечно, опыты с радиоактивным распадом гораздо менее убедительны, чем опыты по энуклеации клеток высших организмов, так как никогда нет полной уверенности в том, что разрушен именно тот ген, который нас интересует; кроме того, нам не известно, как сказываются на изучаемой физиологической функции вторичные эффекты облучения. И в самом деле, не так давно было показано, что распад в хромосоме радиоактивного фосфора не нарушает транскрипцию ДНК и синтез ферментов, но оказывает сильное воздействие на репликацию ДНК и размножение клеток.
3. Довод, основанный на том, что фаг Л и Т-четные фаги по-разному действуют на бактериальную клетку, также может быть опровергнут. Установлено, что деполимериза
ция бактериальной ДНК, вызываемая Т-четными фагами, — это вторичный и сравнительно поздний эффект [17]. Т-четные фаги подавляют синтетические процессы в бактериальной клетке даже в тех случаях, когда показано, что бактериальная ДНК еще не повреждена. Более того, неинфекционные «тени» фага Т2 (оболочки, не содержащие нуклеиновой кислоты) способны ингибировать синтез белков. Процесс этот обратим и не сопровождается деградацией бактериальной ДНК. Пока еще не ясно, с помощью какого механизма Т-четные фаги ингибируют синтез белка в чувствительной к ним бактериальной клетке, и мы не можем с достаточной определенностью сказать, на каком уровне происходит первичное воздействие этих фагов на синтез белка. Однако различия между фагами, очень резко подавляющими синтез бактериальных белков, и фагами, не подавляющими этот синтез, без сомнения, нельзя использовать как подтверждение гипотезы о том, что для синтеза белков обязательно сохранение интактной бактериальной хромосомы.
4. Наконец мы подошли к очень сложной проблеме механизма действия 5-фторурацила. Жакоб и Моно установили, что 5-фторурацил оказывает фактически немедленное действие, вызывая образование в клетке гомогенной популяции молекул аномального белка. Однако результаты исследований щелочной фосфатазы, на которые они ссылаются, показывают, что даже в нормальных условиях началу синтеза предшествует довольно длительный лаг-период. В присутствии аналога продолжительность лаг-периода достигает 30 мин, что приблизительно соответствует времени одной генерации Е. coli. Что касается в-галактозидазы, то в присутствии аналога синтез этого фермента вообще не индуцируется. Таким образом, все имеющиеся сведения ограничиваются конститутивным штаммом Е. coli, в котором 5-фторурацил не полностью подавляет синтез фермента. В этом конститутивном штамме в присутствии аналога скорость синтеза активной в-галактозидазы снижается до 20%, однако при этом образуются очень большие количества белка (или белков), не обладающего ферментативной активностью, но дающего тем не менее перекрестную реакцию с антисывороткой против в-галактозидазы. На основании этого было высказано предположение, что перекрестно реагирующий белок — это структурно измененная, неактивная форма в-галактозидазы, образовавшаяся под действием 5-фторурацила.
Однако возможны и другие интерпретации. Известно, например, что даже в нормальных условиях, т. е. в отсутствие 5-фторурацила, клетки Е. coli синтезируют большое количество неактивного белка, реагирующего с антисывороткой против в-галактозидазы (так называемые PZ-белки). О свойствах этого перекрестно реагирующего белка, образующегося в присутствии 5-фторурацила, известно очень мало, поэтому пока не ясно, представляет ли он собой дефектную форму фермента или нечто совсем другое. Результаты недавних исследований воздействия 5-фтор-урацила на индуктивный синтез в-галактозидазы у Е. coli показали, что подавление синтеза этого фермента обусловлено не образованием дефектных матриц, а накоплением продуктов промежуточного обмена углеводов, т. е. в данном случае наблюдается репрессия катаболитами. Если устранить эту репрессию, то в присутствии 5-фторурацила, несмотря на его включение в РНК, синтезируется совершенно нормальный фермент.
В других исследованиях было обнаружено, что у растущих бактерий более половины урацила, входящего в состав РНК, можно заменить на 5-фторурацил, не вызвав при этом никаких нарушений обмена веществ: правда, клетки начинают делиться медленнее, но при этом соответственно снижается и суммарная скорость синтеза белка. Таким образом, в любом случае совсем непросто сделать какие-либо выводы о механизме действия веществ, подобных 5-фторурацилу. Сегодняшнее состояние наших знаний не позволяет решить, обусловлено ли изменение свойств определенного фермента включением аналога в соответствующую матрицу, или же это результат каких-то побочных явлений. И в-галактозидаза, и щелочная фосфатаза — мультимерные ферменты, которые представлены в цитоплазме клетки целым рядом молекулярных форм. Изменение температурной чувствительности или других свойств этих ферментов на самом деле может объясняться вторичными изменениями, связанными с изменениями их физического состояния. Имеющаяся в нашем распоряжении обширная литература убедительно свидетельствует о сложной природе явлений, которые возникают в клетке под воздействием аналогов оснований нуклеиновых кислот.
Негативный контроль, оперон и репрессор
В то время, когда Жакоб и Моно предложили модель генетического оператора, считалось, что карта генетической области, контролирующей биосинтез в-галактозидазы, состоит из пяти локусов: три из них, по-видимому, структурные гены, определяющие первичную структуру в-галактозидазы (ген z), галактозид — пермеазы (ген у) и галактозид — трансацетилазы (ген а), тогда как два других гена (i и о) участвуют в регуляции активности структурных генов. В результате мутации в локусе i нарушается индуцибельность синтеза в-галактозидазы под воздействием экзогенных индукторов, тогда как мутации локуса о (оператора) затрагивают функцию всей группы структурных генов. При картировании этой области хромосомы был выявлен следующий порядок расположения генов: iozya, Позже обнаружили еще один локус, который, по-видимому, либо регулирует транскрипцию структурных генов, либо каким-то образом облегчает этот процесс. Его назвали локусом р (промотор) и предположили, что он расположен между генами о и z. Полная генетическая карта этой области представлялась, следовательно, таким образом: iopzya. Эту тесно сцепленную группу генов, участвующих в биосинтезе в-галактозидазы, назвали лактозным опероном (Zac-опероном). Впоследствии термин «оперон» стали использовать для обозначения любой тесно сцепленной последовательности генов, которые определяют синтез группы ферментов для какого-либо одного метаболического пути и регулируются координированно как единое целое.
Мысль о том, что функциональное проявление бактериальных генов контролируется специфичными репрессорами, первоначально возникла под влиянием опытов по скрещиванию штаммов Е. coli, мутантных по локусу i. Штаммы Е. coli дикого типа синтезируют в-галактозидазу только тогда, когда в среде имеются галактозиды или некоторые их структурные аналоги. Такие штаммы называют индуцибельными по в-галактозидазе и обозначают i+. Существуют, однако, такие мутации локуса i, в результате которых микроорганизм приобретает способность синтезировать большие количества в-галактозидазы и без экзогенных индукторов. Такие мутантные штаммы называют конститутивными и обозначают i-. При конъюгации организмов i+ и i- возникают гетерогеноты неспособные синтезировать в-галактозидазу в отсутствие индуктора.
Таким образом установили, что способность к синтезу фермента только под воздействием индуктора (индуцибельность) доминирует над способностью к синтезу в отсутствие индуктора (конститутивный синтез). О ферментах, синтез которых невозможен без индуктора, говорят, что они находятся под негативным контролем. Для объяснения механизма негативного контроля Жакоб и Моно высказали предположение, что продукт гена i представляет собой специфичный репрессор, ингибирующий функцию всего Zac-оперона. Сначала природа этого репрессора не была определена, но со временем предложили более или менее конкретную модель, согласно которой репрессор — это белок, способный специфично связываться с локусом о oпeрона и подавлять, таким образом, транскрипцию всей группы генов, участвующих в синтезе р-галактозидазы.
С тех пор как Жакоб и Моно выдвинули гипотезу репрессора, появилось огромное количество работ по генетике и физиологии Zac-оперона, но ни в одной из них не удалось идентифицировать этот специфичный репрессор или получить более достоверные сведения о механизме его действия. Однако в 1966 году Жильбер и Мюллер-Хилл, применив метод равновесного диализа, обнаружили в экстрактах Е. coli следы белка, характеризующегося ярко выраженной способностью связываться с индуктором в-галактозидазы — изопропилтиогалактозидом. После частичной очистки этого белка оказалось, что он обладает высоким сродством к ДНК бактериофага, несущего Zac-гeны Е. coli, но не связывается с ДНК бактериофага, не включившего этих генов. Сродство этого белка к ДНК Zac-оперона менялось под влиянием мутаций, затрагивающих, по-видимому, локус о. Таким образом, опыты Жильбера и Мюллер-Хилла показали, что существует белок, контролируемый, очевидно, геном i, который взаимодействует как с экзогенным индуктором, так и с локусом о lac-оперона. Отсюда был сделан вывод, что этот белок и есть тот самый репрессор, существование которого предсказали Жакоб и Моно, и что он действует именно так, как они предполагали, т. е. специфично связывается с оператором Zac-оперона.
Результаты этих экспериментов послужили веским доказательством в пользу модели генетического оператора, по крайней мере в отношении регуляции синтеза в-галактозидазы у Е. coli. Однако не все здесь ясно. Начать хотя бы с того, что при более тщательном генетическом анализе обнаружили несколько иную последовательность генов в Zac-опероне: не iopzya, как считалось ранее, a ipozya, т. е. что ген-промотор, который, как предполагалось, определяет скорость транскрипции всего Zac-оперона, расположен перед оператором (о). Так как транскрипция начинается с локуса р или рядом с ним, то при этом должен транскрибироваться и локус о. Это означает, что все РНК, образующиеся при транскрипции Zac-оперона, обязательно содержат участок, последовательность оснований которого гомологична ДНК локуса о.
При трансляции этой РНК участок, соответствующий локусу о, будет также транслироваться, и, следовательно, часть молекулы в-галактозидазы или какого-нибудь другого белка будет отражать последовательность его оснований. Но так как РНК, соответствующая локусу о, обычно не транслируется, о чем свидетельствуют многочисленные данные, приходится заключить, что матричная РНК, считанная с оперона, начинается с нетранслируемой области, соответствующей локусу о. Но тогда трудно представить себе, зачем нужен такой нетранслируемый участок, если он не играет никакой регуляторной роли при трансляции матрицы. Поэтому необходимо учитывать, что продукт гена i в интактной клетке может взаимодействовать с областью оператора в молекуле РНК и таким образом осуществлять контроль на уровне трансляции. На это можно возразить, что белок-репрессор, изученный Жильбером и Мюллер-Хиллом, связывается только с двухцепочечной ДНК, а не с одноцепочечной денатурированной ДНК. Однако структура ДНК при денатурации резко нарушается и становится в высшей степени неупорядоченной, тогда как мы можем с уверенностью сказать, что матричные РНК, хотя они и одноцепочечные, не могут находиться в цитоплазме в неупорядоченном состоянии, поскольку иначе их трансляция была бы невозможна. Более того, из факта доминантности индуктивного синтеза над конститутивным еще не следует, что негативный контроль является абсолютным правилом. Группы ферментов, участвующие в использовании мальтозы, L-рамнозы, L-арабинозы и в восстановлении сульфата у Е. coli, находятся под «позитивным» контролем: в этих случаях конститутивный синтез доминирует над индуктивным. И действительно, даже в Zac-опероне обнаружили мутации i-, приводящие к доминированию конститутивного синтеза.
Для того чтобы объяснить явление позитивного контроля р-галактозидазы исходя из взаимодействия репрессора и оператора, была предложена гипотеза комплементации субъединиц нормального и мутантного репрессора. Согласно этой гипотезе, любые комбинации нормальных субъединиц с мутантными дают дефектный репрессор, поэтому при избыточном синтезе мутантных субъединиц образуется очень мало молекул нормального репрессора. Именно этим объясняется преобладание конститутивного синтеза. Такое объяснение пригодно, однако, не для всех случаев. Так, известно, что в системе L-арабинозы способность к конститутивному синтезу доминирует даже у мутантов с делецией регуляторного гена. Это опровергает предположение о том, что позитивный контроль связан с образованием дефектных субъединиц репрессора.
По-видимому, есть основания утверждать, что по крайней мере в некоторых случаях позитивного контроля действие регуляторных генов состоит не в синтезе специфичного репрессора, а в стимуляции или облегчении проявления структурных генов. Однако вопрос о том, на каком уровне — трансляции или транскрипции — происходит эта стимуляция, пока остается открытым. Еще большие трудности возникают при анализе репрессии катаболитами. Известно, что у мутантов Е. coli с делецией i-, о- и p-генов сохраняется тем не менее чувствительность к репрессии катаболитами синтеза в-галактозидазы. Следовательно, система репрессор — оператор может не участвовать в регуляции синтеза в-галактозидазы, но, поскольку такая регуляция наблюдается даже в тех случаях, когда утрачены все регуляторные локусы Zac-оперона, вполне вероятно, что эта регуляция происходит на уровне трансляции.
Существование у бактерий механизмов, регулирующих трансляцию, не вызывает сомнений. Вероятно, самое убедительное доказательство этого было получено при исследовании РНК-содержащих бактериофагов. Последовательность оснований РНК каждого такого бактериофага определяет структуру 3—4 белков. При трансляции этой РНК в бактериальной клетке белки фага синтезируются не одновременно и в разных количествах. Более того, эти различия во времени и скорости синтеза разных белков можно обнаружить даже тогда, когда РНК фага транслируется in vitro в бесклеточной системе, т. е. в условиях, исключающих возможность регуляции на любом уровне, кроме трансляции. Если фаг несет полярную мутацию, то она проявляется и при трансляции его РНК in vitro. (Полярной называется мутация, которая затрагивает не только тот ген, в котором она возникла, но снижает также активность соседних генов. )
Анализ полярных мутаций в Zac-опероне и в оперонах, контролирующих синтез триптофана и гистидина, также выявил участие механизмов, регулирующих трансляцию. В случае Zac-оперона было обнаружено, что структурные белки синтезируются в разных количествах, причем в зависимости от температуры их количественное соотношение может меняться. Изучение полярных мутаций, повреждающих только z-или z- и у-гены Zac-оперона, показало, что проявление гена а зависит от того, произошла ли трансляция РНК, синтезированной на гене у. Было также показано, что мутации в гене z, которые ведут к преждевременному прекращению его транскрипции, не препятствуют проявлению других генов оперона, но при этом синтез полипептида может вновь начаться с последовательности РНК, соответствующей гену у, или с какого-либо другого участка. Если активность триптофанового оперона подавить с помощью экзогенного триптофана, то синтез ферментов, за которые ответственны проксимальные гены оперона, быстро прекращается, тогда как ферменты, определяемые дистальными генами, продолжают синтезироваться еще целых 13 мин. Когда гистидиновый оперон ингибируют с помощью экзогенного гистидина, прекращение синтеза ферментов, определяемых этим опероном, происходит в том же порядке, в каком расположены на хромосоме соответствующие структурные гены. Но если в первом гене этой цепи возникнет мутация, в результате которой теряется чувствительность к нормальному ингибированию конечным продуктом, то под воздействием экзогенного гистидина синтез всех ферментов подавляется одновременно. Эти эффекты полярности в лактозном, триптофановом и гистидиновом оперонах настолько сильно напоминают эффекты, обнаруженные у РНК-содержащих бактериофагов, что, вероятно, в основе тех и других лежат однотипные регуляторные механизмы. Во всяком случае ясно, что все эти явления нельзя объяснить одной только регуляцией на уровне транскрипции. Большинство исследователей, основываясь на экспериментах Жильбера и Мюллер-Хилла, считают, что индукция галактозидами синтеза (3-галактозидазы у Е. coli в каком-то звене обязательно контролируется именно на уровне транскрипции. Однако трудно отказаться от мысли, что любые регуляторные механизмы, действующие на уровне транскрипции, противоречат более важным и более гибким регуляторным механизмам, действующим на стадии трансляции.
Таким образом, нет оснований соглашаться с предположением о том, что у бактерий синтез белка регулируется преимущественно на уровне генов, тогда как в клетках высших организмов этот синтез главным образом регулируется цитоплазматическими механизмами. В обоих случаях, очевидно, преобладает цитоплазматическая регуляция. Вполне возможно, что у бактерий в связи с необходимостью быстрой адаптации к изменениям условий питания возникли какие-то специальные формы контроля транскрипции. Клетки высших животных и растений обычно не подвергаются столь резким изменениям условий среды, и в них можно индуцировать лишь слабые и очень медленные (по сравнению с бактериями) изменения скорости синтеза ферментов. Тем не менее механизмы, контролирующие транскрипцию, имеются и в высших клетках, но, как я покажу позже, они имеют очень мало общего с моделью циркуляции репрессора, предложенной для бактерий.
Стабильность матриц у бактерий
Один из наиболее важных выводов, к которому можно прийти, исходя из модели генетического оператора, и который особо подчеркивали Жакоб и Моно, состоит в том, что продолжительность жизни матрицы для синтеза белков должна быть очень короткой. Если бы синтез белков регулировался только на уровне транскрипции ДНК, то матричные РНК должны были бы очень быстро распадаться: если же это не так, то выключение какого-нибудь гена не приведет к немедленному прекращению синтеза соответствующего белка. Этот вывод, в основе которого лежит модель генетического оператора, опять полностью противоречит тому, что наблюдается в растительных и животных клетках. Как мы уже знаем, при исследовании энуклеированных клеток эукариотов была обнаружена необычайно высокая стабильность матриц для синтеза белков: продолжительность их жизни может измеряться месяцами и даже в неблагоприятных условиях составляет не менее нескольких часов. Следует еще раз отметить, что эти подсчеты касаются минимальных сроков.
В энуклеированной клетке белковый синтез в целом, так же как и сиптез какого-либо одного белка, может прекратиться по причинам, не имеющим никакого отношения к распаду матриц. И если продолжение синтеза белка неизбежно свидетельствует о том, что матрица все еще интактна, то прекращение синтеза вовсе не свидетельствует о ее разрушении. Если бы удалось доказать, что у бактерий продолжительность жизни матриц для синтеза белков действительно очень невелика и что аналогичные матрицы в клетках высших организмов, наоборот, очень устойчивы, то это был бы еще один вывод чрезвычайной важности, поскольку он означал бы, что между бактериями и высшими клетками существуют принципиальные различия в структуре матриц или в системе ферментов, разрушающих эти матрицы.
Прежде чем приступить к сколько-нибудь серьезному обсуждению продолжительности жизни матриц, необходимо уточнить термины «короткоживущие» и «долгоживущие» матрицы. Конечно, продолжительность жизни матрицы можно выразить в абсолютных величинах: столько-то минут, столько-то часов или столько-то дней. Но это мало что дает, поскольку продолжительность жизненного цикла у разных клеток весьма различна. Так, время генерации Е. coli при оптимальных условиях составляет примерно 30 мин, минимальное время генерации животной клетки, растущей in vitro, 8—10 ч, продолжительность жизни Aceiabularia mediterranea приблизительно 3 мес, а малый лимфоцит человека, не делясь, может существовать в организме более 15 лет.
Если исходить из времени генерации, то 3 мин для Е. coli могут соответствовать 1 ч жизни клетки животного в культуре или 10 дням жизни ацетабулярии. Таким образом, различия в продолжительности жизни матриц у столь разных организмов могут быть просто следствием более медленной работы регуляторных механизмов в медленно растущих клетках, а вовсе не свидетельствовать о том, что во всех этих клетках функционируют разные типы регуляторных механизмов. Суть проблемы, таким образом, заключается в следующем: действительно ли для репрессии синтеза белка необходимо разрушение соответствующих матриц?
Согласно модели генетического оператора, синтез белка в клетке прекращается потому, что разрушается его матрица, а так как эта модель требует, чтобы продолжительность жизни матрицы была короткой по сравнению с временем генерации клетки, то, следовательно, матрицы должны постоянно обновляться и скорость их синтеза должна быть значительно выше, чем необходимо лишь для роста клетки. Вопрос, следовательно, сводится к тому, действительно ли продолжительность жизни матрицы составляет именно такой промежуток времени, который необходим для репрессии синтеза какого-либо исследуемого белка. Если, например, синтез в-галактозидазы прекращается в течение 2—3 мин после удаления из среды индуктора или введения в нее другого источника углеводов, то в соответствии с моделью генетического оператора продолжительность жизни матриц для этого фермента не может превышать 2—3 мин. Мы знаем, что эта модель не в состоянии объяснить регуляцию синтеза ферментов в клетках высших организмов, поскольку матрицы в таких клетках могут длительное время сохраняться интактными и регуляторные механизмы способны контролировать их трансляцию спустя длительное время после удаления ядра. Следовательно, необходимо выяснить, играет ли быстрое разрушение матриц существенную роль в работе механизмов, управляющих синтезом ферментов у бактерий.
Основной недостаток бактерий как объекта изучения при решении подобных вопросов состоит в том, что у них нет четко выраженного ядра, а значит, и удаление ядра невозможно. Поэтому все исследования такого рода на бактериях ограничиваются непрямыми методами «физиологической» энуклеации либо в результате распада в хромосоме радиоактивного изотопа, либо с помощью высоких концентраций актиномицина D. И если для изучения механизмов регуляции метод с применением радиоактивного изотопа использовался лишь в нескольких работах, то актиномицин D нашел очень широкое применение. Нет нужды говорить, что литература, посвященная использованию этого антибиотика, весьма противоречива и запутанна, так как, с одной стороны, актиномицин D оказывает меньший эффект, чем энуклеация, потому что он не полностью подавляет активность генов, а с другой — актиномицин вызывает в клетке глубокие и сложные вторичные эффекты.
Я думаю, не стоит подробно обсуждать результаты определения продолжительности жизни разных матриц, основанные на снижении скорости синтеза соответствующих белков в присутствии актиномицина D. Согласно этим данным, продолжительность жизни матриц для в-галактозидазы у Е. coli колеблется от 2—3 мин до периода, соответствующего времени генерации клетки или даже превышающего его. Продолжительность жизни матриц варьирует в широких пределах у разных организмов, и даже у одного и того же организма она меняется в зависимости от условий культивирования.
Кинетика подавления белкового синтеза в присутствии актиномицина D также чрезвычайно разнообразна: в некоторых случаях этот процесс описывается простой экспоненциальной функцией, в других — составлен по крайней мере из двух, а быть может, и большего числа экспонент , а иногда кривая, описывающая этот процесс, имеет многоударный характер, из чего следует, что наблюдаемый эффект возникает в результате нескольких независимых событий. Началу подавления синтеза всегда предшествует лаг-период, продолжительность которого тоже очень изменчива. Боюсь, что результаты этих опытов по определению продолжительности жизни матриц нельзя считать хоть сколько-нибудь достоверными до тех пор, пока не будет доказано, что снижение скорости синтеза белка происходит исключительно за счет разрушения матриц и не связано ни с чем иным.
Матрицы с разной стабильностью
Разнообразие скоростей подавления синтеза разных белков в присутствии актиномицина D послужило причиной модификации модели генетического оператора, заслуживающей специального обсуждения. Если первоначальная модель Жакоба и Моно утверждает, что продолжительность жизни всех матриц должна быть очень короткой, то недавно было высказано предположение, согласно которому матрицы могут иметь разную стабильность, и именно благодаря этим различиям механизмы регуляции синтеза соответствующих белков приобретают большую гибкость. Предполагалось, что ферменты, скорость синтеза которых подвержена быстрым изменениям (например, в-галактозидаза в индуцибельных штаммах Е. coli), имеют короткоживущие, нестабильные матрицы, тогда как ферменты, скорость синтеза которых изменяется медленней (например, пенициллиназа у Bacillus cereus), имеют матрицы с большей продолжительностью жизни. Основной довод, подтверждающий это предположение, состоял в том, что под воздействием актиномицина D наблюдалась различная скорость подавления синтеза разных ферментов, отражающая, как думали, продолжительность жизни соответствующих матриц. Эти общие соображения позволяют нам прийти к частному выводу о том, что у организмов с индуцибельным синтезом какого-то фермента матрицы должны быть короткоживущими и, наоборот, они должны быть очень стабильными, долгоживущими в организмах, где данный фермент синтезируется конститутивно. Подобная модель все еще исходит из предположения, что механизмы, управляющие синтезом белков, действуют в основном на уровне транскрипции ДНК, но она тем не менее допускает, что быстрота изменения скорости синтеза, а следовательно, и гибкость контроля определяются продолжительностью жизни матрицы.
Сейчас еще очень трудно проверить эту модель экспериментально. Пока что только в исключительных случаях, когда необычайно благоприятные генетические условия позволяют применить метод гибридизации ДНК и РНК, удается достаточно точно идентифицировать матрицу для определенного белка. Но даже в этих случаях попытки прямого определения продолжительности жизни матрицы встречают серьезные осложнения. Почему это так, станет ясно в следующей главе, где обсуждается кинетика обмена РНК. По моему мнению, существуют веские доводы, которые не позволяют согласиться с тем, что в основе механизмов регуляции синтеза белка лежат различия в продолжительности жизни матричных РНК.
Если допустить, что продолжительность жизни матриц может варьировать в широких пределах, то сразу же встает вопрос о том, с помощью каких механизмов достигаются эти различия. Мне кажется, что такая вариабельность могла бы обеспечиваться одним из трех следующих способов:
1) возможно, что в структуре матриц имеются какие-то различия, определяющие неодинаковую их чувствительность к разрушению цитоплазматическими ферментами;
2) кроме того, для каждого типа матричных РНК может существовать набор специфичных ферментов, которые разрушают их с разной скоростью, и, наконец, 3) матрицы могут быть защищены от действия этих ферментов, но защищены не в одинаковой степени. Ни одна из этих альтернатив не кажется мне полностью приемлемой.
Наши знания о связи между структурой рибонуклеиновых кислот и их чувствительностью к действию рибонуклеаз не позволяют надеяться на то, что незначительные различия в последовательности оснований могут привести хоть к сколько-нибудь заметным различиям в чувствительности матриц к действию ферментов. Насколько нам сейчас известно, наличие двойной спирали, отсутствие пиримидиновых или одного из пуриновых оснований, метилирование сахара и природа концевых групп — вот в сущности все те структурные особенности, которые могут влиять на устойчивость полирибонуклеотидов к действию нуклеаз. Поскольку все активные матрицы в любом случае должны функционировать именно как матрицы, кажется маловероятным, что они могут иметь весьма значительные различия во вторичной структуре. Метилирование рибозы, отсутствие пиримидиновых или одного из пуриновых оснований не свойственно для природных полирибонуклеотидов. Можно, правда, предположить, что защитную роль играют последовательности оснований на концах некоторых матриц, благодаря чему матрицы могут успешно противостоять действию как экзо-, так и эндонуклеаз с различной биохимической специфичностью. Однако такие различия в структуре ни в коем случае не могут обеспечить предполагаемых различий в стабильности матриц для конститутивной и индуцибельнон форм одного и того же фермента, поскольку первичная структура их матриц должна быть идентичной.
Для осуществления второй возможности необходимо гораздо большее число нуклеаз, чем сейчас известно, причем они должны обладать большей специфичностью. Но даже если в конце концов будет обнаружено множество высокоспецифичных ферментов, то с помощью этой схемы все равно не удастся объяснить предполагаемую разную стабильность матриц для синтеза конститутивной и индуцибельной форм одного и того же белка.
Хорошо известно, что транслирующиеся матрицы каким-то образом охраняются от разрушительного действия ферментов [53, 54], правда, формы этой защиты неспецифичны. Следовательно, продолжительность жизни тех матриц, на которых идет активный синтез белка, совсем не так мала. Любая модель, основанная на специфичной защите матриц, должна исходить из того, что либо способ защиты разных матриц неодинаков, либо степень соответствия матрицы и защищающей ее молекулы может быть разной. Первая альтернатива снова предполагает существование целой «армии» высокоспецифичных и до сих пор не обнаруженных белков; из второй альтернативы следует, что матрицы должны сильно отличаться друг от друга по вторичной и третичной структуре.
Представление о различных способах защиты слишком неопределенно, чтобы его можно было анализировать всерьез, и, по-моему, оно ведет к еще большим концептуальным трудностям, чем то предположение, ради объяснения которого его выдвинули. Несомненно, что в определенных условиях матричные РНК, содержащиеся в клетке, могут разрушаться и что в разных частях клетки этот процесс может происходить с неодинаковой скоростью. Однако, прежде чем восторгаться идеей, что именно различия в стабильности матриц составляют основу некоего общего механизма регуляции синтеза белков, необходимо предложить более правдоподобные механизмы, чем те, которые я смог здесь изложить.
Сравнение бактерий и клеток эукариотов
Термин «оперон» подразумевает, что функциональное значение сцепления генов, ответственных за синтез ферментов какого-либо одного метаболического пути, состоит в возможности координированной регуляции синтеза этих ферментов. Однако это не совсем так, поскольку координированная регуляция синтеза метаболически связанных ферментов может осуществляться независимо от того, насколько тесно сцеплены соответствующие структурные гены. Это относится не только к клеткам высших организмов, у которых пространственное объединение генов, ответственных за синтез группы ферментов какого-либо одного метаболического пути, может быть скорее исключением, чем правилом, но также и к бактериям. Даже у Е. coli гены, определяющие синтез функционально связанных ферментов, могут быть сцеплены (Zac-оперон), пространственно разобщены (ферменты пути биосинтеза пролина ) или же частично сцеплены и частично разобщены (ферменты, участвующие в синтезе аргинина). И тем не менее регуляция синтеза всех этих групп ферментов происходит координированно, без каких-либо затруднений. Отсюда ясно, что для координированной регуляции сцепление генов не обязательно.
Альтернативное объяснение состоит в том, что сцепление метаболически связанных генов способствует объединению ферментов, которые обычно функционируют вместе как единый многокомпонентный комплекс. Однако далеко не все метаболически связанные ферменты образуют такие сложные структурные комплексы. Еще одно объяснение состоит в том, что пространственное объединение генов может обеспечивать селективное преимущество тем организмам, у которых половое размножение осуществляется путем передачи единственной хромосомы из одной клетки в другую. Эта форма полового размножения, характерная для бактерий, связана с большим риском, так как во время конъюгации может произойти разрыв хромосомы. По-видимому, тесное сцепление генов служит одним из способов, значительно снижающих частоту таких разрывов, в результате которых в клетку-реципиент может попасть неполный набор функционально связанных генов.
Следовательно, у организмов с иной формой полового размножения тесное сцепление метаболически связанных генов должно встречаться гораздо реже, и, по-видимому, это действительно так. Во всяком случае, ясно, что биологический смысл тесного сцепления функционально связанных генов сложнее, чем это подразумевают, когда пользуются термином «оперой»; вероятно, исходя из принципов эволюционной теории, мы найдем более удовлетворительное объяснение этому явлению, чем на основе представлений о регуляции обмена веществ.
Попытки выяснить, в какой мере отличаются друг от друга механизмы регуляции синтеза белков у бактерий и клеток высших организмов, увенчаются успехом только тогда, когда появится возможность сравнить одну и ту же систему реакций в двух типах клеток. Конечно, это совсем не так просто. Наиболее полные сведения о регуляции синтеза белков у бактерий были получены в результате изучения чрезвычайно быстрых изменений скорости синтеза ферментов, определяемых группой тесно сцепленных генов. В клетках высших животных и растений подобных явлений может не наблюдаться. Даже для самых незначительных изменений количества ферментов, участвующих в обычных метаболических путях в клетках высших организмов, требуется несколько часов или даже дней; гены, ответственные за синтез таких ферментов, как правило, не связаны в единые группы.
В клетках высших организмов очень трудно обнаружить процесс, подобный индукции синтеза в-галактозидазы у Е. coli. Существует, однако, два строго регулируемых процесса, которые можно наблюдать и в бактериальных и в эукариотических клетках; процессы эти — образование спор и их прорастание. Споры, или биологически эквивалентные образования, при определенных условиях возникают у очень многих видов растений, причем закономерности образования спор у этих эукариотических организмов во многом сходны с тем, что наблюдается у бактерий. И у бактерий, и у многих эукариотов сложная последовательность биохимических и морфологических изменений приводит к образованию клеток, покрытых оболочкой, необычайно устойчивой к резким изменениям условий окружающей среды и обеспечивающей выживание этих клеток до тех пор, пока условия вновь не станут благоприятными для роста.
Образование зонтика у ацетабулярии, в котором развиваются цисты, содержащие гаметы, и формирование плодовых тел у некоторых миксомицетов в сущности сходные процессы. Я уже достаточно подробно обсудил опыты, проведенные на энуклеированных клетках ацетабулярии. Эти опыты показали, что для такого сложного процесса, как образование зонтика, присутствие ядра совсем не обязательно. Вся необходимая информация передается в цитоплазму задолго до момента ее реализации; биохимические процессы, приводящие к формированию зонтика, контролируются цитоплазматическими регуляторными механизмами ничуть не хуже, чем в присутствии соответствующих генов. Тем же закономерностям, по-видимому, подчиняется формирование плодовых тел у слизевика Dictyostelium и образование спор у бактерий. Ни в одном из этих двух последних случаев энуклеация невозможна, однако результаты, полученные с помощью актиномицина D, почти не оставляют сомнений в том, что в основе указанных двух процессов лежат те же механизмы, которые обеспечивают формирование зонтика у ацетабулярии. В обоих случаях синтез специфичных белков, необходимых для морфологической дифференцировки, может начаться спустя много часов после подавления синтеза РНК с помощью высоких доз актиномицина D .
Анализ этих опытов показал, что информация для любой стадии образования спор или образования плодовых тел передается в цитоплазму задолго до того, как это событие происходит в действительности. У бактерий, так же как и у эукариотов, трансляция матриц, контролирующих процесс образования спор, инициируется и регулируется механизмами, которые вступают в действие спустя большой промежуток времени после транскрипции соответствующих генов. Это в равной мере справедливо и для процесса прорастания, при котором споры, цисты или семена начинают вегетативный рост. Прорастание семян пшеницы вызывает волну белкового синтеза, который может продолжаться в течение 24 ч, несмотря на то что при этом не происходит сколько-нибудь заметного синтеза РНК. Данные о влиянии актиномицина D на прорастание микроцист у миксобактерий Myxococcus xanthus также свидетельствуют о том, что информация, необходимая для прорастания, попадает в цитоплазму по крайней мере за 4—5 ч до ее проявления.
Таким образом, регуляция двух важнейших процессов в бактериальных клетках и в клетках высших организмов подчиняется тем же основным закономерностям, которые были выявлены при изучении ацетабулярии. При образовании спор и при прорастании тесная связь между временем транскрипции гена и временем трансляции соответствующей матрицы совсем не обязательна не только для клеток высших организмов, но и для бактерий. Инициация синтеза белков, специфичных для этих двух форм дифференцировки, а также обеспечение последующего синтеза этих белков происходит в цитоплазме клетки, а не на уровне транскрипции генов.
Используемая литература: Г. Харрис
Перевод с английского: М. И. Маршак
Ядро и цитоплазма: под ред. и с предисловием д-ра биол. наук Н. И. Шапиро
Москва 1973 год.
Скачать реферат:
Пароль на архив: privetstudent.com